Слайд 2ТРАНСЛЯЦИЯ
Перевод генетической информации мРНК, записанной с помощью четырех нуклеотидов, в первичную структуру

белка (полипептид), записанную с помощью 20 аминокислот
(экспрессия гена).
Трансляция идет в рибосомах.
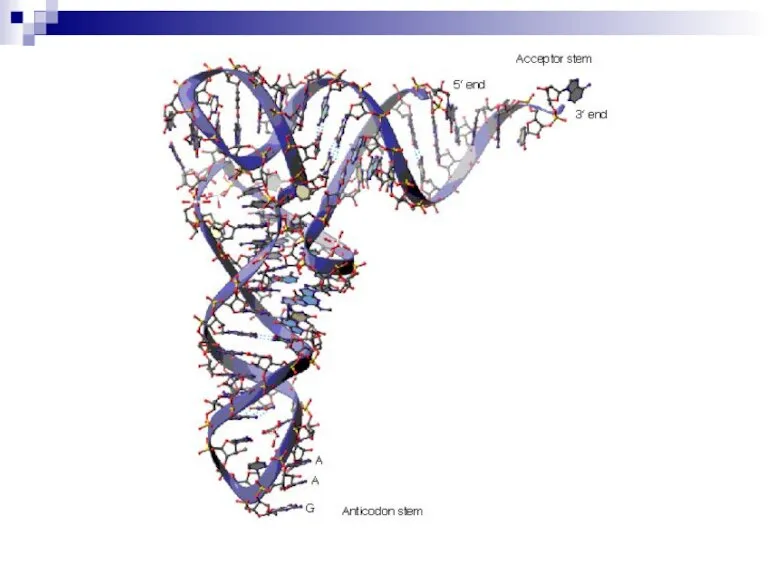
Для перевода нуклеотидного кода в аминокислотную последовательность служат молекулы-адаптеры аминоацил-тРНК: на 3’-конце – аминокислота, а в другой части молекулы - триплет нуклеотидов (антикодон), комплементарный кодону мРНК.
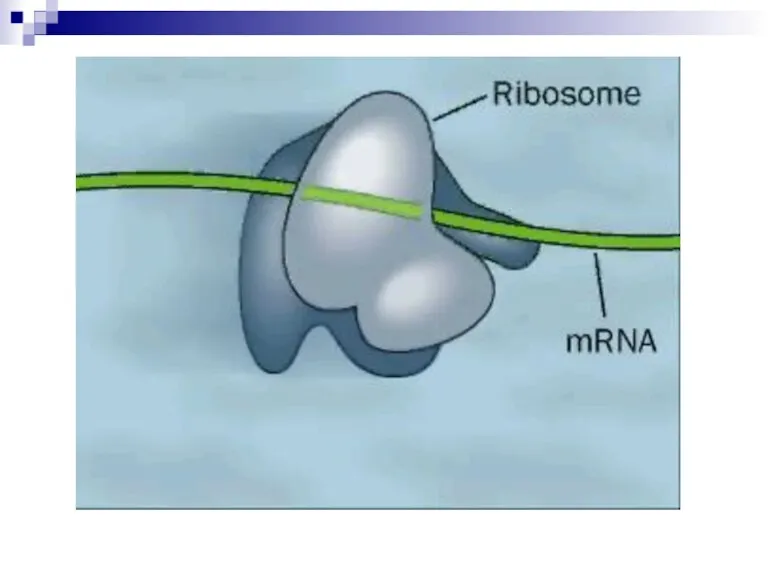
Слайд 4Рибосомы
Рибосомы - внутриклеточный компартмент, где происходит трансляция.
Полирибосомы (полисомы) - несколько рибосом, транслирующих

одну и ту же цепь мРНК.
Шероховатый эндоплазматический ретикулум – рибосомы, связанные с мембранами, продуцируют мембранные и экспортные белки.
Свободные полисомы синтезируют внутриклеточные белки.
Слайд 5Строение рибосом
Химически рибосомы представляют собой нуклеопротеины, состоящие из РНК и белков в

соотношении 1:1 у 80S рибосом эукариот и 2:1 у 70S рибосом прокариот.
Рибосомные РНК синтезируются в ядрышке, белки образуются в цитоплазме и переносятся в ядрышко. Здесь спонтанно образуются рибосомные субчастицы путем объединения белков с соответствующими рРНК.
Слайд 6Строение рибосом
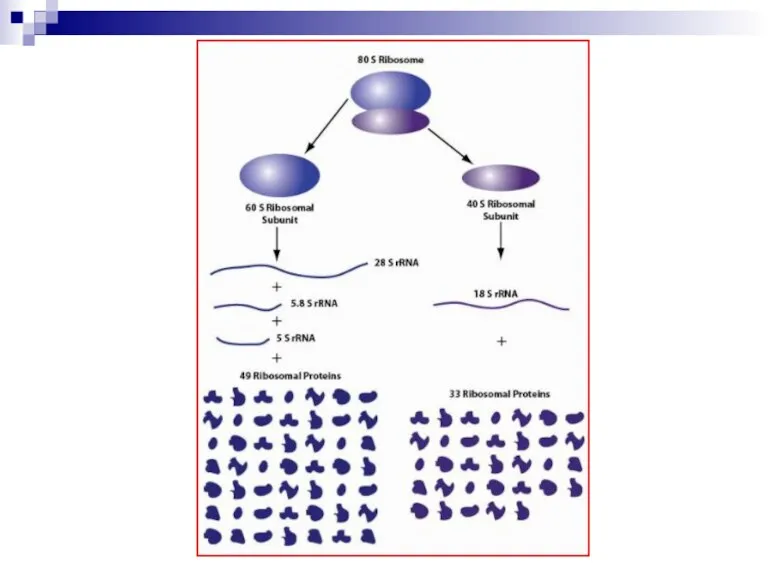
Рибосома состоит из 2 субъединиц: малая (30S – прокариоты или 40S

- эукариоты) и большая (50S – прокариоты или 60S – эукариоты).
У эукариот малая субъединица содержит 33 белка и 18S рРНК, а большая – 49 белков, 5S, 5,8S и 28S рРНК.
В микробной клетке – 10000 рибосом, в клетках эукариот – до 100000 рибосом.
Слайд 8РИБОСОМНЫЙ ЦИКЛ ДЖ.УОТСОНА
В начале синтеза полипептидной цепи субъединицы рибосомы объединяются на 5’-конце

мРНК в функционирующую рибосому, а в конце синтеза диссоциируют на субъединицы.
Для синтеза каждой новой полипептидной цепи необходимо собрать рибосому на 5’-конце мРНК.
С одной мРНК одновременно могут транслироваться несколько полипептидных цепей, каждая своей рибосомой.
Слайд 9ПЕРЕДАЧА ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ ПРИ СИНТЕЗЕ БЕЛКА
ДНК: информация о последовательности аминокислот в полипептидной

цепи записана в структурных генах в виде последовательности триплетов дезоксирибонуклеотидов.
мРНК: в процессе транскрипции на мРНК создается аналогичная последовательность триплетов рибонуклеотидов (кодонов).
тРНК: каждая из 20 протеиногенных аминокислот включается в 1-4 аминоацил-тРНК, имеющих одинаковый антикодон – триплет рибонуклеотидов, комплементарный соответствующему кодону мРНК.
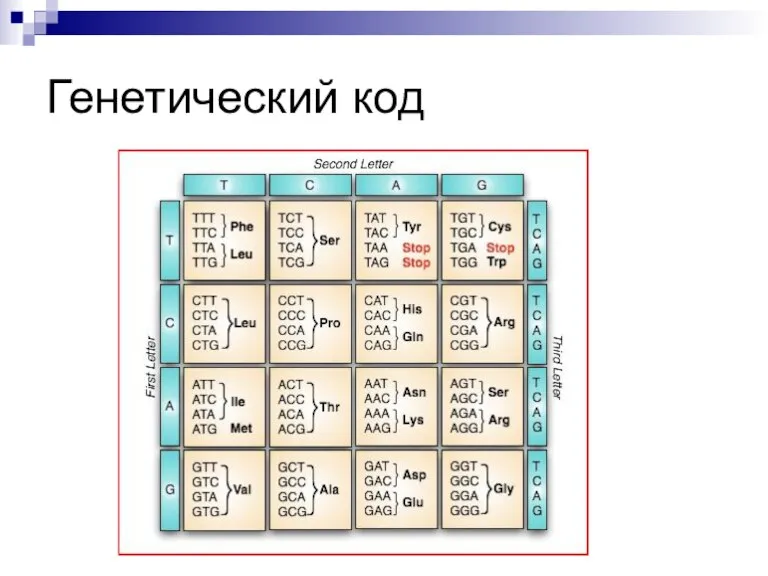
Слайд 11ГЕНЕТИЧЕСКИЙ КОД (мРНК)
Инициирующие кодоны – АУГ и ГУГ (кодируют включение формилметионина у

прокариот или метионина у эукариот), определяют стадию начала (инициации) синтеза белковой молекулы.
Смысловые кодоны – кодируют включение аминокислот в синтезируемую полипептидную цепь.
Терминирующие кодоны (нонсенс-кодоны УАА,УАГ и УГА) не кодируют включение аминокислот, а определяют завершение (терминацию) синтеза.
Слайд 12ЭТАПЫ СИНТЕЗА БЕЛКА
Активация аминокислот с образованием амино-ацил-тРНК (аа-тРНК);
Инициация полипептидной цепи;
Элонгация полипептидной

цепи;
Терминация полипептидной цепи;
Сворачивание полипептидной цепи (фолдинг) и процессинг (созревание).
Слайд 13Белоксинтезирующая система клетки
мРНК – матрица, на которой записана последовательность аминокислот белка в

виде последовательности триплетов.
Рибосомы (полирибосомы) – место ферментативного соединения аминокислот.
Набор всех типов аа-тРНК (64 типа, по числу кодонов генетического кода).
АТФ, ГТФ, ионы магния, регуляторные и вспомогательные факторы белковой природы.
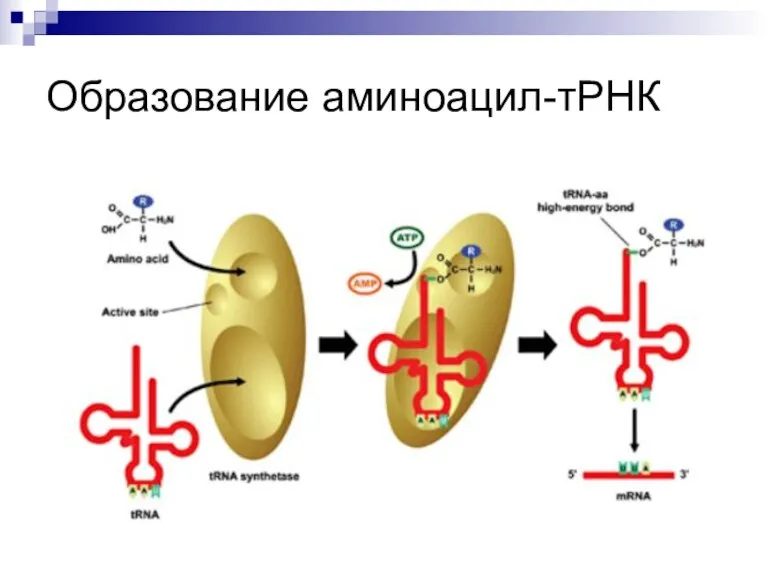
Слайд 14АКТИВАЦИЯ АМИНОКИСЛОТ
В цитозоле 20 аминокислот соединяются с соответствующими тРНК с образованием аа-тРНК.
Ферменты

– аа-тРНК-синтетазы имеют 4 участка в активном центре: для аминокислоты, для тРНК, для АТФ и для воды (гидролиз в случае присоединения «неправильной» аминокислоты).
Аминоацил-тРНК-синтетазы способны распознавать ошибку и устранять ее
(1 ошибка на 1300 аминокислот).
Слайд 15Реакция активации аминокислот
Аминокислота + АТФ + тРНК ?
аа–тРНК + АМФ +

ФФ.
2 этапа:
Аминокислота + АТФ ?
аминоациладенилат + ФФ.
Аминоациладенилат + тРНК-3’ОН ? AМФ + аа-тРНК.
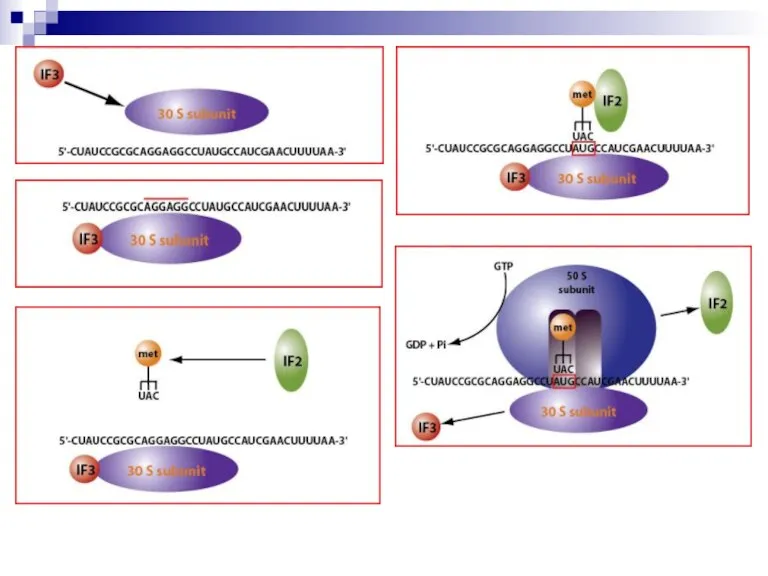
Слайд 17Стадия инициации
Необходимо: субъединицы рибосом, инициирующие факторы IF-1, IF-2, IF-3, (формил)метионин-тРНК, мРНК, ГТФ.
Антикодон

(формил)метионин-тРНК УАЦ комплементарен инициирующему кодону мРНК на 5’-конце мРНК.
Перед АУГ на мРНК – последовательность Shine-Dalgarno, которая помогает правильному расположению рибосомы на инициирующем кодоне мРНК (через IF-2 или 16S-РНК).
Слайд 19Стадия инициации (продолжение)
В рибосоме – два участка связывания аа-тРНК: А (аминоацильный) имеет

основное сродство к амино-ацил-тРНК; Р (пептидильный) имеет сродство к пептидил-тРНК.
В конце стадии инициации инициирующая (формил)метионин-тРНК находится в Р-участке рибосомы; в А-участке находится следующий кодон мРНК.
В работающей рибосоме находятся 2 кодона мРНК.
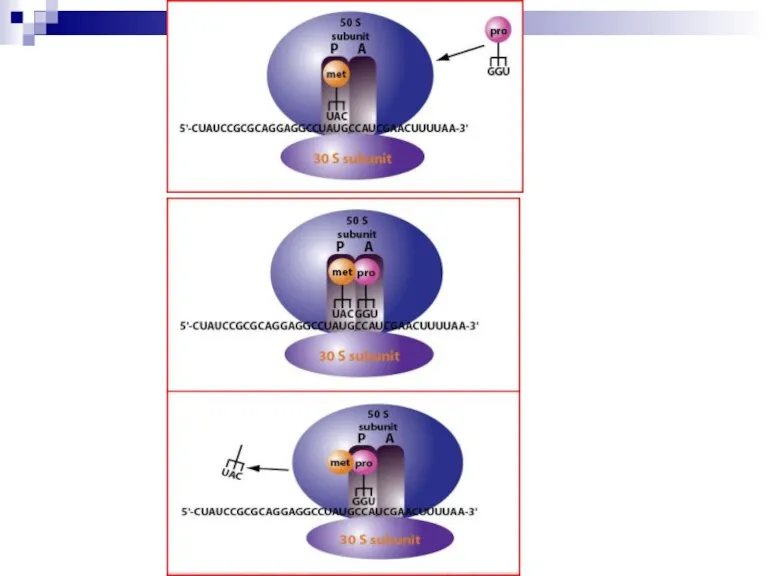
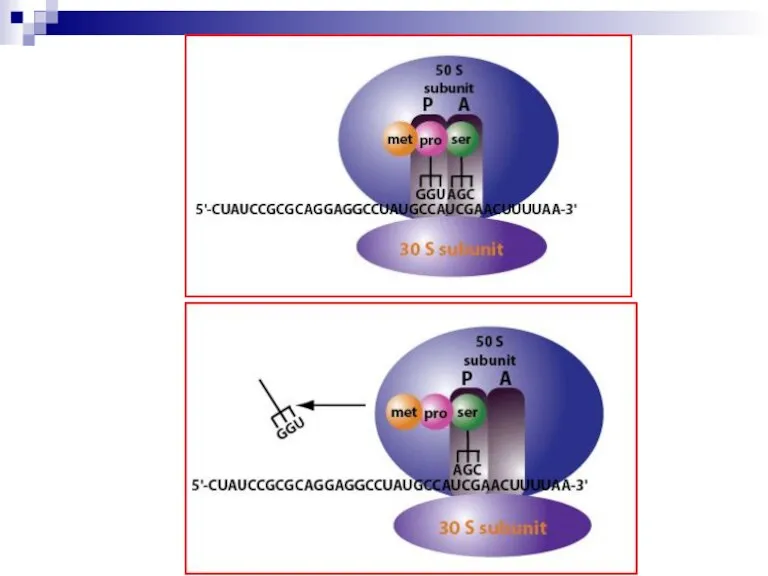
Слайд 20Стадия элонгации
Необходимы: набор аа-тРНК, факторы элонгации EF-T и EF-g, ГТФ.
Этапы: 1) присоединение

аа-тРНК к кодону мРНК в А-участке; 2) замыкание пептидной связи (пептидилтрансфераза) и образование дипептида в А-участке; 3) транслокация – перемещение дипептида в Р-участок; 4) в А-участок приходит третий кодон мРНК; 5) с ним связывается соответствующая аа-тРНК и т.д.
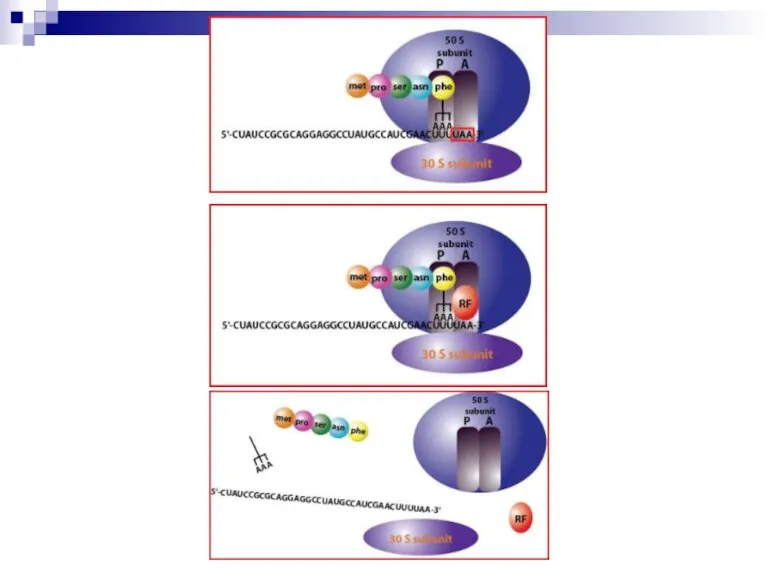
Слайд 23Стадия терминации
Факторы терминации FR-1 (УАА и УАГ) и FR-2 (УАА и УГА).

Терминирующие кодоны (в скобках) не имеют аа-тРНК.
При поступлении УАА, УАГ или УГА в А-участок через факторы FR-1 и FR-2 активируется пептидилэстеразная активность и система синтеза белка распадается на элементы: субъединицы рибосомы, мРНК и синтезированный пептид.
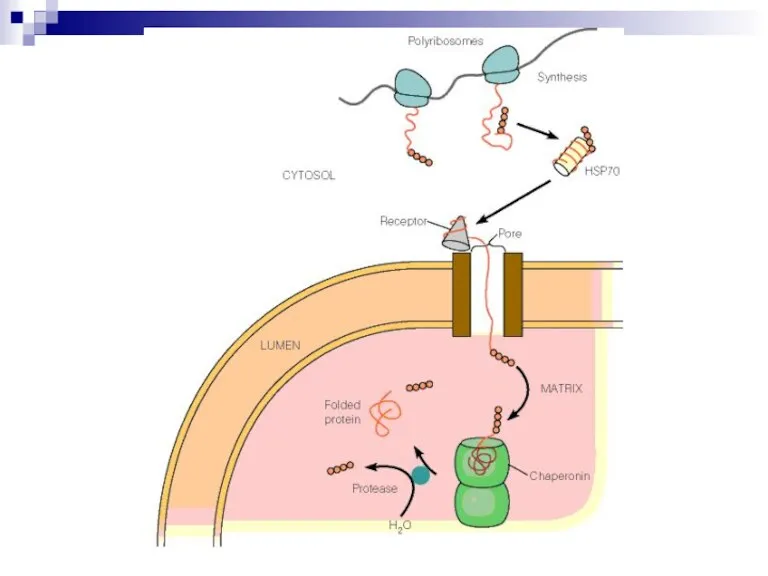
Слайд 25Фолдинг и процессинг
От синтезированного пептида в цитозоле отщепляется инициирующая аминокислота (формил)метионин.
Сигнальная последовательность

на N-конце позволяет проникнуть через мембрану ЭПР.
Складывание трехмерной сируктуры с помощью шаперонинов и отбраковка – с помощью белков теплового шока (семейство HSP).
Модификация (гликозилирование, фосфорилирование и пр.).
Слайд 28Регуляция синтеза белка
Возможна на всех стадиях.
Индукция синтеза белка – вещество понижает сродство

репрессора к гену оператору, что освобождает дорогу РНК-полимеразе.
Репрессия синтеза белка – вещество повышает сродство репрессора к гену-оператору, что прекращает работу РНК-полимеразы.
В первом случае – экспрессия генов, т.е. синтез белков по генетической программе структурных генов. Во втором случае – подавление экспрессии генов.
Слайд 29Препараты-регуляторы синтеза белка
I класс. ИНДУКТОРЫ (анаболики)
1) Гормональные
а) специфические – стероидные

гормоны.
Глюкокортикоиды (индукция ферментов глюконеогенеза)
б) неспецифические – инсулин, феноболин, ретаболин.
2) Негормональные – оротат калия, инозин (используются для синтеза пуриновых нуклеотидов
+ индуцируют синтез белков).
II класс. ИНГИБИТОРЫ
1) транскрипции;
2) процессинга и транспорта мРНК;
3)трансляции;
Слайд 30Ингибиторы транскрипции
Рифампицин связывается с
β-субъединицей РНК-полимеразы, ингибируя образование первой фосфодиэфирной связи в

транскрипте. На уже начавшийся синтез не влияет.
Слайд 31Ингибиторы трансляции
Стрептомицин – препятствует связыванию с рибосомой формилметионин-тРНК, нарушая инициацию трансляции. Связывается

с белком малой субъединицы рибосом и нарушает правильное считывание информации с мРНК.
Пуромицин связывается в А-участке рибосомы, конкурируя с аминоацил-тРНК и освобождает полипептид до завершения синтеза (как и тетрациклины)
Левомицетин соединяется с большой субъединицей и ингибирует пептидилтрансферазную реакцию.
Пенициллины и цефалоспорины нарушают процесс созревания белков клеточной стенки бактерий.
Эритромицин взаимодействует с большой субъединицей рибосом и препятствует элонгации синтеза белка.
Слайд 32Действие токсинов
Аманитин (токсин бледной поганки), циклический пептид, связывается с эукариотической РНК-полимеразой II,

блокируя синтез мРНК.
Рицин (токсин клещевины) является гликозилазой, удаляющей аденин из большой субъединицы рибосом.
Дифтерийный токсин, является
АДФ-рибозилтрансферазой, модифицирует фактор элонгации синтеза белка.
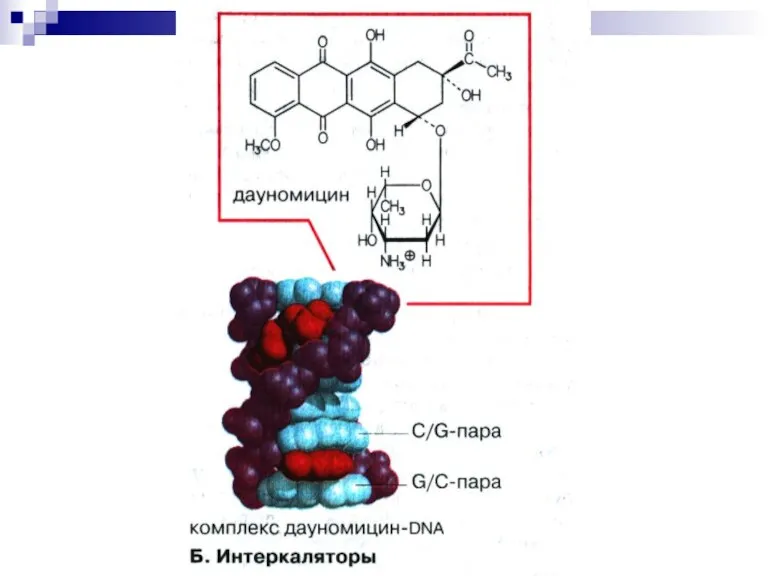
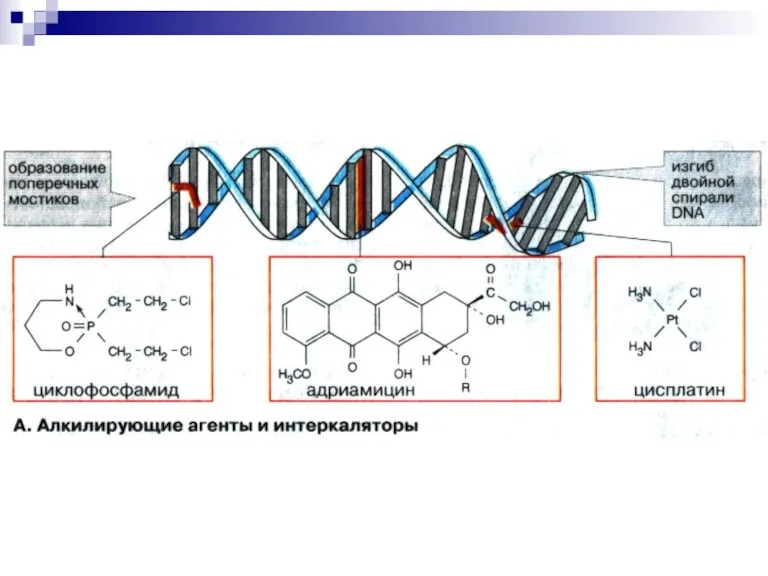
Слайд 33Ингибиторы репликации ДНК
Антибиотики способны:
1) встраиваться (интеркаляция) между основаниями ДНК,

ингибируя ее матричную активность (дауномицин, доксорубицин, рифампицин, актиномицин Д) .
2) алкилировать ДНК, препятствуя репликации (мелфалан).
3) ингибировать ДНК-гиразы у прокариот и топоизомеразы у эукариот (новобиоцин, налидиксовая кислота, номермицин).






















 Первый резец верхней челюсти
Первый резец верхней челюсти Гепатит А Это острое вирусное заболевание с преимущественным поражением печени, протекающее с интоксикацией, в ряде случаев сопр
Гепатит А Это острое вирусное заболевание с преимущественным поражением печени, протекающее с интоксикацией, в ряде случаев сопр Цитоплазма клетки
Цитоплазма клетки Homo erectus - человек прямоходящий
Homo erectus - человек прямоходящий Класс паукообразные
Класс паукообразные Нуклеиновые кислоты
Нуклеиновые кислоты Обмен веществ
Обмен веществ Введение в палеонтологию
Введение в палеонтологию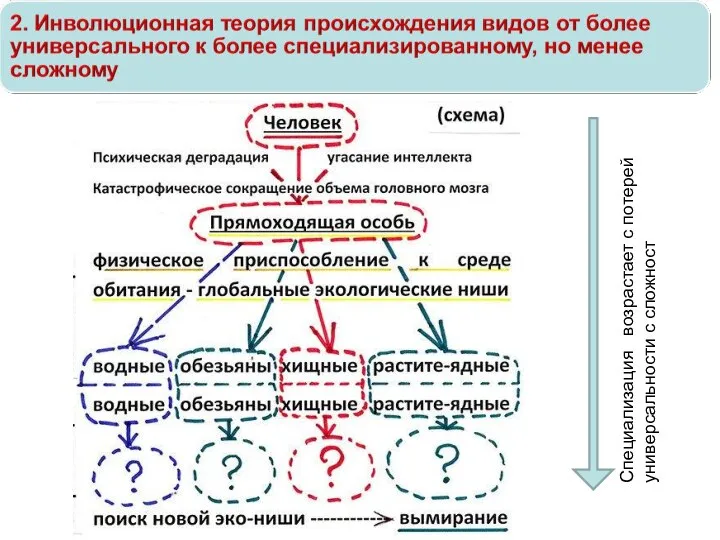 Инволюционная теория происхождения видов от более универсального к более специализированному, но менее сложному
Инволюционная теория происхождения видов от более универсального к более специализированному, но менее сложному Фенеологические наблюдения. Отчёт. 5 класс
Фенеологические наблюдения. Отчёт. 5 класс Многообразие пресмыкающихся
Многообразие пресмыкающихся Развитие насекомых
Развитие насекомых Организм человека как биологическая система
Организм человека как биологическая система Витамины и их роль в организме человека. 8 класс
Витамины и их роль в организме человека. 8 класс Биосинтез белков
Биосинтез белков Презентация на тему Косатка
Презентация на тему Косатка  Презентация на тему Пути и направления эволюции
Презентация на тему Пути и направления эволюции  Зимующие птицы
Зимующие птицы Что такое большие данные?
Что такое большие данные? Частная физиология ЦНС. Медиаторные системы. Ацетилхолин
Частная физиология ЦНС. Медиаторные системы. Ацетилхолин Дерево верба
Дерево верба В мире углеводов
В мире углеводов Происхождение ротового отверстия в онтогенезе. Занятие 15
Происхождение ротового отверстия в онтогенезе. Занятие 15 Плауны, хвощи, папоротники
Плауны, хвощи, папоротники Такса
Такса Грунт в аквариуме
Грунт в аквариуме Красная книга. Тамбовская область
Красная книга. Тамбовская область