Содержание
- 2. Вопросы с прошлой лекции E1/E2-механизм β-элиминации при разрыве фосфодиэфирной связи Секвенирование Illumina
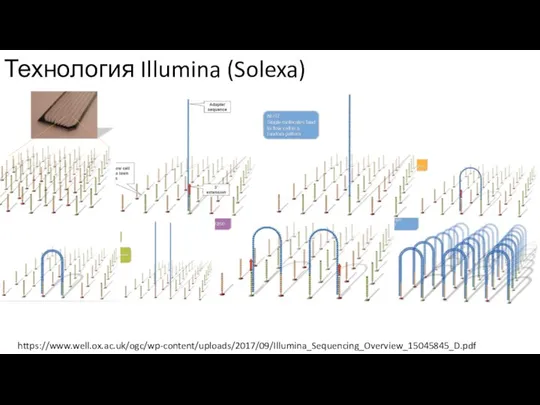
- 3. Технология Illumina (Solexa) https://www.well.ox.ac.uk/ogc/wp-content/uploads/2017/09/Illumina_Sequencing_Overview_15045845_D.pdf
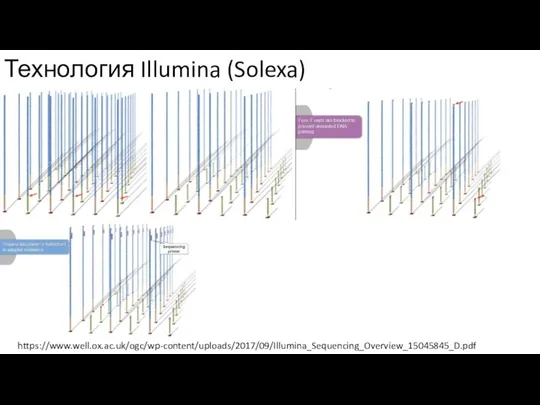
- 4. Технология Illumina (Solexa) https://www.well.ox.ac.uk/ogc/wp-content/uploads/2017/09/Illumina_Sequencing_Overview_15045845_D.pdf
- 5. План лекции Молекулы, попадающие в цепь переноса электронов Что такое окислительно-восстановительный потенциал Строение митохондрий Общая структура
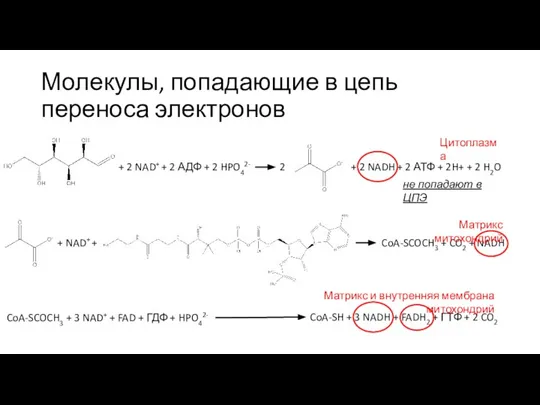
- 6. Молекулы, попадающие в цепь переноса электронов + 2 NAD+ + 2 АДФ + 2 HPO42- 2
- 7. Окислительно-восстановительный потенциал K=e(-ΔG/RT), где ΔG – изменение свободной энергии (энергии Гиббса); R – универсальная газовая постоянная
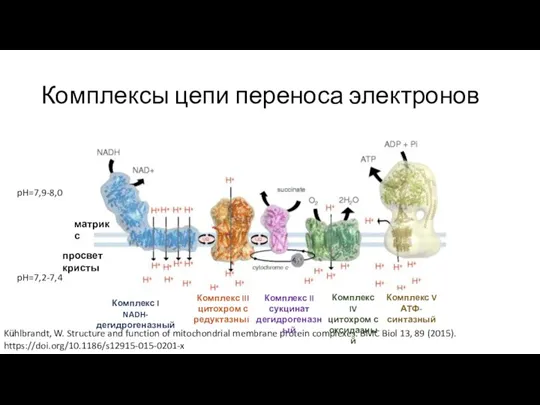
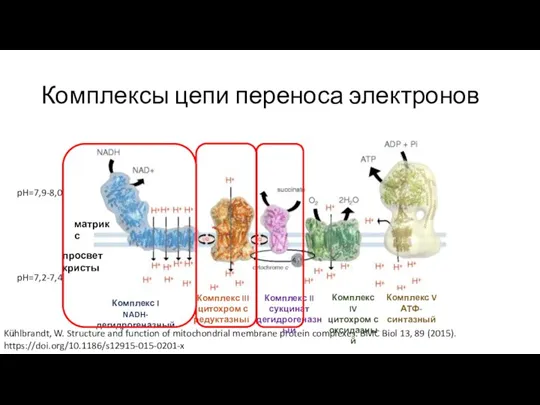
- 8. Строение митохондрий Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biol 13, 89
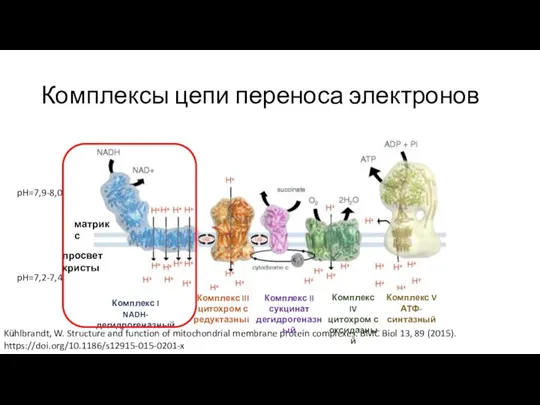
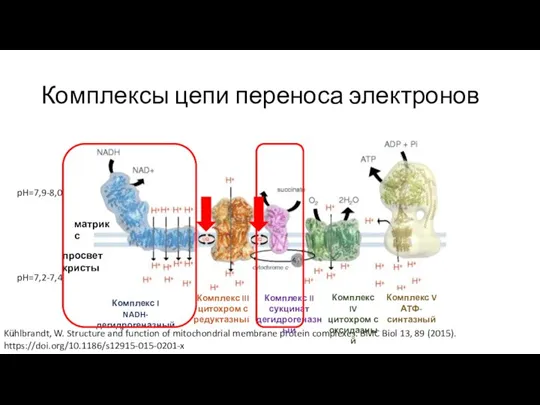
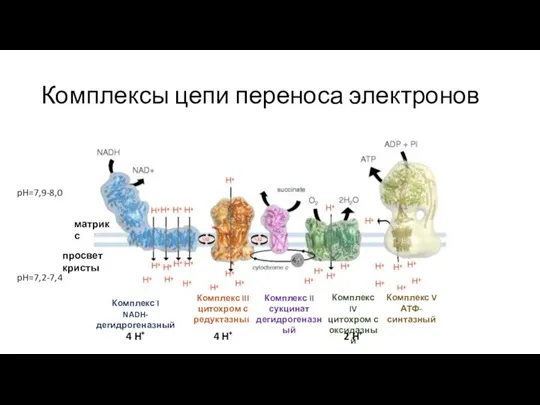
- 9. Комплексы цепи переноса электронов Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biol
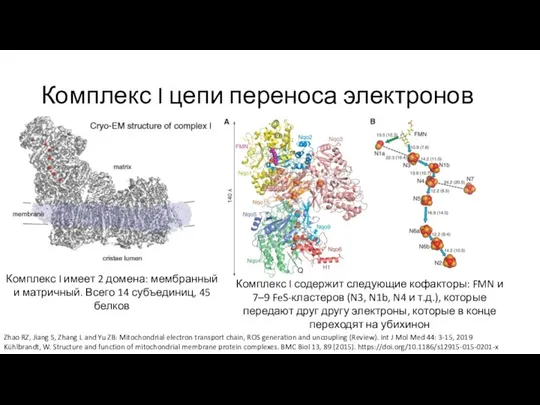
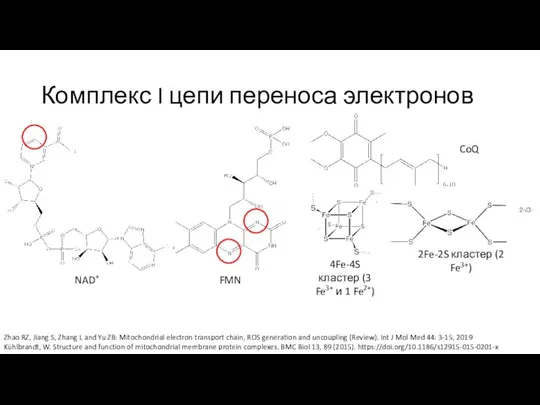
- 10. Комплекс I цепи переноса электронов Zhao RZ, Jiang S, Zhang L and Yu ZB: Mitochondrial electron
- 11. Комплекс I цепи переноса электронов Zhao RZ, Jiang S, Zhang L and Yu ZB: Mitochondrial electron
- 12. Комплекс I цепи переноса электронов Zhao RZ, Jiang S, Zhang L and Yu ZB: Mitochondrial electron
- 13. Комплекс I цепи переноса электронов Zhao RZ, Jiang S, Zhang L and Yu ZB: Mitochondrial electron
- 14. Комплексы цепи переноса электронов Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biol
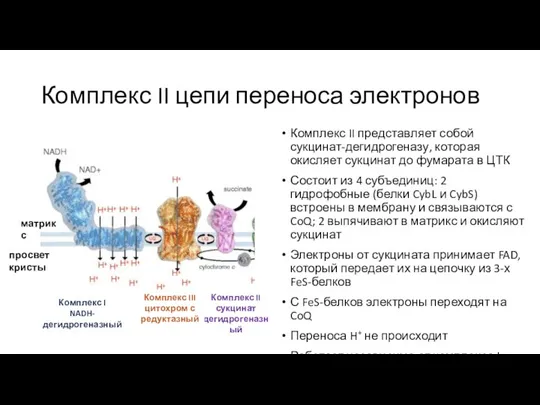
- 15. Комплекс II цепи переноса электронов Комплекс II сукцинат дегидрогеназный матрикс просвет кристы Комплекс I NADH-дегидрогеназный Комплекс
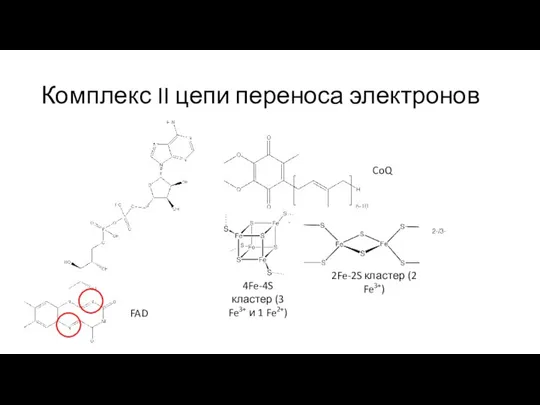
- 16. Комплекс II цепи переноса электронов FAD 2Fe-2S кластер (2 Fe3+) 4Fe-4S кластер (3 Fe3+ и 1
- 17. Комплексы цепи переноса электронов Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biol
- 18. Комплекс III цепи переноса электронов Комплекс III – это убихинон:цитохром c редуктаза Представляет собой димер, каждый
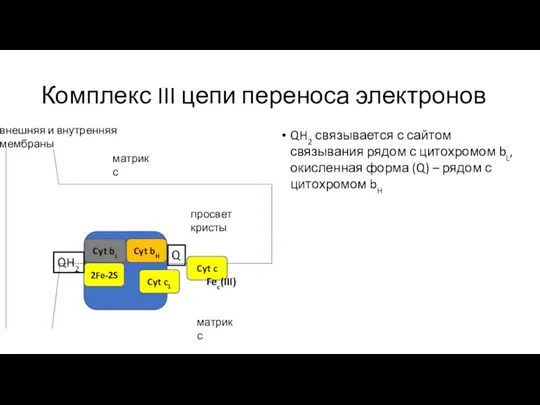
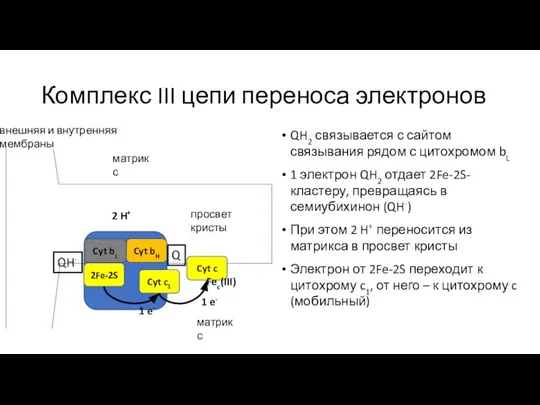
- 19. Комплекс III цепи переноса электронов QH2 связывается с сайтом связывания рядом с цитохромом bL, окисленная форма
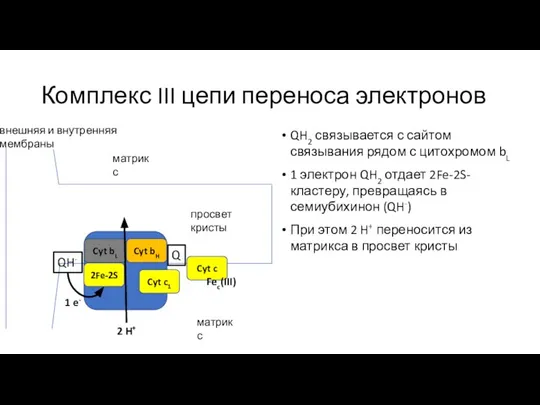
- 20. Комплекс III цепи переноса электронов QH2 связывается с сайтом связывания рядом с цитохромом bL 1 электрон
- 21. Комплекс III цепи переноса электронов QH2 связывается с сайтом связывания рядом с цитохромом bL 1 электрон
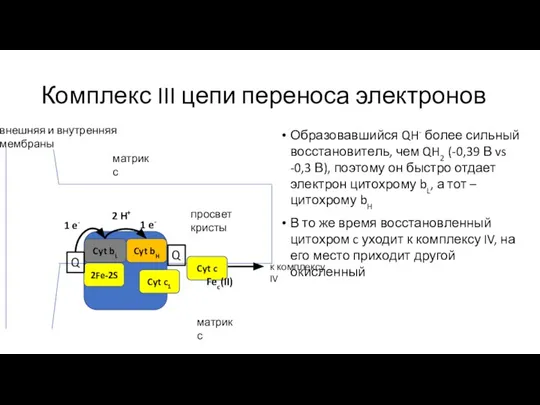
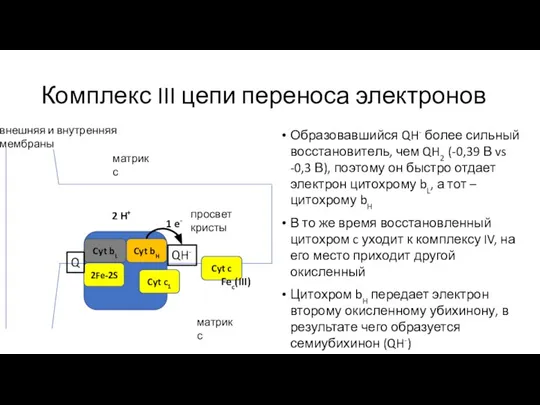
- 22. Комплекс III цепи переноса электронов Образовавшийся QH- более сильный восстановитель, чем QH2 (-0,39 В vs -0,3
- 23. Комплекс III цепи переноса электронов Образовавшийся QH- более сильный восстановитель, чем QH2 (-0,39 В vs -0,3
- 24. Комплекс III цепи переноса электронов Образовавшийся QH- более сильный восстановитель, чем QH2 (-0,39 В vs -0,3
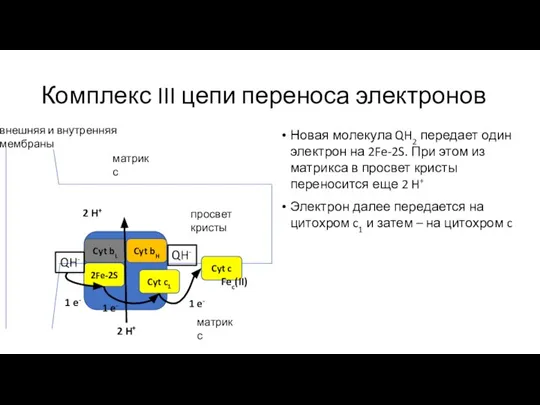
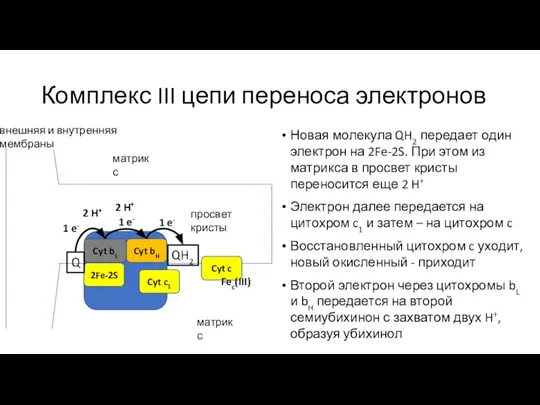
- 25. Комплекс III цепи переноса электронов Новая молекула QH2 передает один электрон на 2Fe-2S. При этом из
- 26. Комплекс III цепи переноса электронов Новая молекула QH2 передает один электрон на 2Fe-2S. При этом из
- 27. Комплекс III цепи переноса электронов Итоги: Два QH2 окислено, один – образовался снова 4 электрона переданы,
- 28. Комплексы цепи переноса электронов Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biol
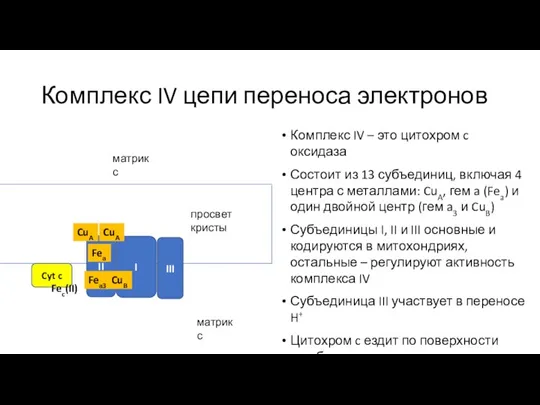
- 29. Комплекс IV цепи переноса электронов Комплекс IV – это цитохром c оксидаза Состоит из 13 субъединиц,
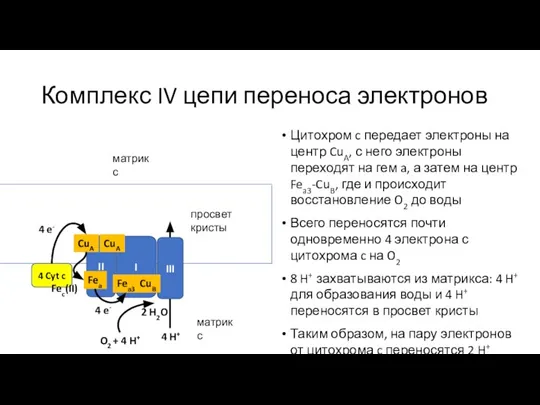
- 30. Комплекс IV цепи переноса электронов Цитохром c передает электроны на центр CuA, с него электроны переходят
- 31. Комплексы цепи переноса электронов Комплекс I NADH-дегидрогеназный Комплекс III цитохром с редуктазный Комплекс II сукцинат дегидрогеназный
- 32. Комплекс V цепи переноса электронов АТФ-синтазы состоят из двух доменов: F0 (встроен в мембрану) и F1
- 33. Расположение комплекса V (АТФ-синтазы) на кристах Thorsten B. Blum, Alexander Hahn, Thomas Meier, Karen M. Davies,
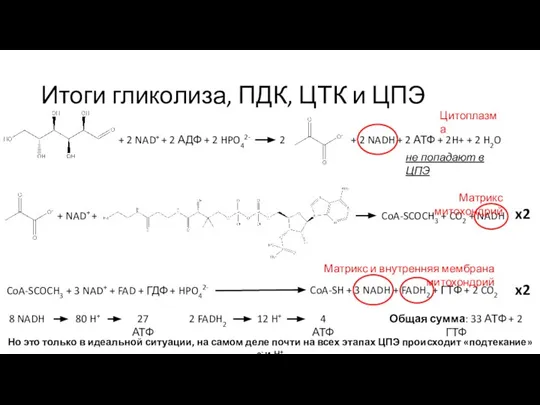
- 34. Итоги гликолиза, ПДК, ЦТК и ЦПЭ + 2 NAD+ + 2 АДФ + 2 HPO42- 2
- 35. Ингибиторы цепи переноса электронов Ротенон: блокирует перенос электронов на комплексе I, используется как инсектицид Цианид: блокирует
- 37. Скачать презентацию












 Презентация на тему Кто такие звери (1 класс)
Презентация на тему Кто такие звери (1 класс)  Вредители растений
Вредители растений Свойства биогеоценозов
Свойства биогеоценозов Парящие над облаками
Парящие над облаками Железо в составе гемоглобина: особенности усвоения и обменные процессы в организме
Железо в составе гемоглобина: особенности усвоения и обменные процессы в организме Физические законы в биологии
Физические законы в биологии Презентация на тему Скелет человека - механическая система
Презентация на тему Скелет человека - механическая система  Буынаяқтылар. Ауыл кенесі, Алма кенесі
Буынаяқтылар. Ауыл кенесі, Алма кенесі Биосфера. Реликты
Биосфера. Реликты Нервная система
Нервная система Презентация на тему Распространенные заболевания человека
Презентация на тему Распространенные заболевания человека  Презентация на тему СТРОЕНИЕ КЛЕТКИ
Презентация на тему СТРОЕНИЕ КЛЕТКИ  Восстановление зрения
Восстановление зрения Окружающий мир’мир
Окружающий мир’мир Эволюция. Развитие жизни на Земле (часть 4)
Эволюция. Развитие жизни на Земле (часть 4) Скаты
Скаты Портрет хромосом человека
Портрет хромосом человека Цветковые или Покрытосеменные
Цветковые или Покрытосеменные Клетка. Органоиды. Клеточная теория
Клетка. Органоиды. Клеточная теория Перелетные птицы
Перелетные птицы Изготовление динозавра из пластилина
Изготовление динозавра из пластилина Головной мозг. Нервная система. Рефлекс. Нервный импульс
Головной мозг. Нервная система. Рефлекс. Нервный импульс Презентация на тему Прибрежно-водные растения
Презентация на тему Прибрежно-водные растения  Необычные представители растений
Необычные представители растений Дозорщик-император. Жук-олень
Дозорщик-император. Жук-олень genetika
genetika Размножение. Вегетативное размножение
Размножение. Вегетативное размножение Өз ойын. Зоология
Өз ойын. Зоология