Содержание
- 2. Жизнь это дыхание Аэробное дыхание – основной источник энергии для ВСЕХ живых организмов
- 3. «Дыхание – это медленное горение углерода и водорода, сходное во всех отношениях с тем, что протекает
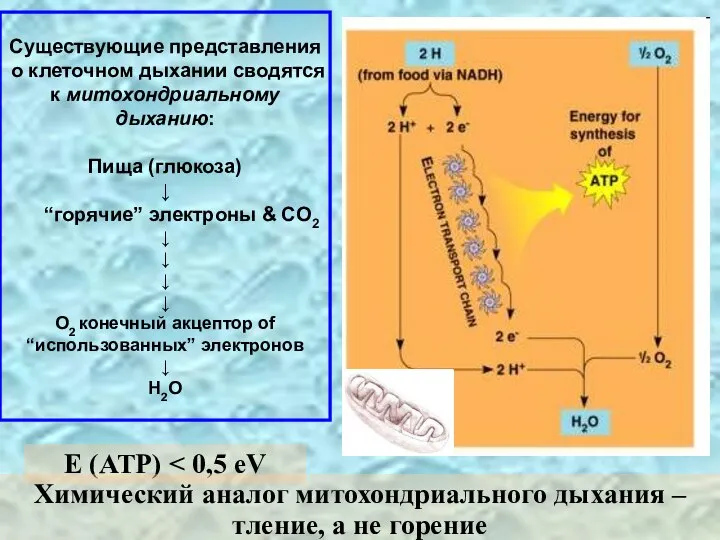
- 4. Существующие представления о клеточном дыхании сводятся к митохондриальному дыханию: Пища (глюкоза) ↓ “горячие” электроны & CO2
- 5. ГОРЕНИЕ: восстановление КИСЛОРОДА электронами (водородам), которое сопровождается освобождением энергии высокой плотности (“пламенем”) 4H2 O2 2H2O
- 6. 20-90% всего потребляемого организмами кислорода используется в таких процессах! (Начало любой жизни – оплодотворение яйцеклетки –
- 7. «… дышащие животные являют собой активные тела, которые горят и выделяют продукты горения” C6H12O6 + 6O2
- 8. Участник # 1 ВОДА
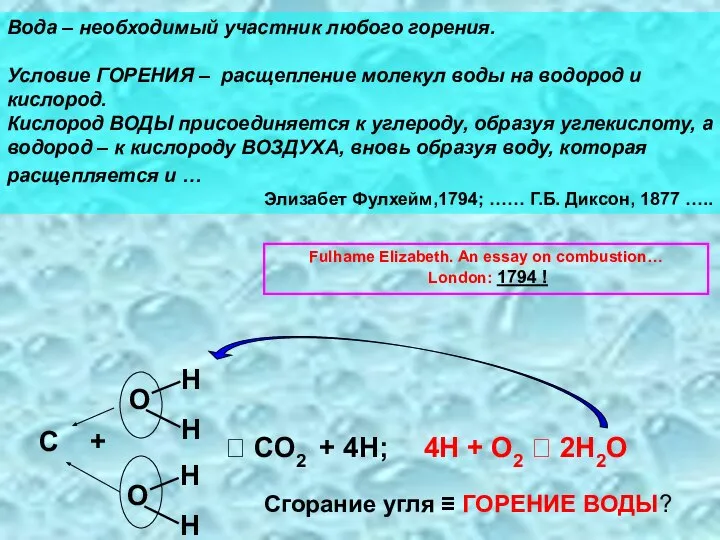
- 9. Fulhame Elizabeth. An essay on combustion… London: 1794 ! Сгорание угля ≡ ГОРЕНИЕ ВОДЫ? Вода –
- 11. Вода – доминирующая субстанция в живой материи Она играет ключевую роль и в их жизнедеятельности, и
- 12. «Живая вода» Морская вода: Вода Тв. в-ва: >3% Медуза: Вода 99,9% Твердые в-ва: 0,1%
- 13. Вода медузы – «живая вода» только благодаря ее взаимодействию с «твердыми» биомолекулами
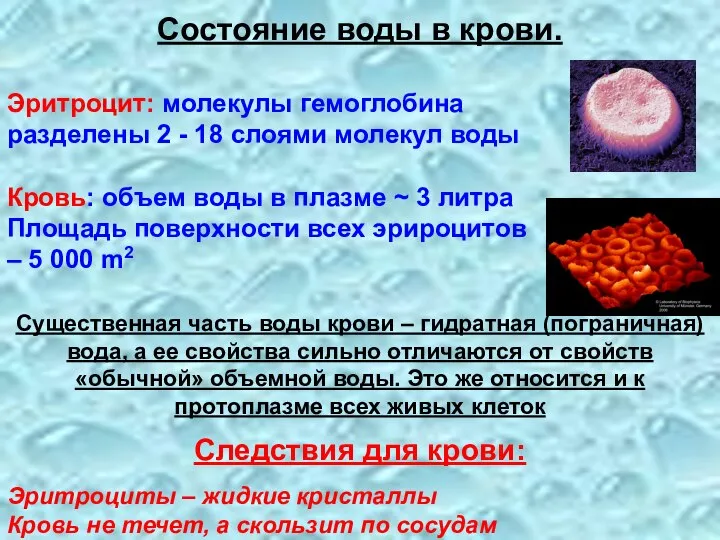
- 14. Эритроцит: молекулы гемоглобина разделены 2 - 18 слоями молекул воды Кровь: объем воды в плазме ~
- 15. Гидрогель - ПВА Микросферы (-) или (+), суспендированные в воде Экспериментальный подход G. H. Pollack, выявляющий
- 16. ПВ динамическая структура Ξ жидкий кисталл Ξ квази-полимерная водная фаза Пограничная вода Объемная вода Водная фаза,
- 17. НАИБОЛЕЕ ВАЖНЫЕ ДЛЯ БИОЭНЕРГЕТИКИ СВОЙСТВА ПОГРАНИЧНОЙ ВОДЫ: * Пограничная вода заряжена отрицательно относительно объемной воды (до
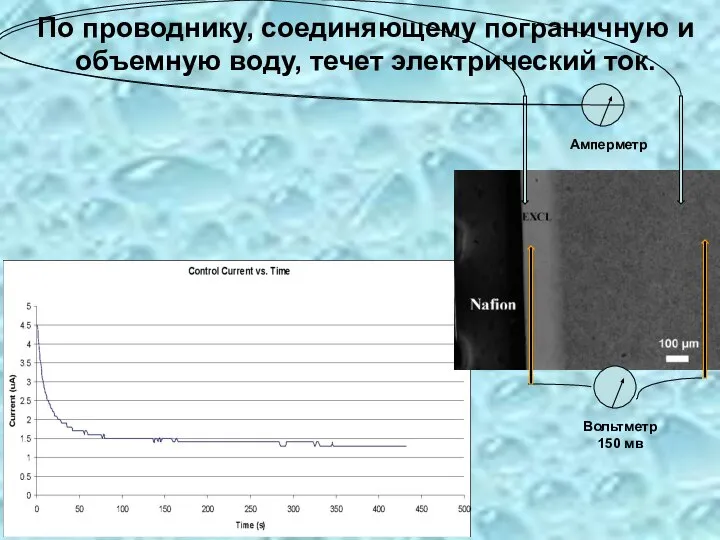
- 18. По проводнику, соединяющему пограничную и объемную воду, течет электрический ток. Вольтметр 150 мв
- 19. Электроны в EZ-воде возбуждены значительно сильнее, чем в объемной для их отрыва нужна небольшая энергия активации
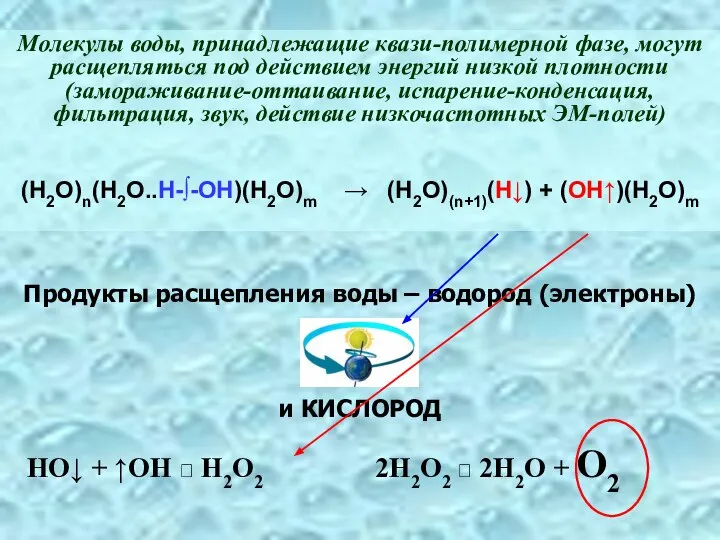
- 20. Молекулы воды, принадлежащие квази-полимерной фазе, могут расщепляться под действием энергий низкой плотности (замораживание-оттаивание, испарение-конденсация, фильтрация, звук,
- 21. E* -- энергия электронного возбуждения, эквивалентная энергии ФОТОНОВ видимой и УФ-области спектра Реакции, следующие за расщеплением
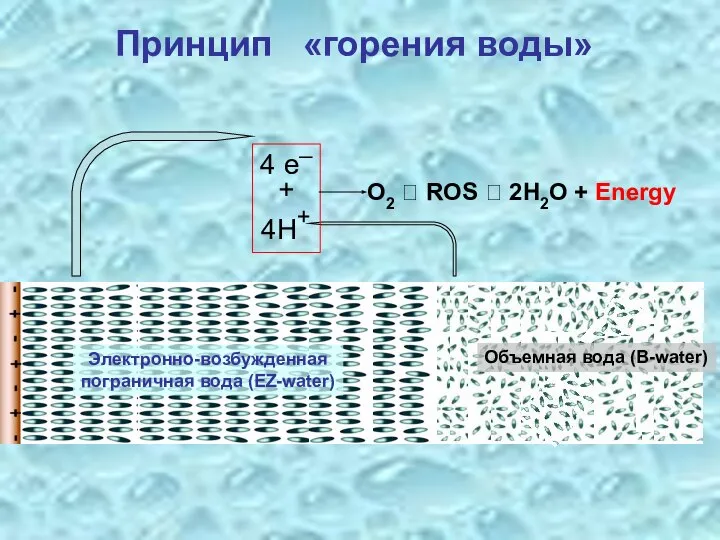
- 22. 4 e─ + 4H+ O2 ? ROS ? 2H2O + Energy Принцип «горения воды» Электронно-возбужденная пограничная
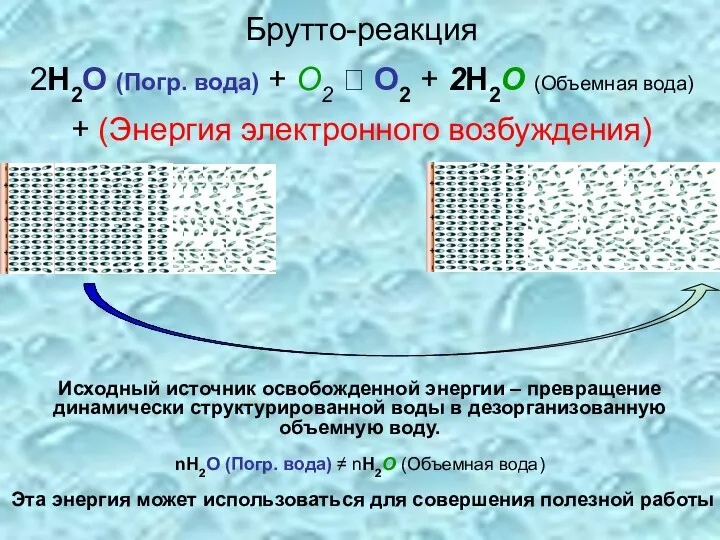
- 23. Брутто-реакция 2H2O (Погр. вода) + O2 ? O2 + 2H2O (Объемная вода) + (Энергия электронного возбуждения)
- 24. Пример горения воды в организме: все антитела (IGs) катализируют окисление воды = ГОРЕНИЕ Antibody catalysis of
- 25. Участник дыхания # 2: CO2
- 26. Аэробное дыхание «…медленное сгорание УГЛЕРОДА и водорода, сходное во всех отношениях с тем, что протекает в
- 27. (BI)CARBONATES (CO2(gas) ↔ CO2(aq.) ↔ H2CO3 ↔ HCO3─) NECESSARY FOR AEROBIC RESPIRATION At the level of
- 28. (БИ)КАРБОНАТЫ (CO2(gas) ↔ CO2(aq.) ↔ H2CO3 ↔ HCO3─) необходимы для аэробного дыхания На уровне организма, На
- 29. На уровне организма: Причина горной болезни – «акапния» – дефицит в организме карбонатов, а не кислорода.
- 30. На клеточном уровне: “Бикарбонатные ионы необходимы для эффективного синтеза ДНК в первичных культурах гепатоцитов крысы» MITAKA
- 31. КАРБОНАТЫ участвуют в процессах, связанных с производством, трансформацией и накоплением энергии в водных системах т.к. Карбонаты
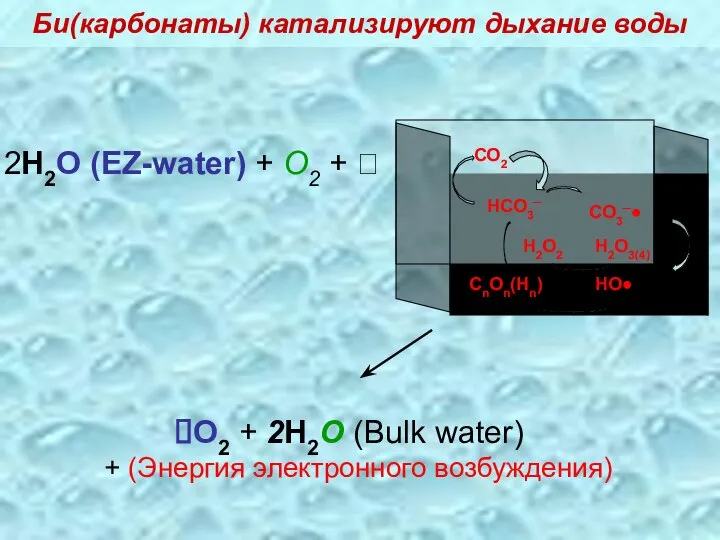
- 32. 2H2O (EZ-water) + O2 + ? O2 + 2H2O (Bulk water) + (Энергия электронного возбуждения) Би(карбонаты)
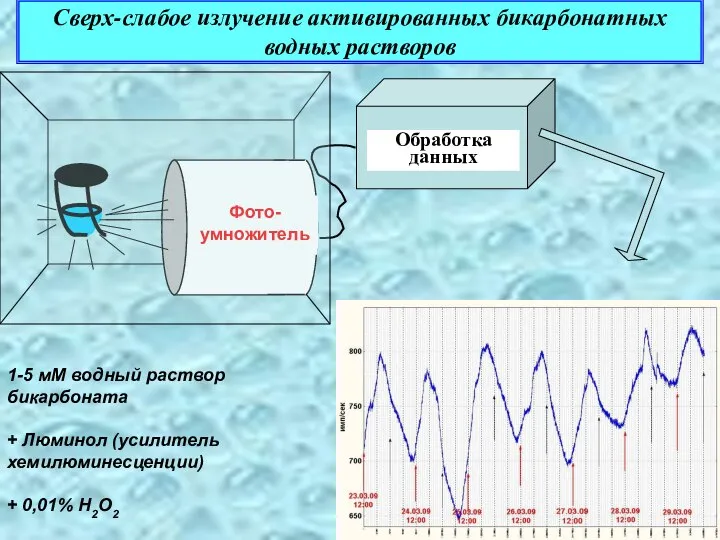
- 33. Сверх-слабое излучение активированных бикарбонатных водных растворов Photo multiplier tube Фото-умножитель 1-5 мМ водный раствор бикарбоната +
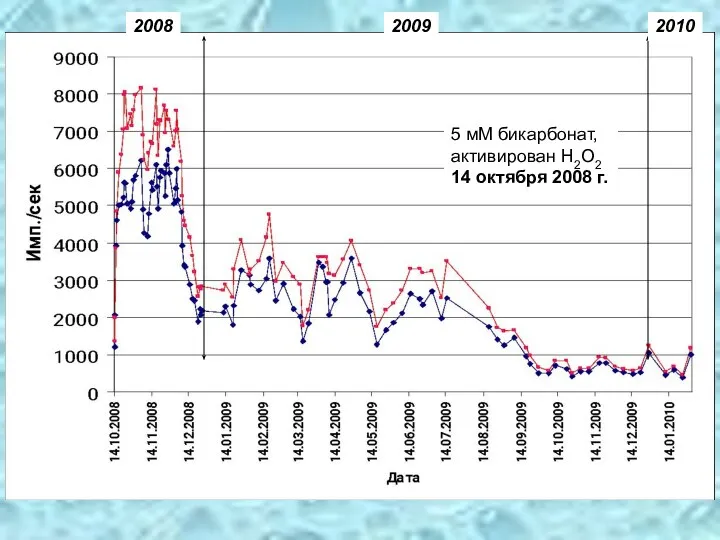
- 34. Активированные и герметично закрытые растворы бикарбонатов «горят» и не затухают в течение многих месяцев даже в
- 35. 5 мМ бикарбонат, активирован Н2О2 14 октября 2008 г. 2008 2009 2010
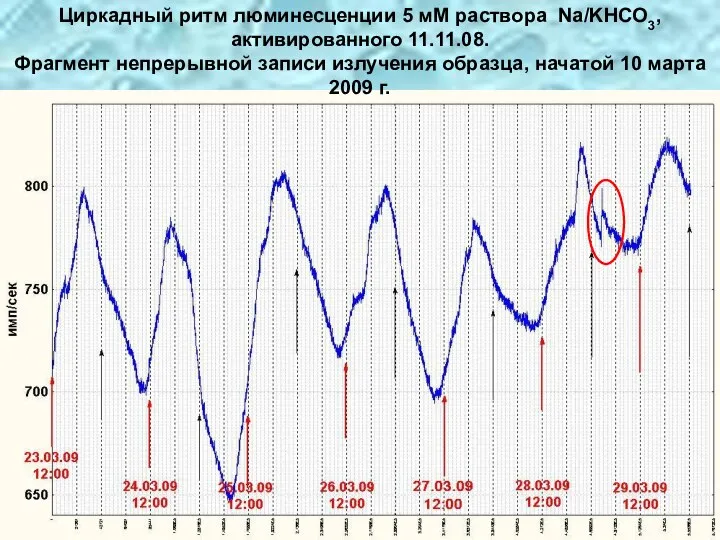
- 36. Циркадный ритм люминесценции 5 мМ раствора Na/KHCO3, активированного 11.11.08. Фрагмент непрерывной записи излучения образца, начатой 10
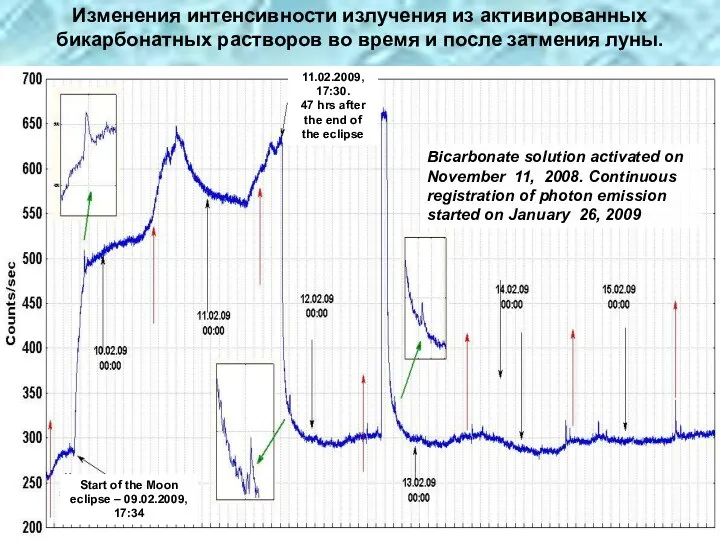
- 37. Bicarbonate solution activated on November 11, 2008. Continuous registration of photon emission started on January 26,
- 38. Что служит источником энергии, питающей в течение многих месяцев активированные бикарбонатные растворы и поддерживающей их в
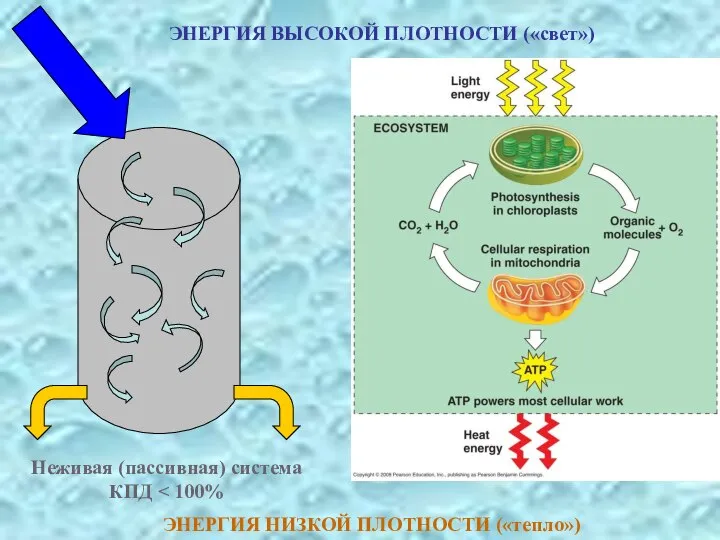
- 39. ЭНЕРГИЯ ВЫСОКОЙ ПЛОТНОСТИ («свет») ЭНЕРГИЯ НИЗКОЙ ПЛОТНОСТИ («тепло»)
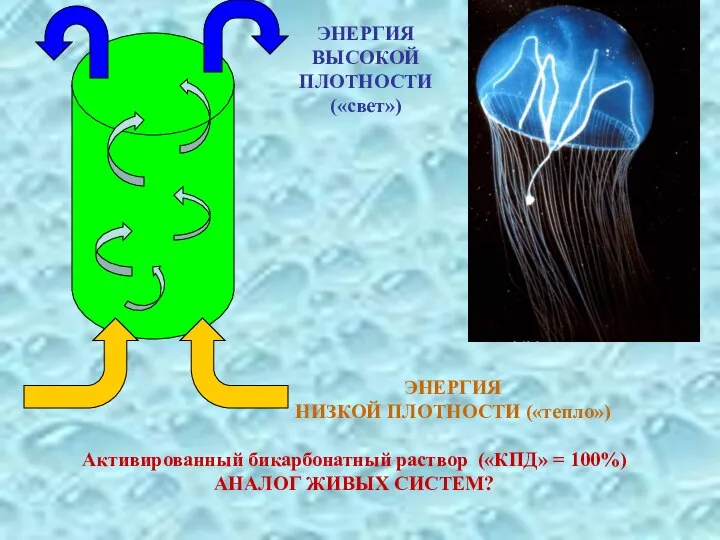
- 40. Активированный бикарбонатный раствор («КПД» = 100%) АНАЛОГ ЖИВЫХ СИСТЕМ? ЭНЕРГИЯ ВЫСОКОЙ ПЛОТНОСТИ («свет») ЭНЕРГИЯ НИЗКОЙ ПЛОТНОСТИ
- 41. Необходимые условия для эффективного аэробного дыхания: Должно иметься достаточное количество высоко организованной «пограничной» воды, обладающей восстанавливающими
- 42. Из космологического Гимна Ригвед Тогда не было ни того, что есть, ни того, что не есть;
- 43. Спасибо
- 44. Julius von Sachs – один из основателей физиологии растений «…энергида представляет собой ядро, ассоциированное с его
- 45. Биологическая роль СО2 и продуктов его взаимодействия с водой СО2 необходим для дыхания F. Miescher, 1897
- 46. СО2 – блокатор «жестких» окислительных реакций и «ловушка» агрессивных свободных радикалов: O=N-OO⎯ + CO2 ? O2N-O-COO⎯
- 47. "Сухие" углекислые ванны. ИБС, в том числе восстановительное (реабилитационное) лечение пациентов, перенесших инфаркт миокарда Гипертоническая болезнь
- 48. Биологическая роль СО2 СО2 и функция гемоглобина [HCO3 в крови = 24 ± 1 мМ]
- 50. Скачать презентацию
































![Биологическая роль СО2 СО2 и функция гемоглобина [HCO3 в крови = 24 ± 1 мМ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/981966/slide-47.jpg)
 Выделительная система позвоночных
Выделительная система позвоночных Клетка и ее строение
Клетка и ее строение Тест по теме Свиньи 8 класс
Тест по теме Свиньи 8 класс Муравьи, их среда обитания
Муравьи, их среда обитания Пищеварение в кишечнике
Пищеварение в кишечнике Пути и направления эволюции. 11 класс. 2
Пути и направления эволюции. 11 класс. 2 Аттестационная работа. Вся правда о комарах
Аттестационная работа. Вся правда о комарах Классификация микроорганизмов. Морфология микроорганизмов. Классификация бактерий
Классификация микроорганизмов. Морфология микроорганизмов. Классификация бактерий Домашние питомцы
Домашние питомцы Классификация культурных растений
Классификация культурных растений Көк кит
Көк кит Пищеварение в ротовой полости
Пищеварение в ротовой полости Почка. Почечный барьер
Почка. Почечный барьер Тип Кишечнополостные
Тип Кишечнополостные Внешнее строение рыб
Внешнее строение рыб Жизненные циклы высших растений
Жизненные циклы высших растений Зимующие птицы
Зимующие птицы Море. Обитатели морей
Море. Обитатели морей Основы строения и физиологии кожи, волос и ногтей
Основы строения и физиологии кожи, волос и ногтей Грибы. Виды грибов
Грибы. Виды грибов Черепные нервы
Черепные нервы Хромосомы. Кариотип. Жизненный цикл клетки
Хромосомы. Кариотип. Жизненный цикл клетки Строение извитого семенного канальца млекопитающего (поперечный разрез)
Строение извитого семенного канальца млекопитающего (поперечный разрез) Belikova_Khoroshko_Fiziologicheskie_osnovy_motivatsii_i_emotsiy
Belikova_Khoroshko_Fiziologicheskie_osnovy_motivatsii_i_emotsiy Перелётные птицы
Перелётные птицы Фенологічна мінливість
Фенологічна мінливість Методы орнитологических исследований
Методы орнитологических исследований Активационная методика для бор-нейтроннозахватной терапии
Активационная методика для бор-нейтроннозахватной терапии