Содержание
- 2. …это проникновение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение
- 3. Основные загрязнители атмосферного воздуха: Оксид углерода Оксиды азота Диоксид серы Углеводороды Альдегиды Тяжёлые металлы Аммиак
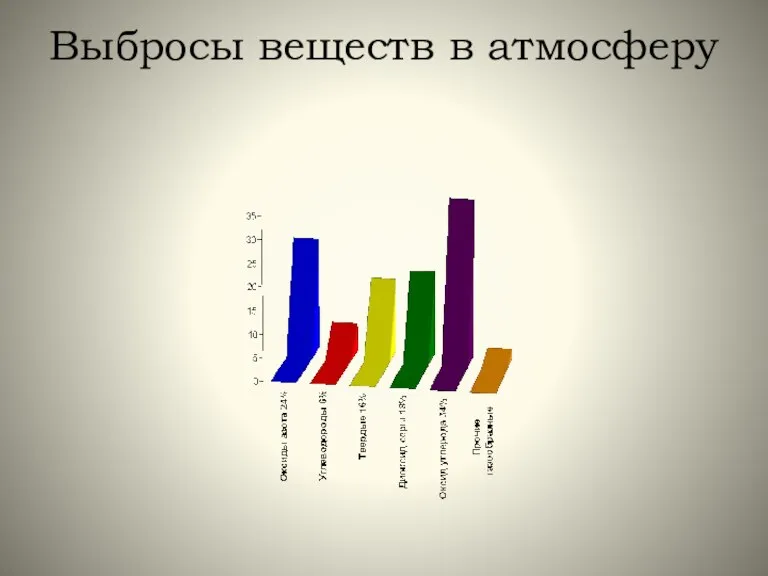
- 4. Выбросы веществ в атмосферу
- 5. ЗАКОН «О ЧИСТОМ ВОЗДУХЕ» ЗАКОН «О ЧИСТОМ ВОЗДУХЕ»
- 6. Последствия загрязнения атмосферы. Смог Смог-это туман, смешанный с пылью, сажей и ядовитыми газами. Смог оказывает влияние
- 8. Что такое угарный газ? Угарный газ (оксид углерода (II) — бесцветный ядовитый газ без вкуса и
- 9. Пирометаллургия - получение металлов и сплавов под действием высоких температур. Восстановление металлов угарным газом: PbO +
- 10. Физиологическое действие угарного газа на организм. Угарный газ очень ядовит. Первыми признаками острого отравления СО являются
- 11. Оксид углерода (IV) Углекислый газ Газ без цвета и запаха. Это кислотный оксид, ему соответствует двухосновная
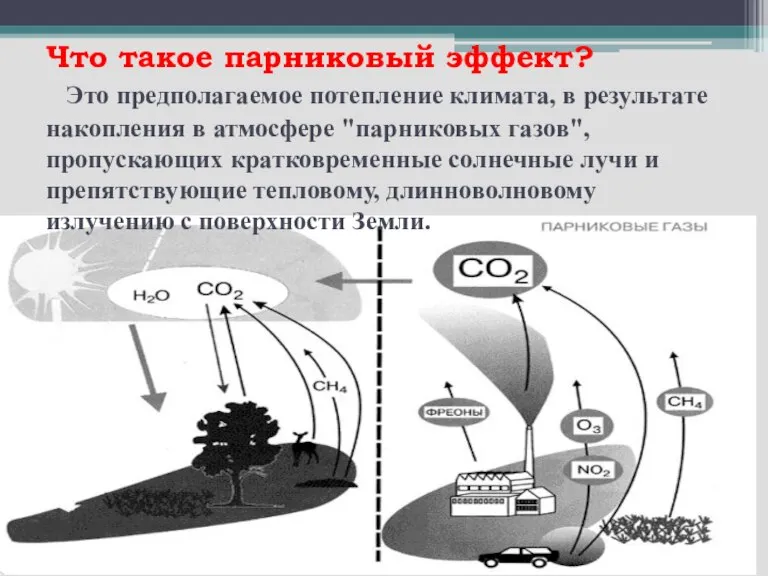
- 12. Что такое парниковый эффект? Это предполагаемое потепление климата, в результате накопления в атмосфере "парниковых газов", пропускающих
- 13. Применение углекислого газа
- 14. SO2 оксид серы(IV) Сернистый газ Физические свойства SO2 Химические свойства SO2 Кислотный оксид Обладает всеми свойствами
- 15. . Кислотные дожди Любая дождевая вода обладает очень слабой степенью кислотности. Однако при сгорании продуктов переработки
- 16. до после
- 17. Оксид азота (II) NO Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота и
- 18. Оксид азота (IV)- NO2 Кислотный оксид 2NO2 + H2O = HNO2 + HNO3 Ядовитый газ бурого
- 19. Применение азотной кислоты: - производство азотных и комбинированных удобрений, - взрывчатых веществ (тринитротолуола и др.), -
- 21. Меры по охране атмосферы от загрязнения: Разработать стандарты по выхлопным газам для автомобилей. Прекратить вырубку лесов.
- 23. Скачать презентацию

















 Пища. Питательные вещества и природные пищевые компоненты – важный экологический фактор
Пища. Питательные вещества и природные пищевые компоненты – важный экологический фактор очему мелеет река Луга? (исследовательская работа)
очему мелеет река Луга? (исследовательская работа) Забота о природе или горы мусора?
Забота о природе или горы мусора? Конкурс по сбору вторсырья
Конкурс по сбору вторсырья Экологическая документация. Государственная экологическая отчетность. Модуль 1
Экологическая документация. Государственная экологическая отчетность. Модуль 1 Аральское море
Аральское море Способы защиты растений и животных. Урок экологии 5 класс
Способы защиты растений и животных. Урок экологии 5 класс Помогите! Мусор вредит природе
Помогите! Мусор вредит природе Проектная работа Улилизация отходов
Проектная работа Улилизация отходов Человек и биосфера
Человек и биосфера Итоги деятельности Комитета по охране водных объектов Санкт-Петербурга в 2020 году
Итоги деятельности Комитета по охране водных объектов Санкт-Петербурга в 2020 году Экологические проблемы Урала
Экологические проблемы Урала Вопросы к игре Что? Где? Когда? Экология дома твоего
Вопросы к игре Что? Где? Когда? Экология дома твоего Станция юных натуралистов города Макеевки
Станция юных натуралистов города Макеевки Green Peace
Green Peace Мультимедийный тест 9 класс
Мультимедийный тест 9 класс Основные экологические проблемы современности. Загрязнение атмосферы, кислотные дожди
Основные экологические проблемы современности. Загрязнение атмосферы, кислотные дожди Экологическое и технологическое влияние на биосферу
Экологическое и технологическое влияние на биосферу Абиотические факторы среды и их влияние на живые организмы
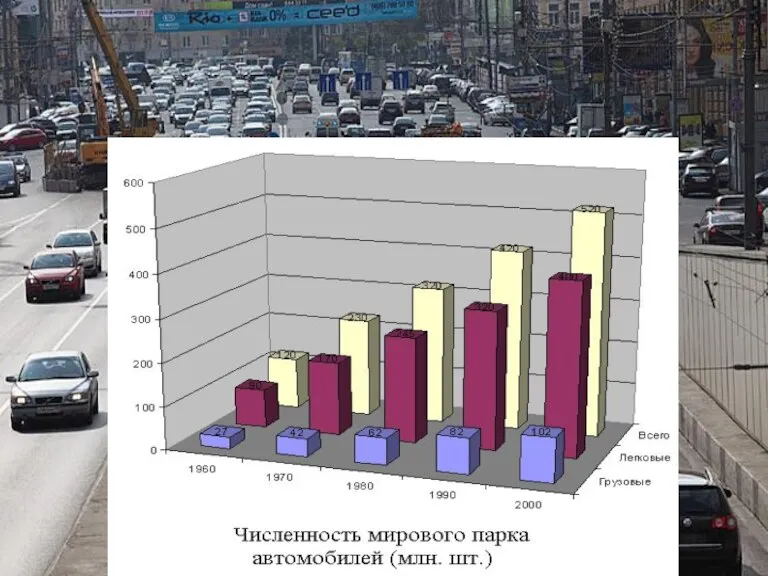
Абиотические факторы среды и их влияние на живые организмы Автотранспорт и загрязнение атмосферы
Автотранспорт и загрязнение атмосферы Физико-химические свойства биосферы
Физико-химические свойства биосферы  Отряд #БлагоТвори
Отряд #БлагоТвори Джанкойское отделение КРА Экология и мир
Джанкойское отделение КРА Экология и мир Я выбираю эко жизнь
Я выбираю эко жизнь Экологический факультет (ЭКФ) МГРИ
Экологический факультет (ЭКФ) МГРИ Химические вещества в нашей жизни: где они находятся?
Химические вещества в нашей жизни: где они находятся? Экологичные привычки
Экологичные привычки