Содержание
- 2. Основные термины: Термодинамическая система – совокупность макроскопических тел любой физико–химической природы, между которыми возможен теплообмен. Изолированная
- 3. Равновесной называется такая система, параметры состояния которой одинаковы во всех точках системы и не изменяются со
- 4. Масса молекул Относительная атомная масса А химического элемента – это отношение массы атома этого элемента к
- 5. Давление 1/6⋅(n⋅V) – количество молекул подлетающих в единицу времени к одной из стенок сосуда. 2∙m⋅vx –
- 6. Общий импульс, который получит стенка S, будет равен: V Разделим на S и dt Здесь υx
- 7. Температура Понятие температуры справедливо только для равновесного состояния. Согласно закону равномерного распределения энергии по степеням свободы,
- 8. Уравнение Менделеева-Клапейрона Идеальный газ – это газ, молекулы которого имеют пренебрежимо малый объём и не взаимодействуют
- 9. Закон Дальтона. Полное давление газа равно сумме парциальных давлений всех газов входящих в смесь. Уравнение Менделеева-Клапейрона
- 10. Внутренняя энергия. Работа и теплота. Внутренняя энергия является функцией состояния системы, независимо от предыстории системы. Изменение
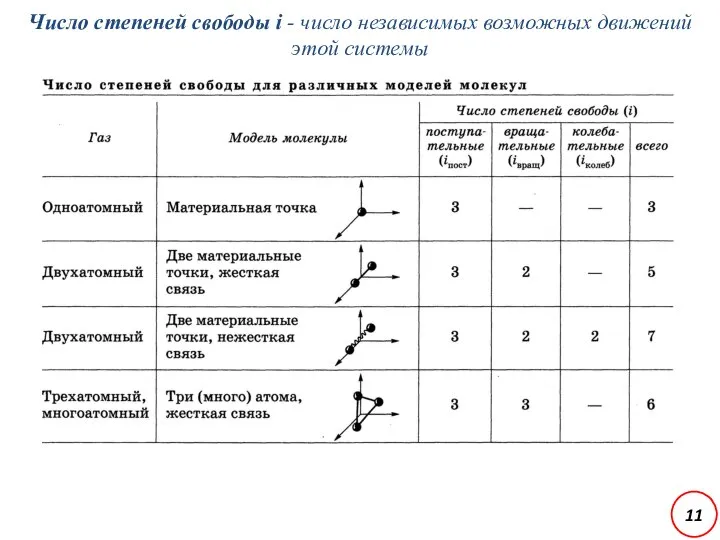
- 11. Число степеней свободы i - число независимых возможных движений этой системы 11
- 12. Обмен различными формами энергии характеризуется понятием совершения работы (А) и переданного количества теплоты (Q). Работа –
- 13. Изменение внутренней энергии тела равно разности сообщенной телу теплоты и произведённой телом работы. Количество теплоты, сообщённое
- 14. Если речь идёт не о малом, а макроскопическом изменении состояния, то нужно записать следующим образом Важно
- 16. Скачать презентацию












 Электромагниты. 8 класс
Электромагниты. 8 класс Презентация на тему Сила трения
Презентация на тему Сила трения  Введение в предмет Микросхемотехника
Введение в предмет Микросхемотехника Резисторы и Реостаты. Занятие 7
Резисторы и Реостаты. Занятие 7 Резонансные методы передачи электрической энергии
Резонансные методы передачи электрической энергии Закон Максвелла. Электромагнитное поле
Закон Максвелла. Электромагнитное поле Электризация тел
Электризация тел Как устроен строительный экскаватор и что такое гидравлический цилиндр?
Как устроен строительный экскаватор и что такое гидравлический цилиндр? Магнетизм. Структурно-логическая схема. Условные обозначения
Магнетизм. Структурно-логическая схема. Условные обозначения Работа по физике. Правду ли говорят
Работа по физике. Правду ли говорят Презентация на тему Влияние магнитных полей на живые организмы
Презентация на тему Влияние магнитных полей на живые организмы  Рулевое устройство
Рулевое устройство Фотометрия и светотехника. ВИК - простая форма обучения
Фотометрия и светотехника. ВИК - простая форма обучения Скин-фактор. Различные режимы притока. Уравнение притока
Скин-фактор. Различные режимы притока. Уравнение притока Дозиметрия. Период полураспада. Закон радиоактивного распада
Дозиметрия. Период полураспада. Закон радиоактивного распада Покоривший волны
Покоривший волны Расчет характеристик световой волны. Практическая работа №21
Расчет характеристик световой волны. Практическая работа №21 Поколения ядерных реакторов. Лекция 6
Поколения ядерных реакторов. Лекция 6 Мир вокруг нас
Мир вокруг нас Инструменты и приборы
Инструменты и приборы Механическая работа. Единицы работы
Механическая работа. Единицы работы Спектроскопические методы анализа
Спектроскопические методы анализа Решения задач по теме Плавление и отвердевание кристаллических тел
Решения задач по теме Плавление и отвердевание кристаллических тел Металлы. Дендрит Д.К. Чернова
Металлы. Дендрит Д.К. Чернова Количество теплоты
Количество теплоты Методы инструментального выявления недостоверного учета электрической энергии
Методы инструментального выявления недостоверного учета электрической энергии Презентация на тему Оптические приборы
Презентация на тему Оптические приборы  Активация в ядерной физике. (Тема 2.8)
Активация в ядерной физике. (Тема 2.8)