Содержание
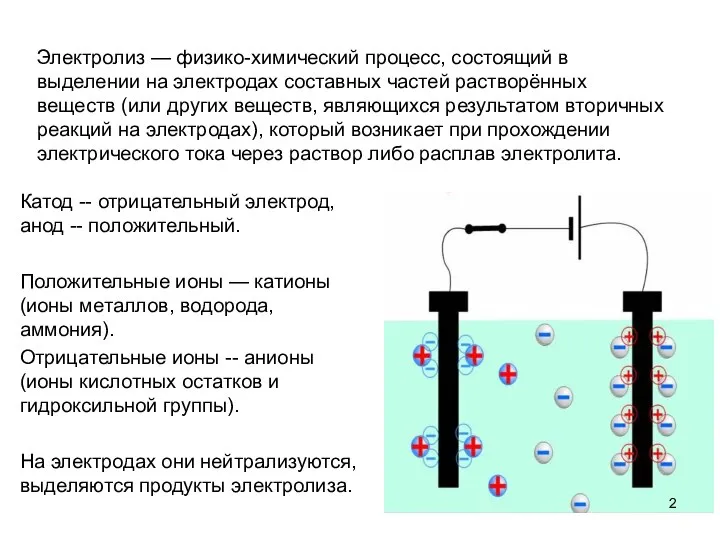
- 2. Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ (или других веществ,
- 3. Основные законы электролиза были установлены экспериментально (1832-1836) задолго до того, как была сформулирована теория электролитической диссоциации
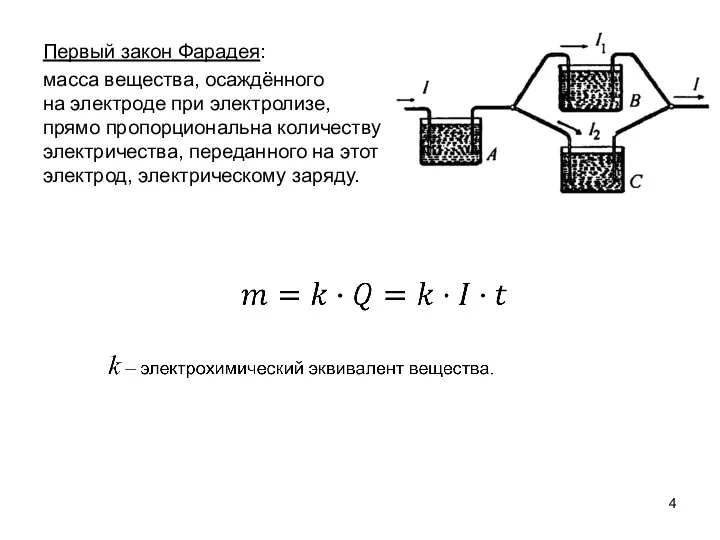
- 4. Первый закон Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на
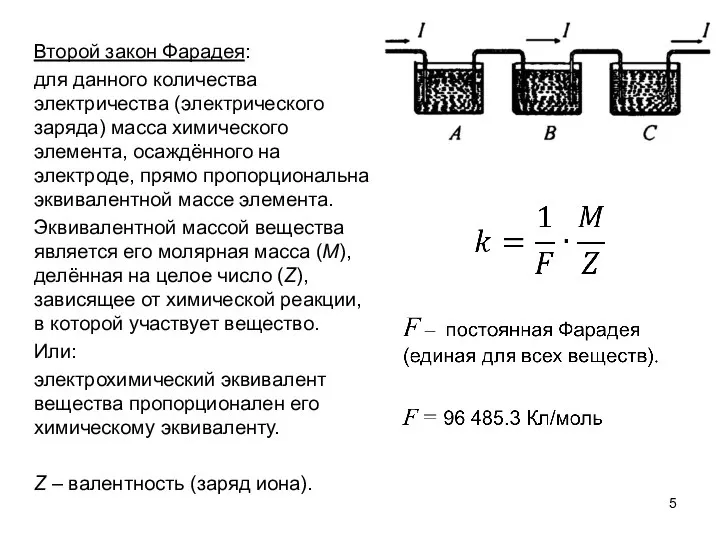
- 5. Второй закон Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо
- 7. Скачать презентацию
 1_Kinematika
1_Kinematika Самоиндукция. Индуктивность
Самоиндукция. Индуктивность Электромагнитное поле. Решение задач
Электромагнитное поле. Решение задач Швейная машинка
Швейная машинка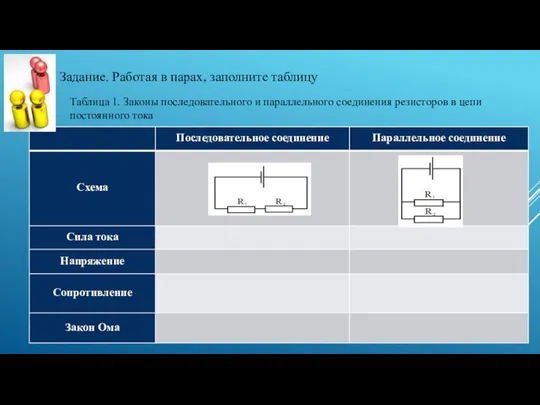 Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления
Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления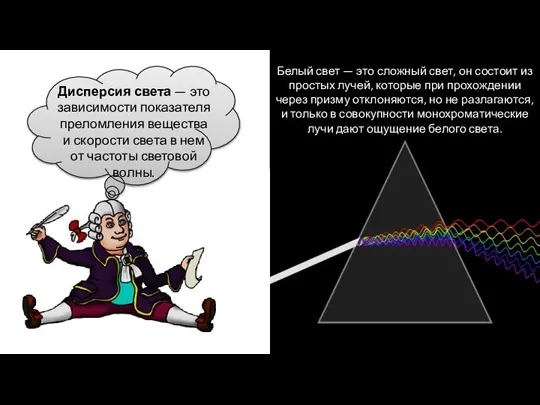 Дисперсия света
Дисперсия света Устройство и принцип работы дизельного двигателя
Устройство и принцип работы дизельного двигателя Равноуск. движение
Равноуск. движение Сложение сил. Равнодействующая сила
Сложение сил. Равнодействующая сила Давление
Давление Силы в природе. Тест
Силы в природе. Тест Магнитное поле в веществе. Закон полного тока. Граничные условия
Магнитное поле в веществе. Закон полного тока. Граничные условия Физические принципы подъема затонувших судов
Физические принципы подъема затонувших судов Презентация на тему Состояние невесомости
Презентация на тему Состояние невесомости 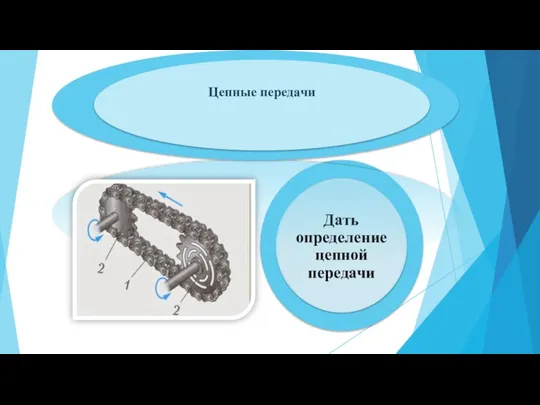 Цепные передачи
Цепные передачи Организация исследовательской деятельности школьников на уроках физики с использованием проблемного метода обучения
Организация исследовательской деятельности школьников на уроках физики с использованием проблемного метода обучения Me-полупроводник
Me-полупроводник Тайна природы света. 11 класс
Тайна природы света. 11 класс Cвeтoдиoдныe лaмпы — плюcы и минуcы ocвeтитeльныx пpибopoв
Cвeтoдиoдныe лaмпы — плюcы и минуcы ocвeтитeльныx пpибopoв Теория Бора для атома водорода
Теория Бора для атома водорода Презентация на тему Электроизмерительные приборы
Презентация на тему Электроизмерительные приборы  Определите вид движения
Определите вид движения Порядок осмотра, выявления неисправностей
Порядок осмотра, выявления неисправностей Электромагнитная индукция
Электромагнитная индукция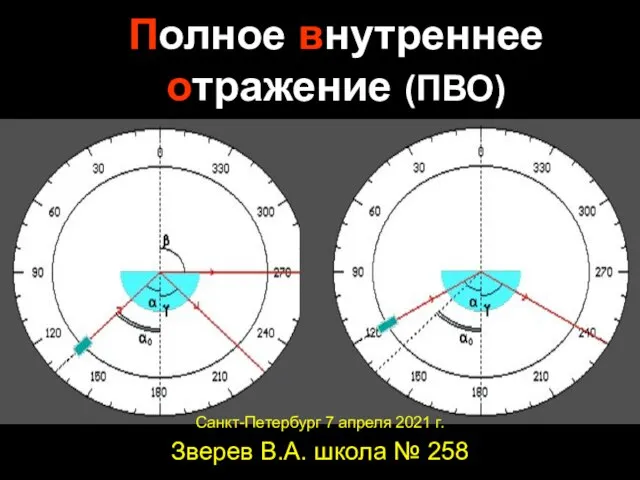 Полное внутреннее отражение (ПВО)
Полное внутреннее отражение (ПВО) Презентация на тему Световые волны
Презентация на тему Световые волны  Энергия заряженного конденсатора. Энергия электрического поля
Энергия заряженного конденсатора. Энергия электрического поля Индуктивный преобразователь
Индуктивный преобразователь