Содержание
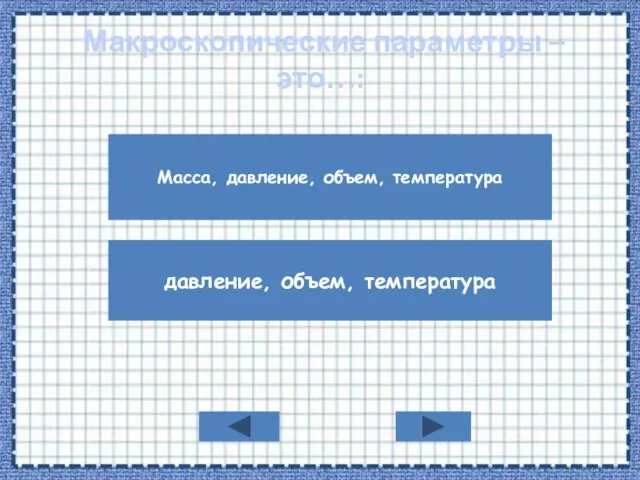
- 2. Макроскопические параметры – это…: Масса, давление, объем, температура давление, объем, температура
- 3. Состояние газа данной массы характеризуется тремя макроскопическими параметрами: давлением– р, объемом – V и температурой –
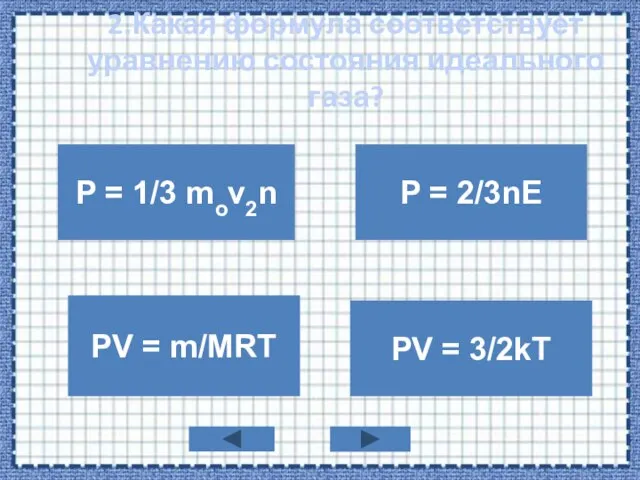
- 4. 2.Какая формула соответствует уравнению состояния идеального газа? P = 1/3 mov2n PV = m/MRT P =
- 5. Ответ неверен! Повтори теорию!
- 6. Молодец! Можешь приступать к следующему вопросу
- 7. Ответ неверен! Повтори теорию!
- 8. Уравнение, связывающее все три макроскопических параметра р, V и T, характеризующие состояние достаточно разряженного газа данной
- 9. Молодец! Можешь приступать к следующему вопросу
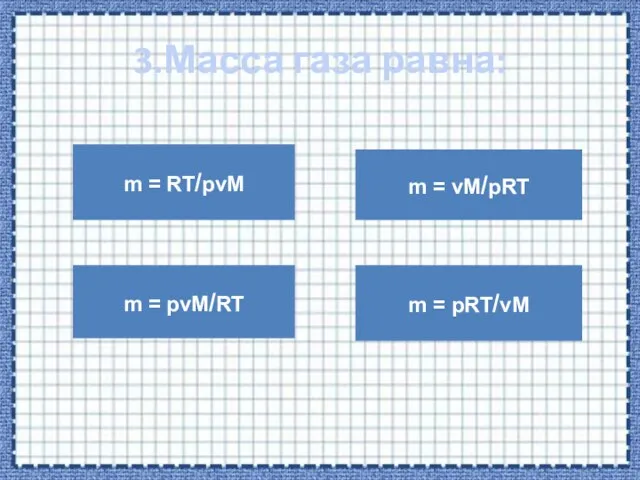
- 10. 3.Масса газа равна: m = RT/pvM m = pvM/RT m = vM/pRT m = pRT/vM
- 11. Молодец! Можешь приступать к следующему вопросу
- 12. Ответ неверен! Повтори теорию!
- 13. pv = m/MRT Чтобы выразить неизвестную величину из уравнения Менделеева – Клапейрона, умножь левую и правую
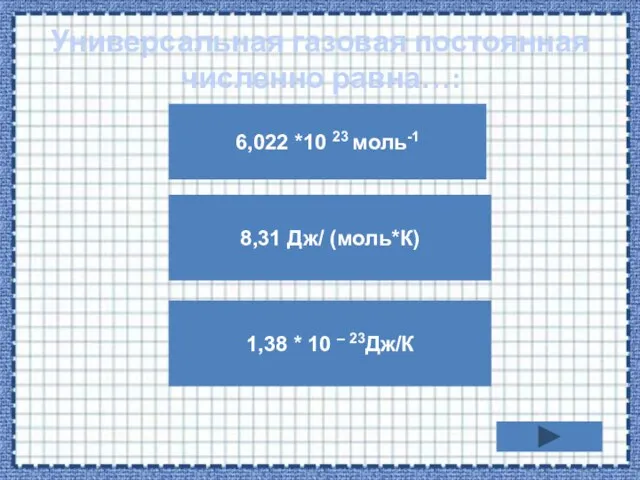
- 14. Универсальная газовая постоянная численно равна…: 6,022 *10 23 моль-1 1,38 * 10 – 23Дж/К 8,31 Дж/
- 15. Ответ неверен! Повтори теорию!
- 16. Молодец! Можешь приступать к следующему вопросу
- 17. Произведение постоянной Больцмана к и постоянной Авогадро Na называют универсальной газовой постоянной и обозначают буквой R
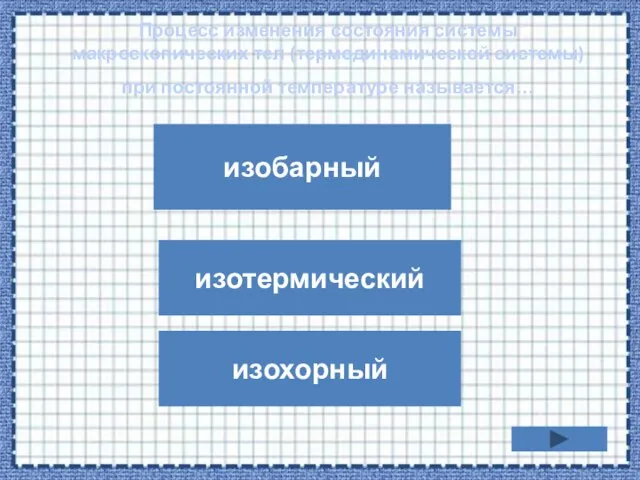
- 18. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называется… изобарный изохорный изотермический
- 19. pv = const Согласно уравнению состояния газа в любом состоянии с неизменной температурой произведение давления газа
- 20. Молодец! Можешь приступать к следующему вопросу
- 21. Ответ неверен! Повтори теорию!
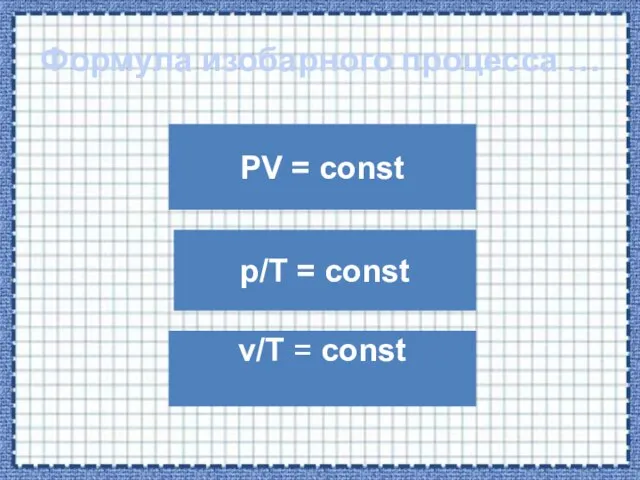
- 22. Формула изобарного процесса … PV = const v/T = const p/T = const
- 23. Ответ неверен! Повтори теорию!
- 24. Молодец! Можешь приступать к следующему вопросу
- 25. P = const Для данной массы газа отношение объема к температуре постоянно, если давление газа не
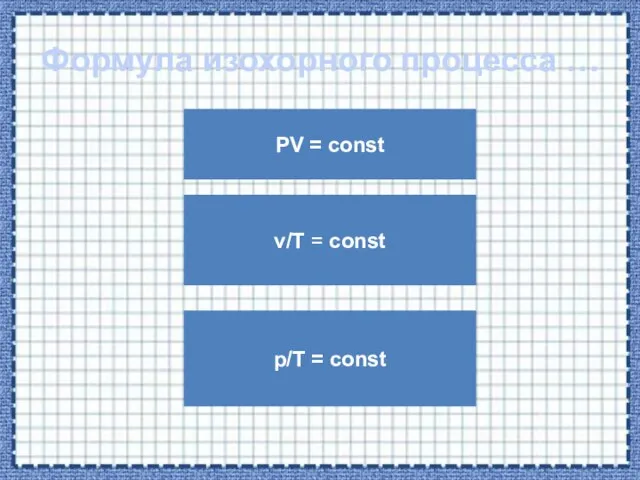
- 26. Формула изохорного процесса … PV = const p/T = const v/T = const
- 27. Ответ неверен! Повтори теорию!
- 28. Молодец! Можешь приступать к следующему вопросу
- 29. p/T = const Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Газовый закон Шарля.
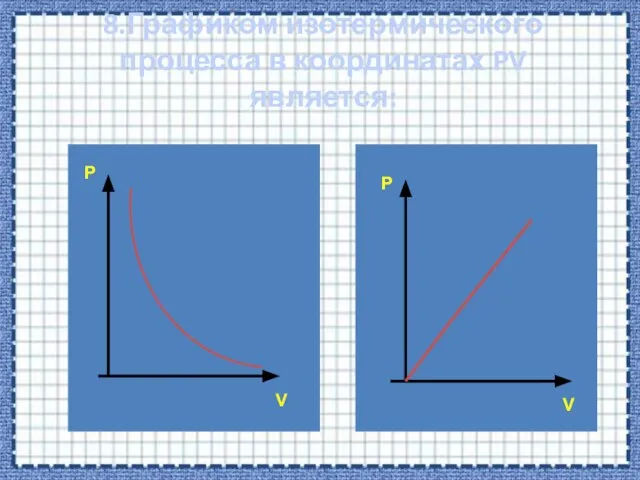
- 30. 8.Графиком изотермического процесса в координатах PV является: P P V V
- 31. Молодец! Можешь приступать к следующему вопросу
- 32. Ответ неверен! Повтори теорию!
- 33. Р V Зависимость между давлением и объемом в изотермическом процессе обратно пропорциональная. Графиком в координатах PV
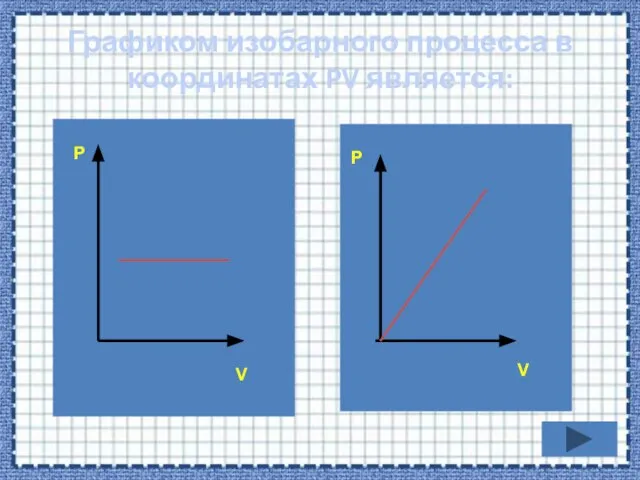
- 34. Графиком изобарного процесса в координатах PV является: P V P V
- 35. Молодец! Можешь приступать к следующему вопросу
- 36. Ответ неверен! Повтори теорию!
- 37. Если процесс изобарный давление постоянно, в координатах PV график прямая линия параллельная оси объема. Р V
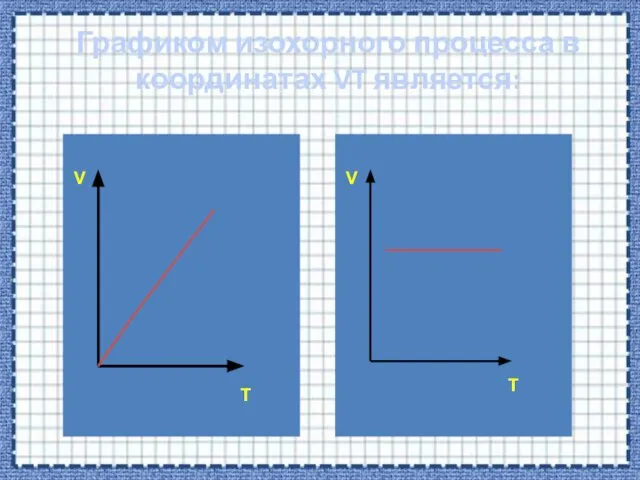
- 38. Графиком изохорного процесса в координатах VT является: V V T T
- 39. Молодец! Можешь приступать к следующему вопросу
- 40. Ответ неверен! Повтори теорию!
- 41. V T Если процесс изохорный объем постоянный, в координатах VT график - прямая линия параллельная оси
- 42. Реши задачу: В сосуде вместимостью 500 см3 содержится 0,89 г водорода при температуре 170С. Определите давление
- 43. Молодец! Задача решена правильно! Решим еще!
- 44. Ответ неверен! Проанализируй правильное решение задачи
- 45. Дано: V=500см3 =500*10-6м3 m = 0,89г = 0,89 *10-3кг T = 2900К R = 8,31 Дж/моль
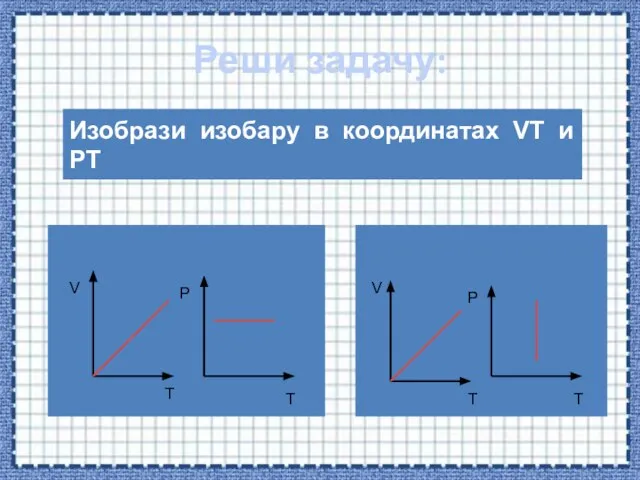
- 46. Реши задачу: Изобрази изобару в координатах VT и PT V T P T V T P
- 47. Поздравляю! Ты знаешь данную тему
- 49. Скачать презентацию



































 Электрическое_поле_в_вакууме_лекция
Электрическое_поле_в_вакууме_лекция Частицы с отрицательной энергией в эргосфере чёрных дыр
Частицы с отрицательной энергией в эргосфере чёрных дыр Свойства воздуха
Свойства воздуха Законы Ньютона
Законы Ньютона Солнечные батареи: принцип работы и применение
Солнечные батареи: принцип работы и применение Презентация на тему Механическая энергия. Закон сохранения энергии
Презентация на тему Механическая энергия. Закон сохранения энергии  Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Презентация на тему Единица электрического заряда
Презентация на тему Единица электрического заряда  Лазер, устройство лазера
Лазер, устройство лазера Физические основы микро и наноэлектроники
Физические основы микро и наноэлектроники Интерференция, дифракция, поляризация
Интерференция, дифракция, поляризация Молекулярно-кинетическая теория (МКТ) и термодинамика (лекция 5)
Молекулярно-кинетическая теория (МКТ) и термодинамика (лекция 5) Состав ядра. Ядерные силы
Состав ядра. Ядерные силы Электрический ток в вакууме
Электрический ток в вакууме Газовый разряд и его классификации
Газовый разряд и его классификации Размерность Минковского. Вычисление размерности
Размерность Минковского. Вычисление размерности Механика. Лекция 6. Момент инерции. Уравнение моментов
Механика. Лекция 6. Момент инерции. Уравнение моментов Теория групп и квантовая физика ХХ век
Теория групп и квантовая физика ХХ век Термометры биметаллические показывающие в диапазоне измерения температур от минус 50 до плюс 200° С
Термометры биметаллические показывающие в диапазоне измерения температур от минус 50 до плюс 200° С Закон сохранения и превращения механической энергии. 10 класс
Закон сохранения и превращения механической энергии. 10 класс Основные приемы резания тонколистого металла и проволоки
Основные приемы резания тонколистого металла и проволоки Законы Ньютона (10 класс)
Законы Ньютона (10 класс) Метод конденсации в среде инертного газа
Метод конденсации в среде инертного газа Влияние электромагнитного излучения на организм и здоровье человека
Влияние электромагнитного излучения на организм и здоровье человека Презентация "Электрические явления" - скачать
Презентация "Электрические явления" - скачать Мини ядерный реактор
Мини ядерный реактор лекция 1 (2)
лекция 1 (2) Электрический ток. 8 класс
Электрический ток. 8 класс