Слайд 2 Такое поведение объясняется квантованием энергии молекул.
В области низких температур величина

теплоемкости
CV= 3R/2, что соответствует вырождению вращательных и колебательных степеней свободы. Чтобы молекула начала вращаться, ей необходимо сообщить энергию для
перехода на возбужденный вращательный уровень.
Минимальная энергия для такого перехода ΔEr = ħ2/I. Возбуждение может происходить только при столкнове-ниях c молекулами, обладающими достаточной энергией. Т.к. средняя энергия теплового движения ~kT, то при kT<< ΔEr этой энергии недостаточно для возбуждения вращений. В этом случае при вычислении теплоемкости вращения можно не учитывать. В противоположном случае, когда kT>>ΔEr , возбуждается много вращатель-ных уровней. Тогда дискретность уровней становится несущественной и применима классическая теория.
Слайд 3 Характеристическая температура для вращения молекул определяется ф-лой Тr = ħ2/kI.

Для молекулы Н2: I = 2mR2 = {m =1,67∙10−27 кг, R= 0,4Ǻ}= 5,3∙10−48 кг∙м2. → → Тr ~150 K.
Резюме При Т>>Тr справедлива классическая теория; при Т<<Тr вращательные степени свободы “заморожены”.
Аналогично оценивается характеристич. температура
для колебаний молекул Tv=ΔEv/k=ħωv/k.
Для водорода Tv ~ 5000 K.
Слайд 4 § 2.7. ПОЛИТРОПИЧЕСКИЕ ПРОЦЕССЫ
Политропическими называют процессы, при которых теплоемкость

системы С является постоянной величиной. Можно показать, что уравнением политропического процесса идеального газа является уравнение
Здесь − показатель политропы.
Все рассмотренные ранее изопроцессы относятся к категории политропических процессов. Легко видеть, что значения n для изопроцессов равны:
процесс // изобар. изотерм. адиабат. изохор.
n // 0 1 γ ∞ .
Работу газа в политропическом процессе легче всего вычислить с помощью 1-го начала:
Слайд 5 § 3.5. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ
Установим связь между макроскопической формулиров-кой

2-го начала dS ≥ δQ/T и статистической теорией.
С молекулярно-кинетической точки зрения любое макро-состояние системы (характеризуемое через p, V, T,…) может быть реализовано различными способами (микро-состояниями), характеризуемыми состоянием каждой из входящих в систему молекул (их координат и скоростей). Число различных микросостояний, соответствующих данному макросостоянию, называют статистическим весом G макросостояния. Эргодическая гипотеза утверждает, что все микросостояния равновероятны. Отсюда следует пропорциональность вероятности реали-зации некоторого состояния системы Р его статистичес-кому весу: P = G∙w,
где w − вероятность каждого из микросостояний данного макросостояния.
Слайд 6 Если система находится в неравновесном состоянии, то
она самопроизвольно (спонтанно) будет переходить
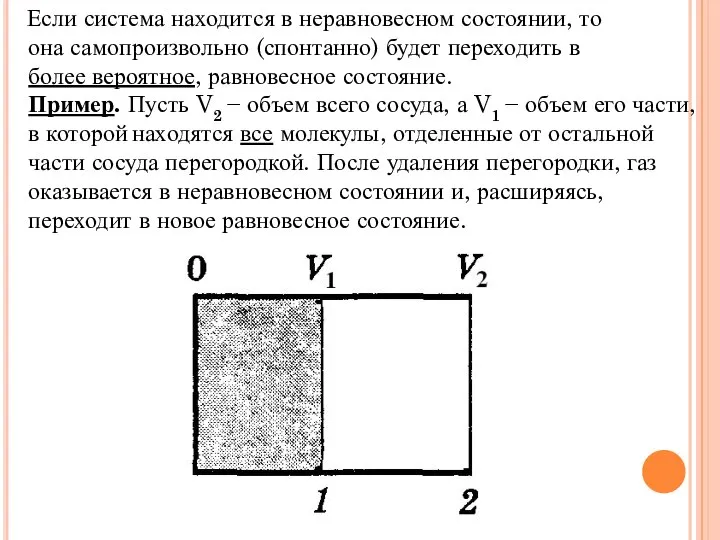
в
более вероятное, равновесное состояние.
Пример. Пусть V2 − объем всего сосуда, а V1 − объем его части, в которой находятся все молекулы, отделенные от остальной части сосуда перегородкой. После удаления перегородки, газ оказывается в неравновесном состоянии и, расширяясь, переходит в новое равновесное состояние.
Слайд 7 Вместе с тем, согласно 2-му началу, все самопроизвольные процессы в замкнутых

макросистемах сопровождаются увеличением энтропии. Поэтому логично предположить (идея Больцмана), что между энтропией S макросистемы
в некотором состоянии и вероятностью Р того же состояния должна существовать связь. Установим её.
Рассмотрим необратимый процесс расши-
рения идеального газа в пустоту в тепло-
изолированном сосуде от объёма V1 до
объёма V2. Т.к. при теплоизолированном
расширении в вакуум ∆U = 0, то тем-ра
идеального газа остаётся без изменений.
Поскольку S − функция состояния, то её приращение в этом необратимом процессе можно вычислить с помощью некоторого обратимого процесса, который переводил бы газ в то же самое конечное состояние.
Слайд 8 Здесь в качестве такого процесса можно использовать изотермическое квазиравновесное расширение
где N

= νNA − число молекул в газе.
Теперь рассмотрим возможности реализации каждого из состояний. В рассмотренном процессе распределение по скоростям в начальном и конечном состояниях одинаково, т.к. оно зависит только от тем-ры Т, которая не измени-лась. Пространственные же возможности распределения молекул увеличились. Т.к. молекулы беспорядочно дви- жутся, то каждая из них с одинаковой вероятностью бывает во всех частях сосуда. Поэтому число возможных положений, а потому и число различных состояний неко-
торой молекулы увеличилось в V2/V1 раз.
Слайд 9 Т.к. положение некоторой другой молекулы не зависит
от того, где находится

1-я, то число её микросостояний также возрастает в V2/V1 раз.
Следовательно, число различных микросостояний
системы из двух молекул возрастёт в (V2/V1)2 раз. Для
всех же N молекул число возможных микросостояний увеличится в G2/G1 = (V2/V1)N раз.
Поэтому приращение энтропии можно записать как
Полученное соотношение называют ф-лой Больцмана.
Строгий вывод ф-лы (Б) даётся в теор. физике.
Анализ принципа возрастания энтропии ( IIЗ) со статис- тической точки зрения приводит к фундаментальному выводу: все замкнутые макросистемы стремятся перехо- дить от состояний менее вероятных к более вероятным.
Слайд 10 Переход к более вероятному состоянию с бóльшим значе-нием энтропии представляет собой

переход к более беспорядочному состоянию. Действительно, увеличение энтропии системы dS = δQ/T соответствует сообщению системе теплоты δQ, которое увеличивает степень беспорядка (хаоса) в системе. Равновесному, наиболее вероятному состоянию, в котором энтропия достигает максимума S=max, отвечает достижение максимального “хаоса” в системе.
Резюме. Энтропия является мерой степени беспорядка в системе.
П. Флуктуации. По законам статистики возможны, хотя и маловероятны, и противоположные процессы, в рез-те которых энтропия убывает. Причиной таких процессов являются флуктуации − хаотические отклонения тех или иных величин от их средних значений.
Слайд 11 Например, в состоянии равновесия число молекул, нахо- дящихся в объёме V1

сосуда, обычно близко к среднему значению N1=N∙V1/V2. Наличие флуктуаций приводит к отклонению от среднего значения. Но чем больше откло-нение, тем менее вероятна такая флуктуация. В прин-ципе, может случиться, что все молекулы соберутся в объёме V1. Однако вероятность Р=(V1/V2)N такого события необыкновенно мала. Например, пусть V2=2V1, N=NA. Тогда
что соответствует практически невероятному событию.
Резюме. Статистический смысл 2-го начала заключа-ется в том, что за каким-либо состоянием системы в подавляющем большинстве случаев следуют еще более вероятные состояния.
Слайд 12 § 3.6. ТЕОРЕМА НЕРНСТА
Теорема Нернста утверждает: при приближении темпе-
ратуры

к абсолютному нулю энтропия стремится к
определенному конечному пределу S0.
Действительно, при абсолютном нуле температур энергия системы минимальна. Число G0 допустимых квантовых состояний системы при этом также достигает минимума. Оно равно G0 =1, либо какому-то целому числу, равному кратности вырождения состояния с минимальной энер-гией. Поэтому для энтропии также получается конечное значение
Если условиться считать, что S0=0, то всякая неоднознач-ность в определении энтропии исчезнет. Энтропию,
определенную таким образом, называют абсолютной энтропией. Теорему Нернста нельзя вывести из первых двух начал т/д, поэтому её часто называют 3-им началом термодинамики.
Слайд 13 ГЛАВА 4. ТВЕРДЫЕ ТЕЛА
§ 4.1. Типы кристаллов
Под

твердыми телами здесь понимаются кристалличес-кие в-ва. Другой тип твердых тел − аморфные в-ва − можно отнести к твердым только по признаку сохранения формы. По всем остальным они (стекло, смолы, пластмас-сы) ведут себя как жидкости с аномально высокой вязкостью. ◄!энергетика структурирования►
Устойчивая структура кристаллов обусловлена взаимо-действием между их структурными частицами. В зависимости от природы частиц в узлах решетки и от характера вз-вия различают 4 типа кристаллов:
ионные, атомные, молекулярные и металлические.
Слайд 14 1. Ионные кристаллы. В узлах находятся ионы противо-положных знаков; вз-вие в
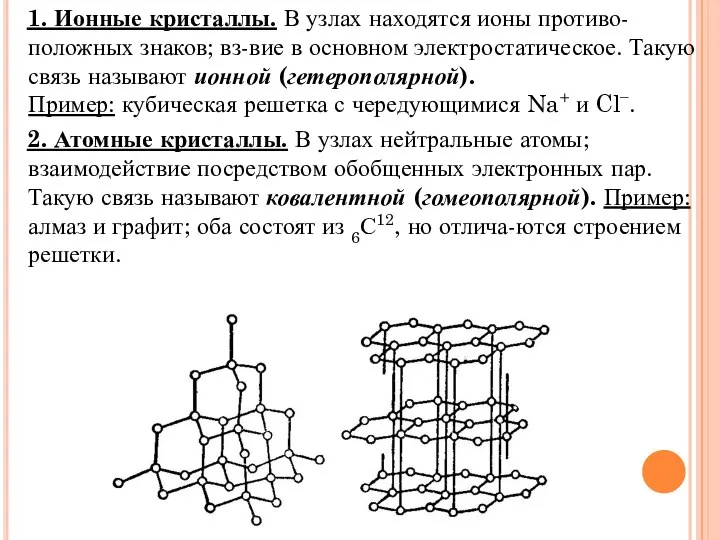
основном электростатическое. Такую связь называют ионной (гетерополярной).
Пример: кубическая решетка с чередующимися Na+ и Cl−.
2. Атомные кристаллы. В узлах нейтральные атомы;
взаимодействие посредством обобщенных электронных пар.
Такую связь называют ковалентной (гомеополярной). Пример: алмаз и графит; оба состоят из 6С12, но отлича-ются строением решетки.
Слайд 15 3. Молекулярные кристаллы. В узлах молекулы с ориентированными в направлении соседей

дипольными моментами. Такое взаимодействие между молекулами называют вандерваальсовым. Эта связь слабая; поэтому молекулярные кристаллы легко летучи.
Пример: нафталин.
4. Металлические кристаллы. В узлах положительные ионы. Пр-во между ними заполнено свободными электро-нами. Такую связь называют металлической. Наличием свободных электронов объясняется высокая проводимость металлов.
Слайд 16§ 4.2. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
П. Классическая теория. Простейшая модель тв. тела

− кристаллич. решетка, в узлах которой расположены тождест-венные атомы, совершающие тепловые колебания. Расстояние между атомами ~1,5÷2Å, амплитуда колебаний ~0,1Å. Энергия этих колебаний составляет основную часть внутренней энергии твердого тела.
Каждый атом обладает 3-мя колебат. степенями свободы.
Следовательно, внутренняя энергия одного моля твердого тела
U = NA∙3kT = 3RT. Отсюда получаем молярную теплоёмкость
твердого тела:
− закон Дюлонга и Пти
Опыт (Рис. CV) показывает, что для многих твердых тел закон (СДП) выполняется лишь при весьма высокой Т, а при обычной температуре CV < 3R. При низкой же Т теплоёмкость всех
веществ быстро убывает, стремясь к нулю по закону С ~ Т3.















 Diagnostirovanie_i_TO_transmissii
Diagnostirovanie_i_TO_transmissii Основные характеристики гребных винтов
Основные характеристики гребных винтов Техническая механика. Раздел: Теоретическая механика. Лекция 1
Техническая механика. Раздел: Теоретическая механика. Лекция 1 Механические волны
Механические волны Зенкерование и развертывание отверстий
Зенкерование и развертывание отверстий Сверхпроводимость. Эффект Мейсснера
Сверхпроводимость. Эффект Мейсснера Кинематика. Равномерное прямолинейное движение
Кинематика. Равномерное прямолинейное движение Топливный бак. Назначение, устройство
Топливный бак. Назначение, устройство Теория кварков
Теория кварков Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Первый закон термодинамики
Первый закон термодинамики Физика и технология наноструктур
Физика и технология наноструктур Законы Ньютона. Введение в космодинамику
Законы Ньютона. Введение в космодинамику Ядерный реактор
Ядерный реактор Аксиомы динамики
Аксиомы динамики Нагревание проводников электрическим током. Закон Джоуля – Ленца. 8 класс
Нагревание проводников электрическим током. Закон Джоуля – Ленца. 8 класс Ракетный двигатель. Импульс тела
Ракетный двигатель. Импульс тела Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Нобелевская премия. Физика и религия. Высшая цель физика
Нобелевская премия. Физика и религия. Высшая цель физика Строительный экскаватор. Гидравлический цилиндр
Строительный экскаватор. Гидравлический цилиндр Элементы машиноведения. Составные части машин
Элементы машиноведения. Составные части машин Строение атомов химических элементов
Строение атомов химических элементов Презентация на тему Шкала электромагнитных излучений
Презентация на тему Шкала электромагнитных излучений  Магнитное поле Земли 8 класс - Презентация
Магнитное поле Земли 8 класс - Презентация Презентация на тему Взаимодействие тел
Презентация на тему Взаимодействие тел  Современное состояние прецизионной кварцевой стабилизации частоты применительно к задачам частотно-временного обеспечения
Современное состояние прецизионной кварцевой стабилизации частоты применительно к задачам частотно-временного обеспечения Буровые машины для открытых горных пород. Лекция 8
Буровые машины для открытых горных пород. Лекция 8 Газораспределительный механизм
Газораспределительный механизм