Содержание
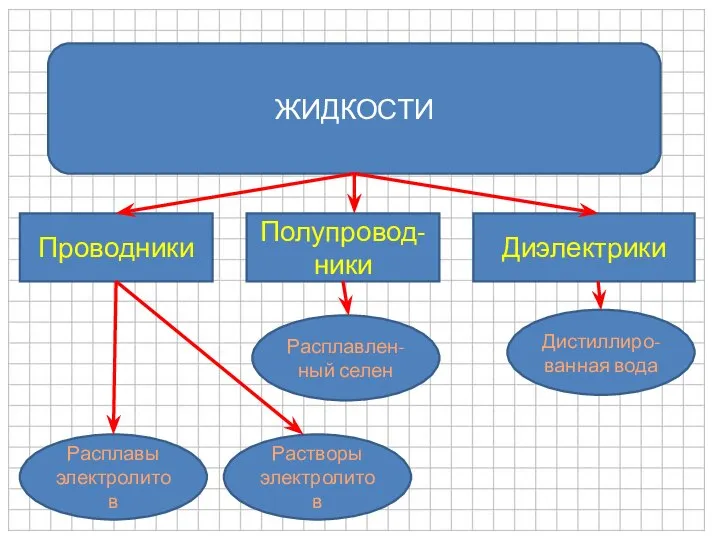
- 2. ЖИДКОСТИ Проводники Полупровод-ники Диэлектрики Расплавы электролитов Растворы электролитов Расплавлен-ный селен Дистиллиро-ванная вода
- 3. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ Электролитическая диссоциация – процесс распада нейтральных молекул электролита на положительные и отрицательные
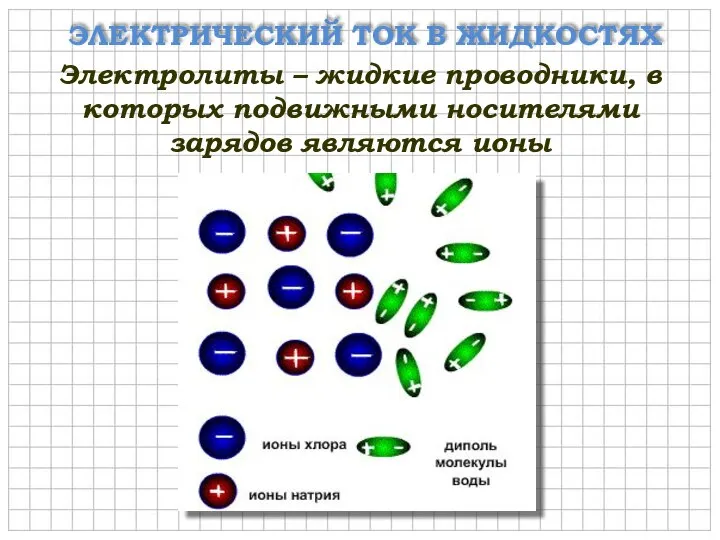
- 4. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ Электролиты – жидкие проводники, в которых подвижными носителями зарядов являются ионы
- 5. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ Степень диссоциации (отношение распавшихся на ионы молекул к числу первоначально имеющихся) зависит:
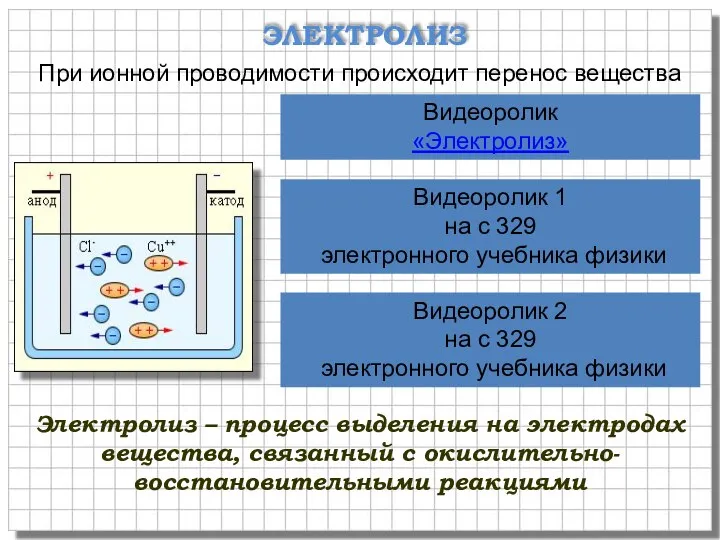
- 6. ЭЛЕКТРОЛИЗ При ионной проводимости происходит перенос вещества Видеоролик «Электролиз» Видеоролик 1 на с 329 электронного учебника
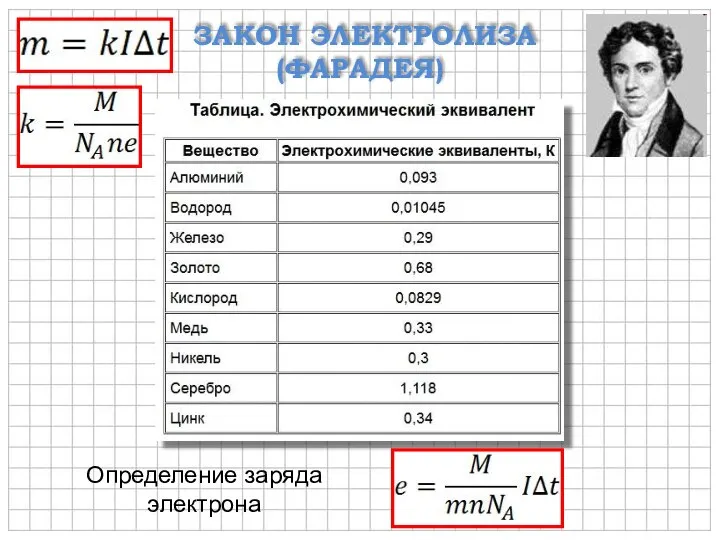
- 7. ЗАКОН ЭЛЕКТРОЛИЗА (ФАРАДЕЯ) k – электрохимический эквивалент (кг/Кл) Закон электролиза (Фарадея): масса вещества, выделившегося на электроде
- 8. ЗАКОН ЭЛЕКТРОЛИЗА (ФАРАДЕЯ) Определение заряда электрона
- 9. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Гальваностегия – декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование,
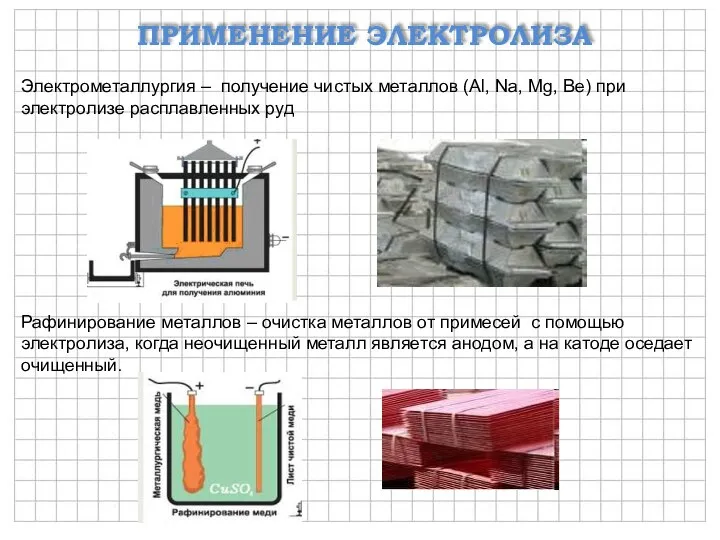
- 10. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Электрометаллургия – получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд Рафинирование
- 12. Скачать презентацию




 Ресурс долота. Понятия и расчеты
Ресурс долота. Понятия и расчеты Газовые законы. Решение задач на газовые законы. 10 класс
Газовые законы. Решение задач на газовые законы. 10 класс Закон Снеллиуса (отражения) для монотипных волн
Закон Снеллиуса (отражения) для монотипных волн Колебательное движение. Свободные колебания
Колебательное движение. Свободные колебания Закон сохранения импульса
Закон сохранения импульса История развития наноматериалов и нанотехнологий
История развития наноматериалов и нанотехнологий Расчет токовой защиты нулевой последовательности в сети с глухозаземленной нейтралью
Расчет токовой защиты нулевой последовательности в сети с глухозаземленной нейтралью Вопросы и задачи к ГИА по направлению подготовки Менеджмент профиль Производственный менеджмент
Вопросы и задачи к ГИА по направлению подготовки Менеджмент профиль Производственный менеджмент Физическая величина
Физическая величина Средства измерений и контроля с оптическим и оптико-механическим преобразованием
Средства измерений и контроля с оптическим и оптико-механическим преобразованием Различные свойства вещества
Различные свойства вещества Элементы теории относительности
Элементы теории относительности Неразъёмные соединения. (Лекция 4)
Неразъёмные соединения. (Лекция 4) Топографические и лучевые векторные диаграммы
Топографические и лучевые векторные диаграммы Прямолинейное равномерное движение
Прямолинейное равномерное движение التداخل والحيود
التداخل والحيود Явление электромагнитной индукции
Явление электромагнитной индукции Относительность движения
Относительность движения ВКР: Организация работ по эксплуатации электропривода главного движения станка модели 16К20ПФ1
ВКР: Организация работ по эксплуатации электропривода главного движения станка модели 16К20ПФ1 Сила упругости. Закон Гука. 7 класс
Сила упругости. Закон Гука. 7 класс Изучение тепловых явлений
Изучение тепловых явлений Сила Архимеда
Сила Архимеда Вспомогательные системы
Вспомогательные системы Физическая природа изображений
Физическая природа изображений Презентация по физике _Ускорение. 9 класс_
Презентация по физике _Ускорение. 9 класс_ Линзы
Линзы Система охлаждения двигателя
Система охлаждения двигателя 679405
679405