Содержание
- 2. ОСНОВНЫЕ СВОЙСТВА КРИОГЕННЫХ ЖИДКОСТЕЙ Откачкой испаряющихся паров вакуум-насосом можно получать и сравнительно просто поддерживать криогенные температуры
- 3. Жидкий азот, LN2 Жидкость без цвета и запаха. Химически инертен. Молекулярный вес – 28 г/моль. Плотность
- 4. Жидкий кислород, LO2 Жидкость голубоватого цвета, без запаха. Молекулярный вес — 32 г/моль. Плотность — 1140
- 5. Жидкий неон, LNe Химически инертная, тяжелая жидкость с плотностью 1204 кг/м3. Молекулярный вес — 20 г/моль.
- 6. Жидкий водород, LН2 Самый распространенный элемент в космосе, 70% массы Солнца и звезд. Самая легкая криогенная
- 7. Жидкий водород, LН2 Переход водорода из орто- в парамолекулы процесс экзотермический, т.е. сопровождается выделением значительного количества
- 8. Жидкий водород, LН2 Из-за взрывоопасности жидкий водород в качестве охлаждающей среды для получения низких температур используется
- 9. Сжиженный природный газ, СПГ (LNG) СПГ представляет собой бесцветную жидкость без запаха, на 75 - 99
- 10. Жидкий гелий, L4Не, L3Не Существуют два стабильных изотопа гелия: 4Не, который является бозоном (ядерный спин I
- 11. ОСНОВНЫЕ СВОЙСТВА КРИОГЕННЫХ ЖИДКОСТЕЙ Откачкой испаряющихся паров вакуум-насосом можно получать и сравнительно просто поддерживать криогенные температуры
- 13. Скачать презентацию
Слайд 2ОСНОВНЫЕ СВОЙСТВА КРИОГЕННЫХ ЖИДКОСТЕЙ
Откачкой испаряющихся паров вакуум-насосом можно получать и сравнительно просто
ОСНОВНЫЕ СВОЙСТВА КРИОГЕННЫХ ЖИДКОСТЕЙ
Откачкой испаряющихся паров вакуум-насосом можно получать и сравнительно просто
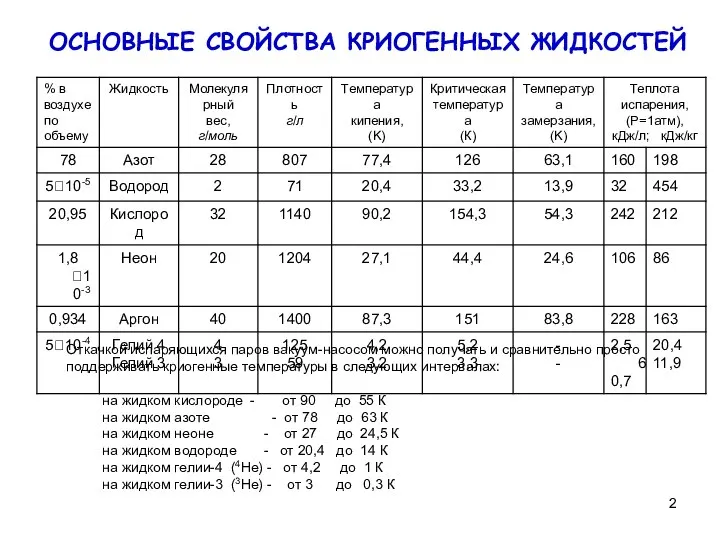
на жидком кислороде - от 90 до 55 К
на жидком азоте - от 78 до 63 К
на жидком неоне - от 27 до 24,5 К
на жидком водороде - от 20,4 до 14 К
на жидком гелии-4 (4Не) - от 4,2 до 1 К
на жидком гелии-3 (3Не) - от 3 до 0,3 К
Слайд 3Жидкий азот, LN2
Жидкость без цвета и запаха. Химически инертен.
Молекулярный вес –
Жидкий азот, LN2
Жидкость без цвета и запаха. Химически инертен.
Молекулярный вес –

Температура кипения — 77,4 К, затвердевания — 63,1 К.
Теплота испарения — 198 кДж/кг (160 кДж/л).
Производится в крупных промышленных масштабах путем ожижения атмосферного воздуха (78%) и дальнейшего его разделения на азот и кислород.
Доступен для получения, прост в обращении, сравнительно небольшая стоимость.
Самое распространенное вещество для получения криогенных температур от
120 до 63 К.
Широко применяется в промышленности, науке, технике, медицине, косметике, сельском хозяйстве.
Используется на предварительной ступени охлаждения при производстве жидких газов: водорода, неона и гелия.
Значение жидкого азота резко повысится в случае создания в будущем массовых криогенных устройств и сверхпроводящих материалов, работающих при азотных температурах.
Слайд 4Жидкий кислород, LO2
Жидкость голубоватого цвета, без запаха.
Молекулярный вес — 32 г/моль.
Жидкий кислород, LO2
Жидкость голубоватого цвета, без запаха.
Молекулярный вес — 32 г/моль.

Теплота испарения — 212 кДж/кг (242 кДж/л), теплота плавления — 13,9 кДж/кг.
Химически активен, в газообразном виде интенсивно поддерживает горение.
Если в воздухе 10% кислорода – горение не идет.
Сам кислород горит в атмосфере фтора F
В отличие от азота, неона, аргона, водорода и других простых газов
жидкий кислород парамагнитен — в жидком состоянии притягивается магнитом.
Из-за высокой химической активности и связанных с ней опасностей жидкий кислород как средство охлаждения и получения криогенных температур применяется редко. Кислород чаще всего используется в газообразном виде (сварка, резка, интенсификация процессов окисления, в химии, медицине и т. д.), однако доставлять его к месту потребления и хранения выгоднее в жидком виде.
Производится в промышленных масштабах в разделительных колонках из ожиженного атмосферного воздуха (21%).
В больших количествах применяется в промышленности (металллургия) и реактивных двигателях как окислительный компонент топлива.
Слайд 5Жидкий неон, LNe
Химически инертная, тяжелая жидкость с плотностью 1204 кг/м3.
Молекулярный вес
Жидкий неон, LNe
Химически инертная, тяжелая жидкость с плотностью 1204 кг/м3.
Молекулярный вес

Температура кипения — 27,1 К, затвердевания — 24,6 К.
Теплота испарения — 86 кДж/кг (106 кДж/л).
Благодаря низкой температуре кипения, значительной теплоте испарения на единицу объема (в 40 раз больше, чем у гелия, и в 3,3 раза больше, чем у водорода) и взрывобезопасности жидкий неон получает все большее распространение как криогенный агент. Единственное препятствие для широкого применения - дороговизна, связанная с небольшими объемами его производства. Увеличение производства неона приведет к снижению его стоимости.
Газообразный неон получают из воздуха как побочный продукт при производстве азота и кислорода, зачастую выбрасывается в атмосферу, так как мешает процессу конденсации воздуха.
В атмосферном воздухе содержится 1,8∙10-3% неона.
В выбрасываемой из конденсаторов смеси содержится до 3 -10% неона и гелия.
В аппаратах-дефлегматорах доводится до 70—90%. Эта смесь собирается и в дальнейшем разделяется на технически чистые неон и гелий адсорбционным или конденсационным способом.
Схемы ожижения неона такие же, как и для водорода, но коэффициент ожижения в них выше, а весь процесс проще.
Слайд 6Жидкий водород, LН2
Самый распространенный элемент в космосе, 70% массы Солнца и
Жидкий водород, LН2
Самый распространенный элемент в космосе, 70% массы Солнца и
Самая легкая криогенная жидкость.
Молекулярный вес — 2 г/моль, плотность — 71 г/л.
Температура кипения 20,4 К, затвердевания 13,9 К.
Теплота испарения — 454 кДж/кг (32 кДж/л).
Водород — горючий газ. В смеси с воздухом образует взрывоопасную смесь в широком интервале концентраций от 4 до 75%.
В молекуле Н2 два ядра (два протона со спином I = 1/2) могут связываться двумя способами, образуя молекулу, которая может иметь суммарный спин I = 1 или I = 0. По этой причине существуют два типа водородных молекул называемых соответственно орто- (↑↑) и парамолекулами (↑↓).
Орто- и парамолекулы водорода различаются по своим физическим свойствам, так что водород можно рассматривать как смесь двух газов. Ортоводород является легко воспламеняющимся веществом, в то время как параводород является более медленно сгораемым видом водорода.
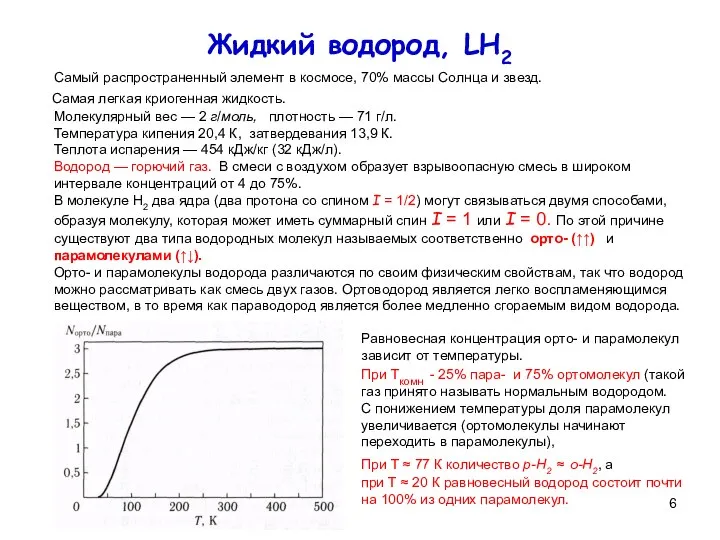
Равновесная концентрация орто- и парамолекул зависит от температуры.
При Ткомн - 25% пара- и 75% ортомолекул (такой газ принято называть нормальным водородом.
С понижением температуры доля парамолекул увеличивается (ортомолекулы начинают переходить в парамолекулы),
При Т ≈ 77 К количество р-Н2 ≈ о-Н2, а
при Т ≈ 20 К равновесный водород состоит почти на 100% из одних парамолекул.
Слайд 7Жидкий водород, LН2
Переход водорода из орто- в парамолекулы процесс экзотермический, т.е. сопровождается
Жидкий водород, LН2
Переход водорода из орто- в парамолекулы процесс экзотермический, т.е. сопровождается

Существуют, по крайней мере, три ситуации, в которых переход ортоводорода в параводород может быть важным.
1. Жидкость с высокой концентрацией ортоводорода испаряется со временем даже без внешнего подвода энергии.
2. Некоторые металлы, такие как Рd и Nb, хорошо растворяют водород в своей кристаллической решетке, где он находится в атомарной форме. Растворимость водорода в других металлах, таких как Сu, Аg, Аu, Рt, пренебрежимо мала. В объеме металлического образца формируются газовые пузырьки молекулярного водорода с типичным диаметром около 10-4 мм. При охлаждении металла водород становится жидким или твердым.
Орто-пара конверсия водорода в пузырьках приводит к паразитному выделению тепла в объеме охлаждаемого металлического образца. Выделение энергии невелико — порядка
1 нВт/г, тем не менее, это может оказаться существенным в экспериментах с массивными металлическим образцами при экстремально низких температурах.
3. При практической реализации постоянной температуры, например тройной точки водорода, термостат с водородом должен выдерживаться более суток при температуре
Т > Тст для ускорения процесса орто-пара конверсии. К тому же, выделение тепла может снизить точность воспроизведения самой тройной точки.
Слайд 8Жидкий водород, LН2
Из-за взрывоопасности жидкий водород в качестве охлаждающей среды для
Жидкий водород, LН2
Из-за взрывоопасности жидкий водород в качестве охлаждающей среды для

В крупных масштабах он используется как топливо в ракетной технике, как среда для физических ядерных исследований (например, в пузырьковых камерах), в бортовых электрохимических генераторах для энергоснабжения космических аппаратов.
Технический водород производится трех марок: А, Б и В. Водород марки А получают из азото-водородной смеси, марки Б - электролизом воды и В - другими способами.
Для ожижения, как правило, используется более чистый водород марки Б с общим содержанием примесей не более 0,2%.
Важное применение в атомной энергетике имеют изотопы водорода - дейтерий D или 3Н(D2), и тритий Т или 3Н (Т2). Получаемая из дейтерия «тяжелая» вода (D2О) служит замедлителем быстрых нейтронов и теплоносителем в ядерных реакторах атомных электростанций.
Мировые потребности в тяжелой воде составляют сотни тонн в год.
Для энергетики будущего дейтерий может иметь важное значение как термоядерное горючее.
Несмотря на малое содержание дейтерия в обычной воде (на 6000 ядер водорода приходится 1 ядро дейтерия), общее количество дейтерия на Земле очень велико, и его как топлива хватит на сотни миллионов лет.
Наиболее экономичный способ получения дейтерия - криогенный, путем ректификации жидкого водорода.
Радиоактивный изотоп водорода — тритий (период полураспада 12,3 лет) применяется в реакциях термоядерного синтеза, как горючее в термоядерных бомбах, как изотопный индикатор в биологических исследованиях. Тритий получают в ядерных реакторах при облучении нейтронами лития.
Слайд 9Сжиженный природный газ, СПГ (LNG)
СПГ представляет собой бесцветную жидкость без запаха, на
Сжиженный природный газ, СПГ (LNG)
СПГ представляет собой бесцветную жидкость без запаха, на

Молекулярный вес — 16 г/моль, плотность ≈ 500 г/л, в два раза меньше плотности воды.
Температура кипения 112 К, Ткр = 191 К, Ттр = 91 К.
В жидком состоянии СПГ не горюч, не токсичен, не агрессивен.
При сгорании паров образуется диоксид углерода и водяной пар.
СПГ получают из природного газа путём сжатия с последующим охлаждением. При сжижении природный газ уменьшается в объёме примерно в 600 раз. Процесс ожижения идет ступенями, на каждой из которых газ сжимается в 5—12 раз, затем охлаждается и передается на следующую ступень. Собственно ожижение происходит при охлаждении после последней стадии сжатия.
Процесс ожижения требует значительного расхода энергии — до 25 % от её количества, содержащегося в сжиженном газе. В процессе сжижения используются различные виды установок — дроссельные, турбодетандерные, турбинно-вихревые и пр.
Чистый СПГ не горит, сам по себе не воспламеняем и не взрывается (в жидком СПГ можно тушить сигареты). На открытом пространстве при нормальной температуре СПГ возвращается в газообразное состояние и быстро растворяется в воздухе. При испарении природный газ может воспламениться, если произойдет контакт с источником пламени. Для воспламенения необходимо иметь концентрацию испарений в воздухе от 5 % до 15 %. Если концентрация до 5 %, то испарений недостаточно для начала возгорания, а если более 15 %, то в окружающей среде становится слишком мало кислорода.
Доставка СПГ — это процесс, включающий в себя несколько стадий. Сначала происходит трансформация природного газа в СПГ на заводах по сжижению газа, которые обычно располагаются рядом с районами добычи природного газа. СПГ хранится в специальных крио цистернах, устроенных по принципу сосуда Дюара. Транспортируется СПГ на специализированных морских судах — газовозах, оборудованных криоцистернами, а также на спецавтомобилях. Для использования СПГ подвергается регазификации — испарению без присутствия воздуха. Регазифицированный СПГ транспортируется конечным потребителям по трубопроводам.
Слайд 10Жидкий гелий, L4Не, L3Не
Существуют два стабильных изотопа гелия: 4Не, который является бозоном
Жидкий гелий, L4Не, L3Не
Существуют два стабильных изотопа гелия: 4Не, который является бозоном

Жидкий гелий - легкая, бесцветная, прозрачная жидкость без запаха. Химически инертен.
Он имеет самую низкую температуру кипения из всех элементов таблицы Менделеева.
Температура кипения при атмосферном давлении — 4Не - 4,2 К; 3Не - 3,2 К
.
Молекулярный вес 4Не — 4 г/моль, плотность — 125 г/л,
теплота испарения (Р = 1атм) — 20,4 кДж/кг (2,56 кДж/л).
Молекулярный вес 3Не — 3 г/моль, плотность — 59 г/л,
теплота испарения (Р = 1атм) — 11,9 кДж/кг (0,7 кДж/л).
Гелий впервые был открыт в 1868 г. в спектре Солнца (отсюда и его название). Для криогеники гелий является наиболее подходящим хладоагентом.
Газообразный гелий получают из природных газов, где он содержится обычно от 0,1 до 0,4% (в атмосферном воздухе гелия содержится 5,2·10-4%).
Относительное содержание 3Не в 4Не в природном газе, составляет ~ 10-5%.
Под давлением собственных паров гелий остается жидким вплоть до абсолютного пуля.
При Тλ = 2,177 К 4Не переходит в сверхтекучее состояние, открытое П. Л. Капицей в 1938 г.
Для жидкого 3Не Тλ = 0,0025 К .
Фазовые р-Т диаграммы 4Не и 3Не
Слайд 11ОСНОВНЫЕ СВОЙСТВА КРИОГЕННЫХ ЖИДКОСТЕЙ
Откачкой испаряющихся паров вакуум-насосом можно получать и сравнительно просто
ОСНОВНЫЕ СВОЙСТВА КРИОГЕННЫХ ЖИДКОСТЕЙ
Откачкой испаряющихся паров вакуум-насосом можно получать и сравнительно просто
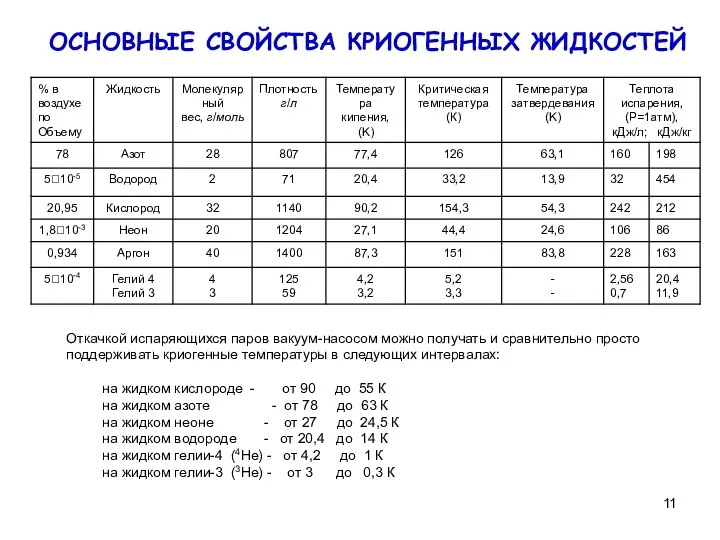
на жидком кислороде - от 90 до 55 К
на жидком азоте - от 78 до 63 К
на жидком неоне - от 27 до 24,5 К
на жидком водороде - от 20,4 до 14 К
на жидком гелии-4 (4Не) - от 4,2 до 1 К
на жидком гелии-3 (3Не) - от 3 до 0,3 К
 Явления электромагнитной индукции
Явления электромагнитной индукции Действие нескольких сил
Действие нескольких сил Силы в механике. Силы тяготения. Силы упругости. Силы трения
Силы в механике. Силы тяготения. Силы упругости. Силы трения Тест. 8 класс
Тест. 8 класс Механика жидкости и газа
Механика жидкости и газа Виды движения. Основные особенности
Виды движения. Основные особенности Математический аппарат термодинамики. Термодинамические потенциалы. Характеристические функции
Математический аппарат термодинамики. Термодинамические потенциалы. Характеристические функции Методическая разработка по применению первого закона термодинамики к решению графических задач
Методическая разработка по применению первого закона термодинамики к решению графических задач Общая Физика. Оптика
Общая Физика. Оптика Згадуємо сили в природі
Згадуємо сили в природі Курс лекций по молекулярной физике и термодинамике
Курс лекций по молекулярной физике и термодинамике Ультразвуковые волны
Ультразвуковые волны Игра для семиклассников Физика и мы
Игра для семиклассников Физика и мы Информационная подсистема пневмосистем. Тема 1.5
Информационная подсистема пневмосистем. Тема 1.5 Внутренняя энергия и работа в термодинамике
Внутренняя энергия и работа в термодинамике Теорема Остроградского – Гаусса
Теорема Остроградского – Гаусса гидрав
гидрав Демонтаж приборов электрооборудования авто
Демонтаж приборов электрооборудования авто Участок механической обработки корпуса контактора
Участок механической обработки корпуса контактора Наночастицы
Наночастицы Семинар по физике для 83 и 84 групп
Семинар по физике для 83 и 84 групп Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Силы гравитации
Силы гравитации Техническое обслуживание
Техническое обслуживание Ускорители заряженных частиц
Ускорители заряженных частиц Механические волны. Решение задач
Механические волны. Решение задач Равноуск. движение
Равноуск. движение Основные понятия. Цепи постоянного тока
Основные понятия. Цепи постоянного тока