Слайд 2Закон сохранения энергии
Энергия в природе не возникает из ничего и не исчезает:

количество энергии неизменно, она только переходит из одной формы в другую.
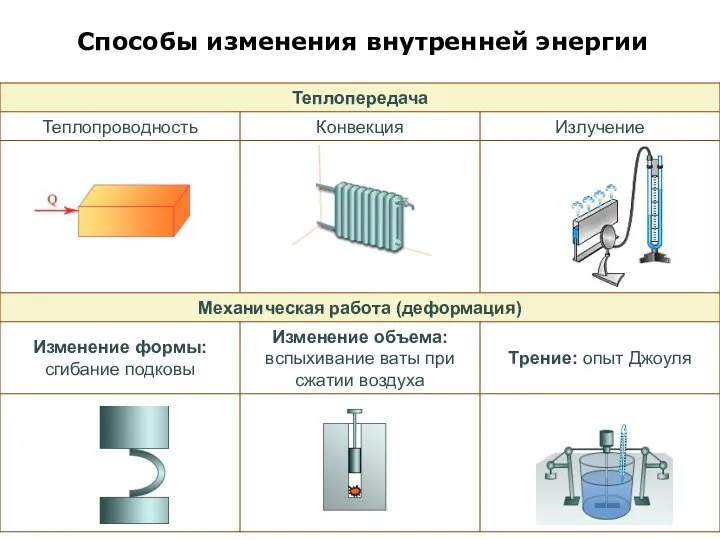
Слайд 3Способы изменения внутренней энергии
Слайд 4I закон термодинамики
внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии
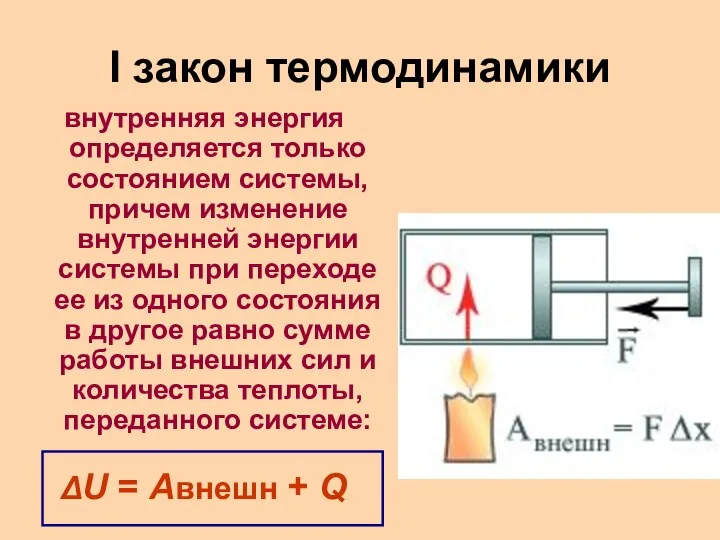
системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = Aвнешн + Q
Слайд 5Если при нагревании газ расширяется и при этом совершает работу A, то

первый закон термодинамики можно сформулировать по-другому:
Q = ΔU + AI
Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом.
Так как работа газа и работа внешних сил вследствие 3-го закона Ньютона равны по модулю и имеют противоположный знак:
Aвнешн = –AI
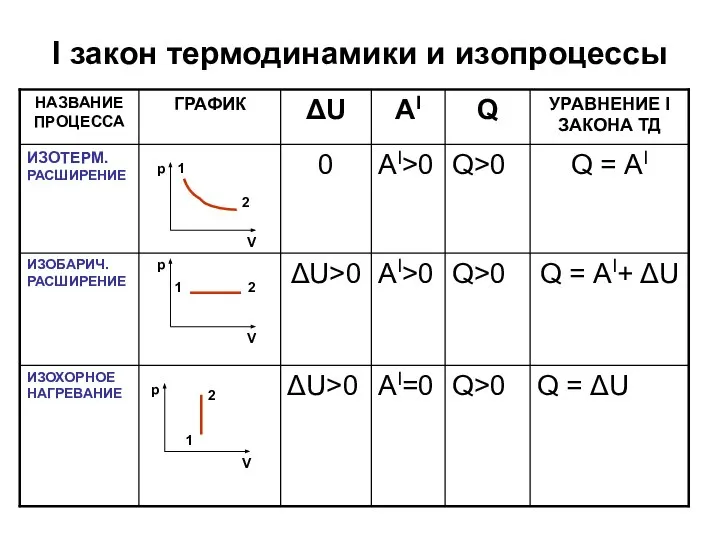
Слайд 6I закон термодинамики и изопроцессы
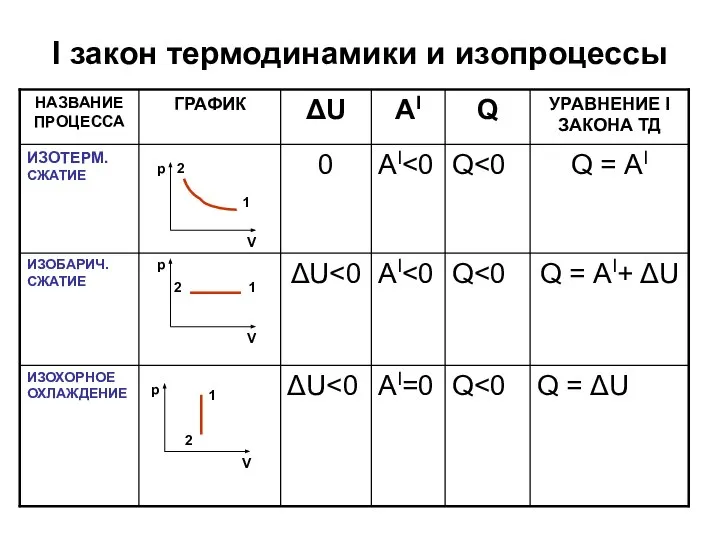
Слайд 7I закон термодинамики и изопроцессы
Слайд 8Адиабатный процесс
– это модель термодинамического процесса, происходящего в системе без теплообмена с
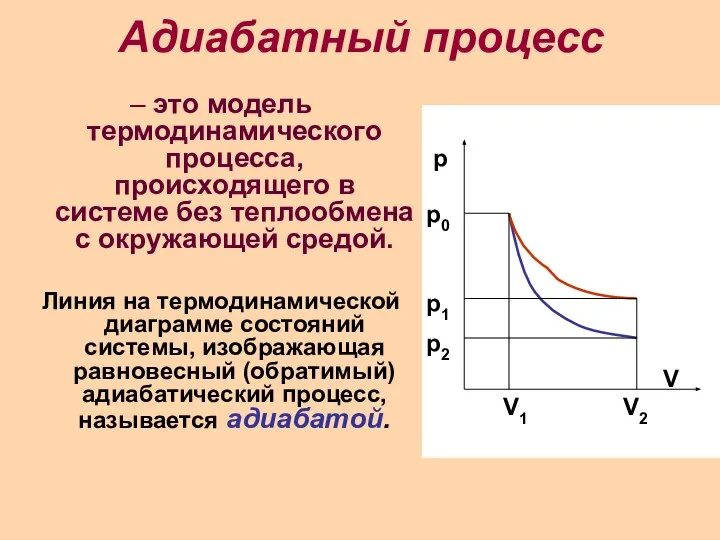
окружающей средой.
Линия на термодинамической диаграмме состояний системы, изображающая равновесный (обратимый) адиабатический процесс, называется адиабатой.







 Хронология проведения испытаний на четвертом энергоблоке ЧАЭС
Хронология проведения испытаний на четвертом энергоблоке ЧАЭС Поршневые компрессоры. Лекция №6
Поршневые компрессоры. Лекция №6 Презентация на тему Электромагнитное поле
Презентация на тему Электромагнитное поле  Определение показателя преломления стекла
Определение показателя преломления стекла Основы молекулярнокинетической теории газов. Тест
Основы молекулярнокинетической теории газов. Тест Методические указания к выполнению отчета по лабораторным работам
Методические указания к выполнению отчета по лабораторным работам Отчёт по учебной практике. Выполнение работ по профессии машинист холодильных установок
Отчёт по учебной практике. Выполнение работ по профессии машинист холодильных установок Давление. Задачи
Давление. Задачи Основы термодинамики. Тема № 4
Основы термодинамики. Тема № 4 Презентация на тему Инфракрасное и ультрафиолетовое излучения
Презентация на тему Инфракрасное и ультрафиолетовое излучения  Свойство волн
Свойство волн 6
6 Изобретение радио. Принципы радиосвязи
Изобретение радио. Принципы радиосвязи Физические задачи с литературным содержанием
Физические задачи с литературным содержанием Цепи периодического несинусоидального тока
Цепи периодического несинусоидального тока Основные понятия и задачи кинематики (продолжение)
Основные понятия и задачи кинематики (продолжение) Плотность. Способы измерения плотности
Плотность. Способы измерения плотности Исследовательская работа по физике
Исследовательская работа по физике Фазовые переходы. Термодинамика ТМП (Термоупругие мартенситные превращения)
Фазовые переходы. Термодинамика ТМП (Термоупругие мартенситные превращения) Зависимость спектральной плотности интенсивности излучения от частоты
Зависимость спектральной плотности интенсивности излучения от частоты Лекция № 8. Антенны классификация и основные виды антенн
Лекция № 8. Антенны классификация и основные виды антенн Осциллограф. Классификация
Осциллограф. Классификация Презентация на тему Выяснение условия равновесия рычага
Презентация на тему Выяснение условия равновесия рычага  Җылылык күренешләре
Җылылык күренешләре Определение проницаемости
Определение проницаемости Радиоактивность. Виды радиоактивного облучения
Радиоактивность. Виды радиоактивного облучения Аккумуляторная батарея
Аккумуляторная батарея «Своя игра» по Физике Автор Skyfury Sparkle
«Своя игра» по Физике Автор Skyfury Sparkle