Изменение внутренней энергии газа в процессе теплообмена и совершения работы. Первое начало термодинамики. Лекция 5
Содержание
- 2. Термодинамика Термодинамика – раздел физики, изучающий связи и взаимопревращения различных видов энергии. Физические системы, состоящие из
- 3. Внутренняя энергия Это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул. Внутренняя энергия системы зависит
- 4. Теплообмен Процесс передачи внутренней энергии без совершения механической работы называется теплообменом. Мерой энергии, получаемой или отдаваемой
- 5. Теплоемкость Теплоемкостью тела называют отношение количества теплоты, необходимого для повышения его температуры от значения Т1 до
- 6. Удельная теплоемкость Удельная теплоемкость: СИ: [с] = Дж/кг·К Зная удельную теплоемкость, можно определить количество теплоты, необходимое
- 7. Первое начало термодинамики Это закон сохранения и превращения энергии: при разнообразных процессах, протекающих в природе, энергия
- 8. Первое начало термодинамики (другие формулировки) Изменение внутренней энергии тела равно разности сообщенного телу количества теплоты и
- 9. Применение первого начала термодинамики к изопроцессам Изобарный процесс p = const, V, T - изменяются Работа,
- 10. Работа при изобарном расширении газа Работа - площадь, ограниченная графиком процесса, осью абсцисс и ординатами начала
- 11. Применение первого начала термодинамики к изопроцессам Изохорный процесс V = const, р, T – изменяются Т.
- 12. Работа при изохорном процессе А = 0 Удельная теплоемкость газа при V = const: СV =
- 13. Применение первого начала термодинамики к изопроцессам Изотермический процесс Т = const; V, p - изменяются Так
- 14. Работа при изотермическом расширении газа Работа - площадь, ограниченная графиком процесса, осью абсцисс и ординатами начала
- 15. Адиабатный процесс Адиабатным (греч. «адиабатос» - непереходный) называется процесс, происходящий без теплообмена с окружающими телами. Работа
- 17. Скачать презентацию




![Удельная теплоемкость Удельная теплоемкость: СИ: [с] = Дж/кг·К Зная удельную теплоемкость, можно](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/976904/slide-5.jpg)









 Volkswagen Touareg Hybrid. Ремонтно-технологическая часть. Характеристика
Volkswagen Touareg Hybrid. Ремонтно-технологическая часть. Характеристика 理论力学D2
理论力学D2 Электрическое сопротивление
Электрическое сопротивление Интерференция и дифракция механических волн
Интерференция и дифракция механических волн Механическое движение
Механическое движение Вiд фiзики до радiотехнiки. Зв`язок мiж електрикою та магнетизмом. Дослiди Ерстеда
Вiд фiзики до радiотехнiки. Зв`язок мiж електрикою та магнетизмом. Дослiди Ерстеда 10.09.2022
10.09.2022 Сила упругости
Сила упругости Механические передачи
Механические передачи Зубчатые передачи
Зубчатые передачи Энергия. Потенциальная и кинетическая энергия
Энергия. Потенциальная и кинетическая энергия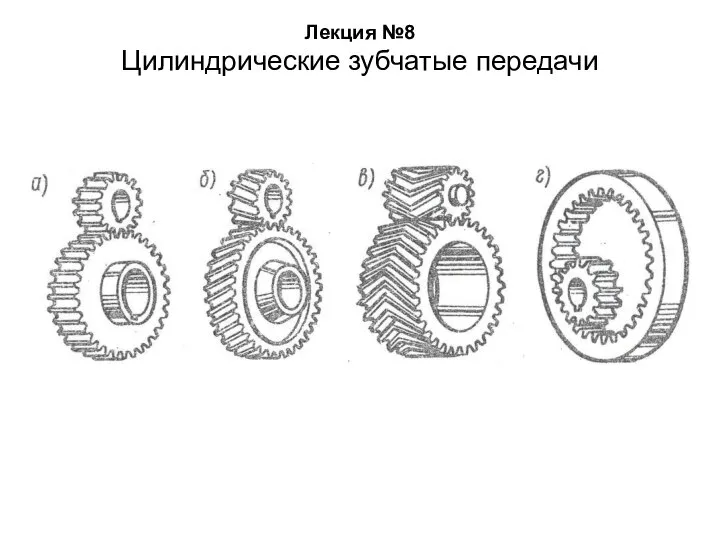 Цилиндрические зубчатые передачи. Лекции 8
Цилиндрические зубчатые передачи. Лекции 8 Электромагнитные колебания. Превращение энергии в колебательном контуре
Электромагнитные колебания. Превращение энергии в колебательном контуре Спектральный анализ
Спектральный анализ Проект создания точной копии летающего аэроплана Блерио XI
Проект создания точной копии летающего аэроплана Блерио XI Плавание тел
Плавание тел Диполь. Поле системы зарядов. Теорема Ирншоу
Диполь. Поле системы зарядов. Теорема Ирншоу Нитяной монорельс
Нитяной монорельс Связь между спектрами периодического и апериодического сигналов
Связь между спектрами периодического и апериодического сигналов Неисправности и ремонт системы питания дизельного двигателя
Неисправности и ремонт системы питания дизельного двигателя Реактивная сила
Реактивная сила Презентация по физике "Числовой луч" -
Презентация по физике "Числовой луч" -  Теорема Остроградского-Гаусса для электростатических полей
Теорема Остроградского-Гаусса для электростатических полей Презентация на тему Электромагнитное поле
Презентация на тему Электромагнитное поле  Применение атомной энергии в разных отраслях
Применение атомной энергии в разных отраслях Кинематика цепной передачи
Кинематика цепной передачи Классификации растворов. Способы выражения концентрации
Классификации растворов. Способы выражения концентрации Механічна робота, потужність
Механічна робота, потужність