Слайд 2Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но

и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученным телом, называют изменение внутренней энергии тела в результате теплообмена
Слайд 3Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы (газа). Величина

A > 0, если система (газ) совершает положительную работу над окружающими телами
Слайд 4Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической

системы. Он формулируется следующим образом:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами
(упрощенно: Количество теплоты, полученное газом, идет на изменение его внутренней энергии и совершение газом работы)
Слайд 5Первый закон термодинамики для изопроцессов
В изохорном процессе (V = const) газ работы не совершает,

A = 0. Следовательно,
Q = ΔU = U 2 – U 1.
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением
A = p (V2 – V1) = p ΔV.
Первый закон термодинамики для изобарного процесса дает:
Q = U 2 – U 1 + p (V2 – V1) = ΔU + p ΔV.
Слайд 6В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя

энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением
Q = A.
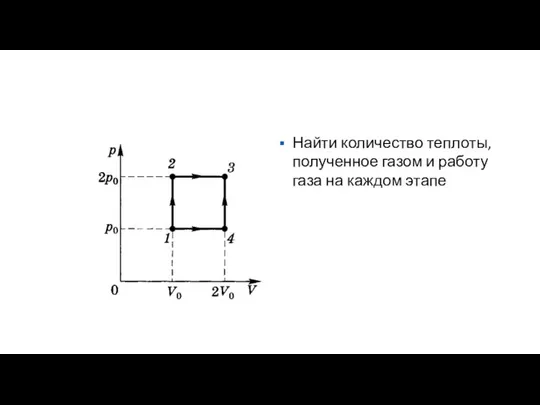
Слайд 7Найти количество теплоты, полученное газом и работу газа на каждом этапе






 Масштаб аэрофотоснимков
Масштаб аэрофотоснимков Устройство и принцип работы дизельного двигателя
Устройство и принцип работы дизельного двигателя Плотность. Плотность мрамора
Плотность. Плотность мрамора Клепаные и сварные соединения
Клепаные и сварные соединения Квантовая физика. Фотоэффект
Квантовая физика. Фотоэффект Русские изобретения, которыми пользуется весь мир
Русские изобретения, которыми пользуется весь мир Деформация Сила упругости, закон Гука (Тема 1, Тема 2)
Деформация Сила упругости, закон Гука (Тема 1, Тема 2) Ветровой электрогенератор challenergy
Ветровой электрогенератор challenergy I-D диаграмма влажного воздуха
I-D диаграмма влажного воздуха Рычаг первого рода
Рычаг первого рода Сопротивление материалов
Сопротивление материалов Тепловое расширение
Тепловое расширение А.В.Перышкин Физика, 8 класс. Решение задач
А.В.Перышкин Физика, 8 класс. Решение задач Теория и практика формообразования заготовок
Теория и практика формообразования заготовок Проверь себя!!!
Проверь себя!!! Первый пароход 4/2 класс
Первый пароход 4/2 класс Законы сохранения в механике. Лекция № 5
Законы сохранения в механике. Лекция № 5 Механика деформируемого твердого тела
Механика деформируемого твердого тела Давление твердых тел
Давление твердых тел Светофор. Внеклассное мероприятие по физике
Светофор. Внеклассное мероприятие по физике Понятие индукции
Понятие индукции Ядерный реактор
Ядерный реактор Электростатика
Электростатика Презентация на тему Давление света
Презентация на тему Давление света  Задачи на соединение проводников
Задачи на соединение проводников Презентация по физике "Скорость" -
Презентация по физике "Скорость" -  Относительность движения
Относительность движения Показатели тепловой экономичности
Показатели тепловой экономичности