Слайд 2 Молекулярная физика
Используя соотношения и , получим:
и . Полученную формулу

называют формулой Больцмана. Для давления будем иметь
, где и при Eпот=0.
В поле силы тяжести вблизи поверхности Земли
,
где m0 – масса молекулы газа, M – его молярная
масса. Последнюю формулу называют барометри-
ческой. Зависимость давления от высоты z над
поверхностью земли при разных температурах и молярных массах представлена на рисунке.
Слайд 3 Молекулярная физика
Распределение молекул по скоростям. Распределение Максвелла.
В связи с тем, что

в макроскопических объемах газа содержится ас-трономическое число молекул, бессмысленно говорить об опреде-лении точного значения скорости каждой из них. С одной стороны, это сложно осуществить технически, а с другой стороны, молекулы, постоянно сталкиваясь, меняют величину и направление скорости. При таком большом количестве частиц можно говорить лишь о вероятности того, что определенная часть молекул имеет скорости лежащие в некотором интервале от до . Решением подобных задач занимается статистическая физика.
Введем понятие вероятности. Вероятностью называется относитель-ная частота выпадения того или иного события. Игральная кость при падении оказывается одной гранью вверх. Вероятность выпа-дения, например, числа 3 равна числу выпадения тройки, отнесен-ному к общему числу бросаний
Слайд 4 Молекулярная физика
Сумма выпадения всех возможных 6 чисел равна .
Пусть из общего

числа молекул N скорости, лежащие в интервале от v до v + dv имеют dN молекул. Вероятность dP того, что молекулы имеют скорости, лежащие в этих пределах пропорцио-нальна , т.е. равна , где вероятность выражена через величину интервала скоростей , а функция называется функцией распределения молекул по скоростям.
Будем искать , используя формулу Больцмана. Для этого рассмотрим идеальный газ в состоянии теплового равновесия в однородном гравитационном поле и будем следить только за z компонентой скоростей его молекул. Пусть число молекул в единице объема со скоростями, лежащими в интервале от
до равно . Рассмотрим бесконечно тонкий слой газа площадью S толщиной dz на высоте z. В его объеме содержится молекул, где n(z) -
Слайд 5 Молекулярная физика
плотность газа на высоте z. Через некоторое время молекулы этого

слоя при тепловом движении сместится на другую высоту z’ и изменит свою толщину от до , а скорости под действием сил поля изменятся и перейдут в интервал от до . Число молекул в этом объеме можно представить в виде .
Поскольку число молекул осталось неизменным, то
.
В поле силы тяжести горизонтальные составляющие скорости не меняются, и закон сохранения энергии примет вид:
Дифференцируя при постоянных z и z’, получим:
, .
Откуда и .
Слайд 6 Молекулярная физика
Используя формулу Больцмана, получим:
Из закона сохранения энергии следует:
.
Тогда и

.
В результате получено равновесное распределение молекул по значениям только одной компоненты скорости . Доля молекул, обладающих тремя определенными значениями скорости получается перемножением долей
молекул, обладающих каждой из компонент в отдельности.
Слайд 7 Молекулярная физика
Таким образом, число молекул dN со скоростями, лежащими в интервалах

от до , от до и от до равно
.
если перейти к сферическим координатам и проинтегрировать по
, то .
Константа определяется из соотношения ,
Означающего очевидное утверждение, что молекула имеет какую-то скорость в интервале от 0 до бесконечности. Это событие является достоверным, поэтому его вероятность равна 1.
Функция распределения равна
Слайд 8 Молекулярная физика
Число молекул dN, движущихся в интервале скоростей от v до
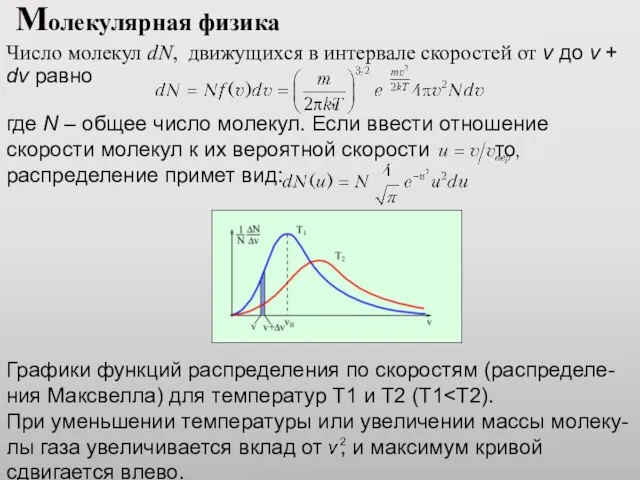
v + dv равно
,
где N – общее число молекул. Если ввести отношение скорости молекул к их вероятной скорости то распределение примет вид:
Графики функций распределения по скоростям (распределе-ния Максвелла) для температур Т1 и Т2 (Т1<Т2).
При уменьшении температуры или увеличении массы молеку-лы газа увеличивается вклад от , и максимум кривой сдвигается влево.
Слайд 9 Молекулярная физика
1.Наиболее вероятная скорость соответствует максимуму кривой
распределения Максвелла.
,
,

где - масса молекулы, M – молярная масса.
2.Средняя скорость молекул .
3.Среднеквадратичная скорость молекул
Пример. Средняя скорость движения молекул
кислорода.
м/с
Распределение молекул по скоростям
Экспериментальное подтверждение распределе-
ния Максвелла получено в опытах Штерна и
Ламмерта.
Слайд 10 Молекулярная физика
Примеры решения задач
Задача 62. Найдите суммарную кинетическую энергию вращательного

движения молекул углекислого газа (с жесткими связями) массой 88 г при температуре 300 К, молярная масса углекислого газа .
Решение. Молекула углекислого газа CO2 является треха-томной с 6 степенями свободы, три из которых приходятся на вращательное движение. Суммарная кинетическая энергия вращательного движения молекул 88 г (двух молей) CO2 равна
7479 Дж.
Задача 63. При какой температуре Т средняя квадратичная скорость молекул азота больше их наиболее вероятной скорости на
м/с?
Решение. Вычитая из выражения для средней квадратичной скорости наиболее вероятную скорость, получим:
Слайд 11 Молекулярная физика
откуда
Задача 64. Найти скорость при которой пересекаются кривые распределения

Максвелла молекул по скоростям при температурах Т и 2Т, если наиболее вероятная скорость при температуре 2Т равна.
Решение. В точке пересечения (рис.5) функций распределения (плотностей вероятности) они равны:
,
откуда и
Задача 65. Какая часть молекул кислорода при t = 0°С обладает скоростями от 100 до 110 м/с?
Решение. Запишем распределение Максвелла молекул по
скоростям в виде , где -
относительная скорость, , . Тогда
Слайд 12 Молекулярная физика
Задача 66. Найдите разность давлений в салоне самолета, летящего на

высоте = 8300 м и за бортом. В салоне поддерживается давление воздуха, соответствующее высоте
=2700 м. Ускорение свободного падения и температура 0°С наружного воздуха от высоты не зависят. Давление на поверхности Земли = 100 кПа, молярная масса воздуха M = 29кг/м3.
Решение. Зависимость давления от высоты над поверхностью Земли дается распределением Больцмана . Тогда давление в салоне равно кПа, а за бортом
кПа. Разность давлений составляет 36 кПа.
Задача 67. Вблизи поверхности Земли отношение объемных концентраций кислорода и азота в воздухе Считая ускорение свободного падения не зависящим от высоты, а темпера-туру атмосферы постоянной и равной 0°С, определить это отношение на высоте h = 10 км.
,











 Построения в линзе
Построения в линзе Презентация на тему Конвекция
Презентация на тему Конвекция  Результаты измерений. Лабораторная работа №3 по биофизике
Результаты измерений. Лабораторная работа №3 по биофизике Розкладання білого світла на кольори. Утворення кольорів
Розкладання білого світла на кольори. Утворення кольорів Закон сохранения массы веществ. Химические уравнения(8 класс)
Закон сохранения массы веществ. Химические уравнения(8 класс) Магнитный поток. 11 класс
Магнитный поток. 11 класс Призма. Аберрации. Фотометрия. Интерференция
Призма. Аберрации. Фотометрия. Интерференция Физика - фундаментальная наука
Физика - фундаментальная наука Презентация на тему Гидростатическое давление
Презентация на тему Гидростатическое давление  Физические и химические явления
Физические и химические явления Закон изменения и сохранения импульса системы тел
Закон изменения и сохранения импульса системы тел Линзы. Построение изображений в линзах
Линзы. Построение изображений в линзах Определение технического состояния системы питания дизельных двигателей
Определение технического состояния системы питания дизельных двигателей Магнитное поле Земли
Магнитное поле Земли Материалы, используемые в конструкциях космических аппаратов
Материалы, используемые в конструкциях космических аппаратов Элементарная теория атома водорода по бору
Элементарная теория атома водорода по бору Работа газа и пара при расширении. Двигатели внутреннего сгорания
Работа газа и пара при расширении. Двигатели внутреннего сгорания Машины и оборудование, инженерные системы и энергосберегающие технологии в городском хозяйстве и сфере услуг
Машины и оборудование, инженерные системы и энергосберегающие технологии в городском хозяйстве и сфере услуг Изэнтропические формулы
Изэнтропические формулы Компрессия двигателя
Компрессия двигателя Тепловые двигатели
Тепловые двигатели Презентация МСС
Презентация МСС Организация технического обслуживания и ремонта и ремонта в автотранспортной организации 1-37 01 06 ТЭА
Организация технического обслуживания и ремонта и ремонта в автотранспортной организации 1-37 01 06 ТЭА Интерференция света
Интерференция света Электроснабжение и основы электротехники. Цепи постоянного тока. Лекции 1 и 2
Электроснабжение и основы электротехники. Цепи постоянного тока. Лекции 1 и 2 Принципы проектирования машин
Принципы проектирования машин Колебательный контур в цепи переменного тока
Колебательный контур в цепи переменного тока Лестница знаний
Лестница знаний