Содержание
- 4. Направление и пределы самопроизвольного протекания физико-химических процессов Самопроизвольные и несамопроизвольные процессы Энтропия Второй закон термодинамики Энергия
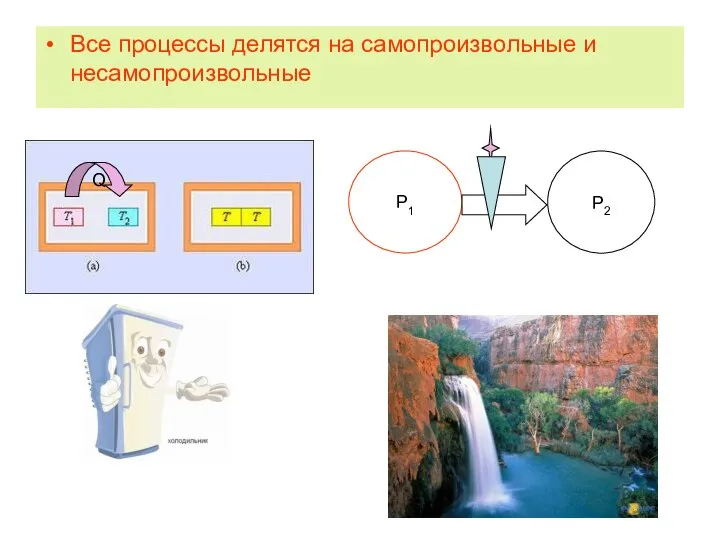
- 5. Все процессы делятся на самопроизвольные и несамопроизвольные
- 6. Направление и пределы самопроизвольного протекания физико-химических процессов
- 7. Особенности самопроизвольных процессов Протекают без затраты энергии извне Неравновесные Необратимые Если в прямом направлении процесс протекает
- 8. Критерии направления и пределов протекания самопроизвольного процесса
- 9. Метод потенциалов Самопроизвольное протекание процессов возможно только в направлении выравнивания фактора интенсивности. Наличие градиента фактора интенсивности
- 10. Второй закон термодинамики
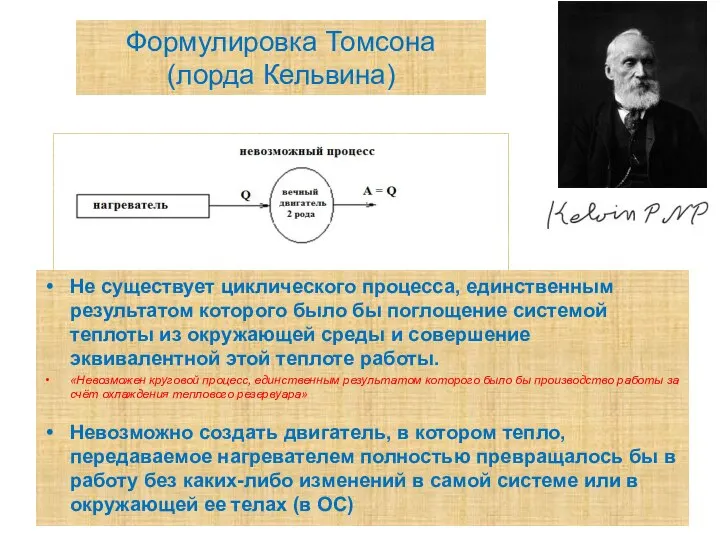
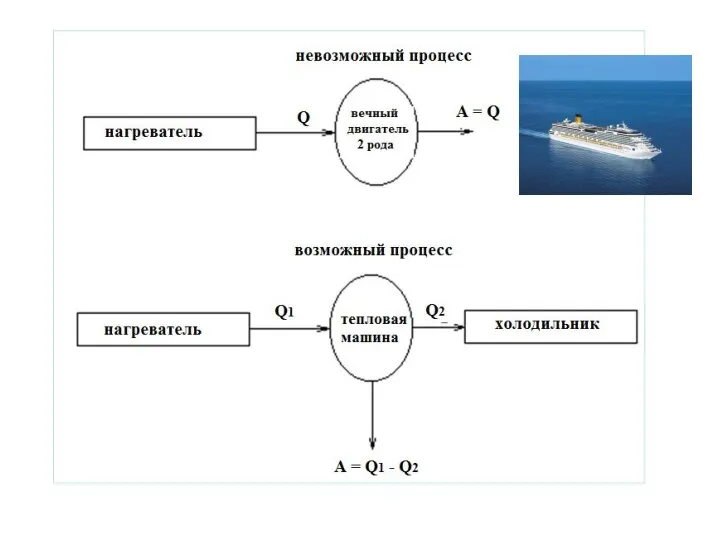
- 11. Формулировка Томсона (лорда Кельвина) Не существует циклического процесса, единственным результатом которого было бы поглощение системой теплоты
- 12. Убедимся в этом!!! Такое утверждение равносильно утверждению о невозможности процесса превращения теплоты в работу, если в
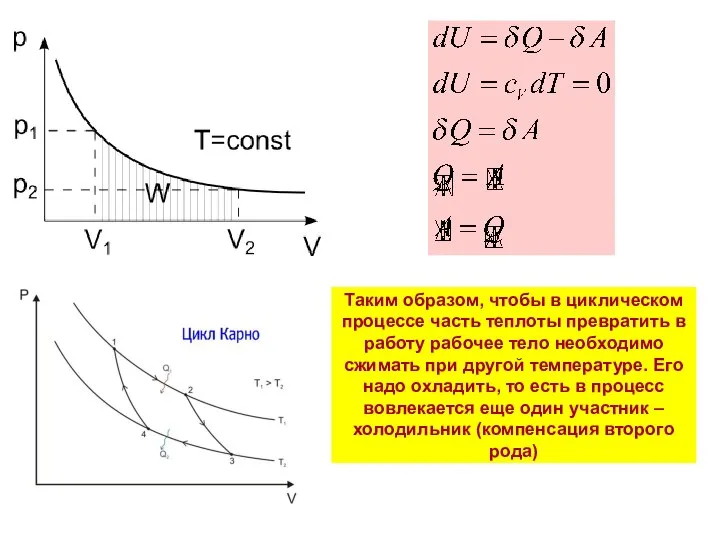
- 13. Таким образом, чтобы в циклическом процессе часть теплоты превратить в работу рабочее тело необходимо сжимать при
- 14. Второй закон термодинамики утверждает, что при преобразовании теплоты в работу (неупорядоченных форм движения материи в упорядоченные)
- 16. Поскольку, согласно закону сохранения энергии, общая энергия системы (мяч – поверхность) не меняется, это означает, что
- 17. Еще примеры Газ не может самопроизвольно сжаться, так как для этого необходимо, чтобы все частицы получили
- 18. Некоторые промежуточные выводы Когда протекают самопроизвольные процессы, несмотря на то, что полная энергия изолированной системы остается
- 19. Логическая природа второго закона термодинамики Выбрать процесс, для которого многовековой опыт позволяет четко указать, какое направление
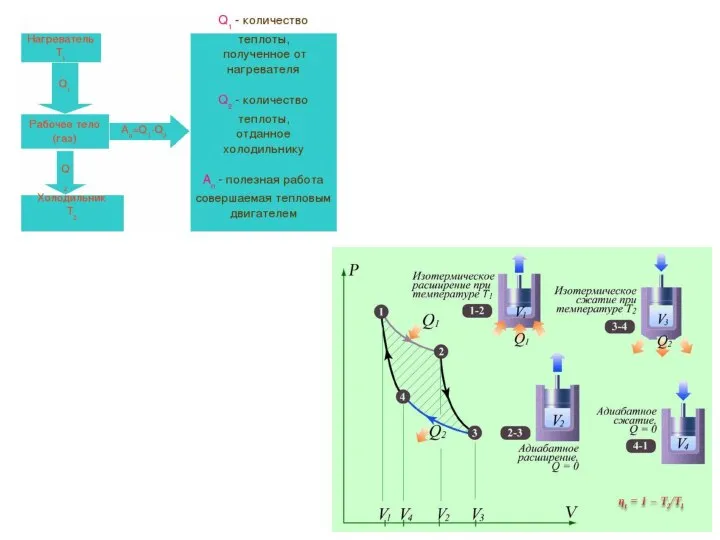
- 20. Рассмотрим переход тепла от более нагретого тела (нагревателя) к менее нагретому (холодильнику) посредством рабочего тела тепловой
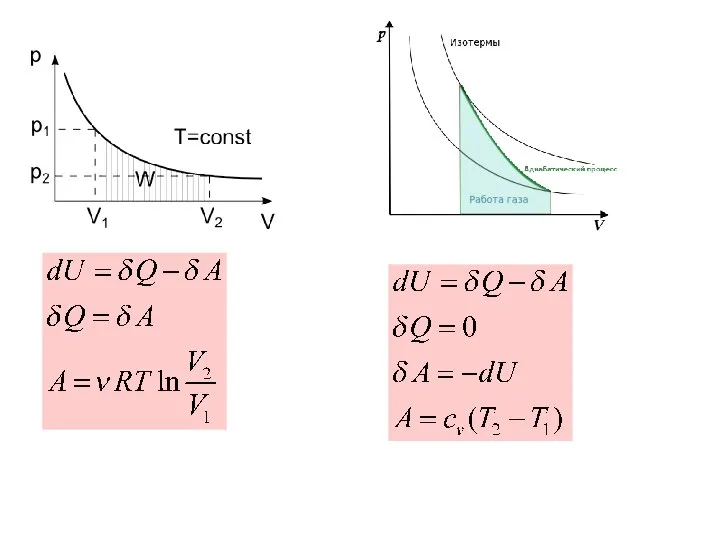
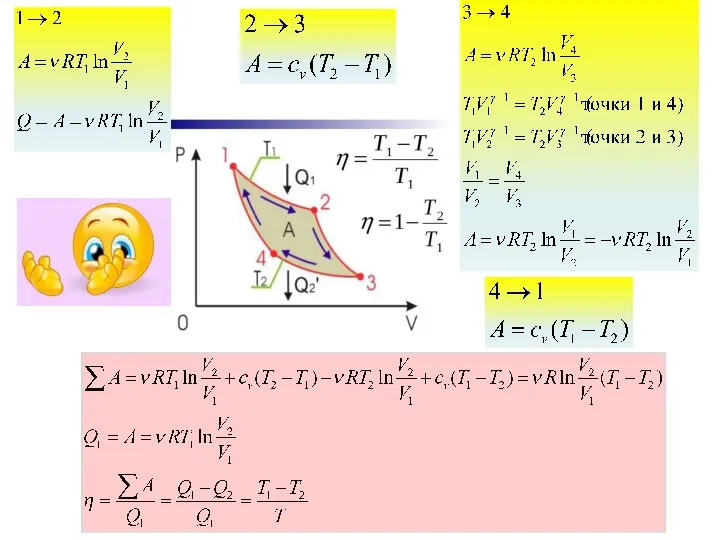
- 21. Теорема Карно
- 25. «Движущая сила тепла не зависит от агентов, взятых для её развития; её количество исключительно определяется температурами
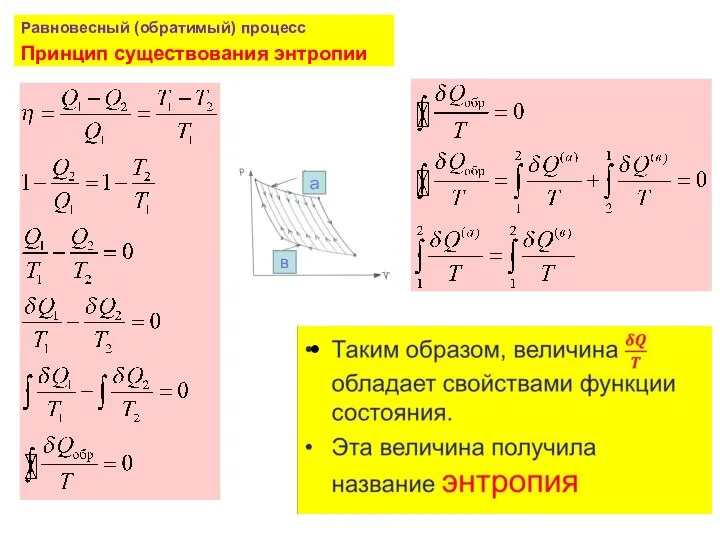
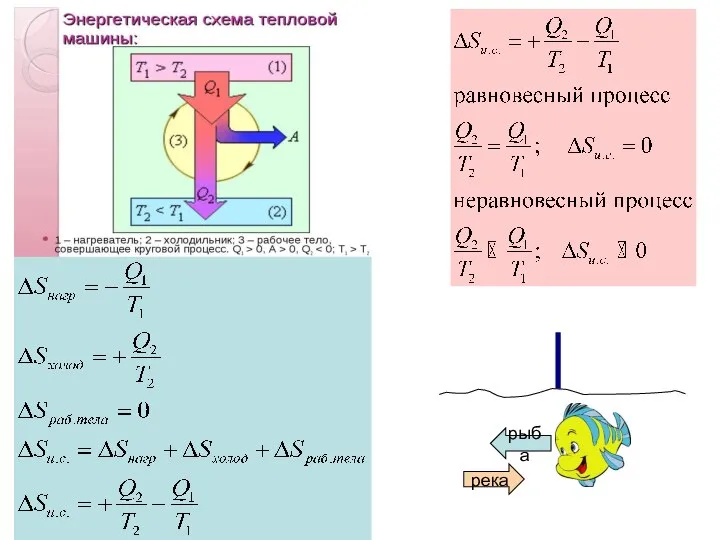
- 26. Равновесный (обратимый) процесс Принцип существования энтропии
- 27. Неравновесный (необратимый) процесс принцип возрастания энтропии Таким образом: если процесс является неравновесным и необратимым (самопроизвольным), то
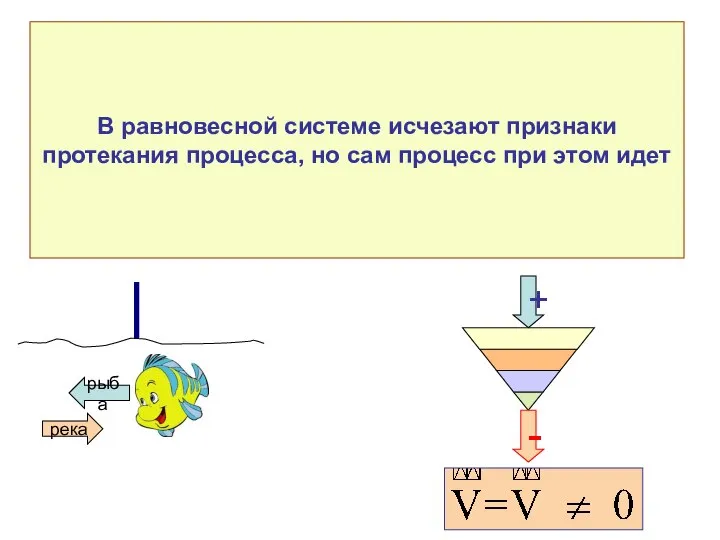
- 29. В равновесной системе исчезают признаки протекания процесса, но сам процесс при этом идет
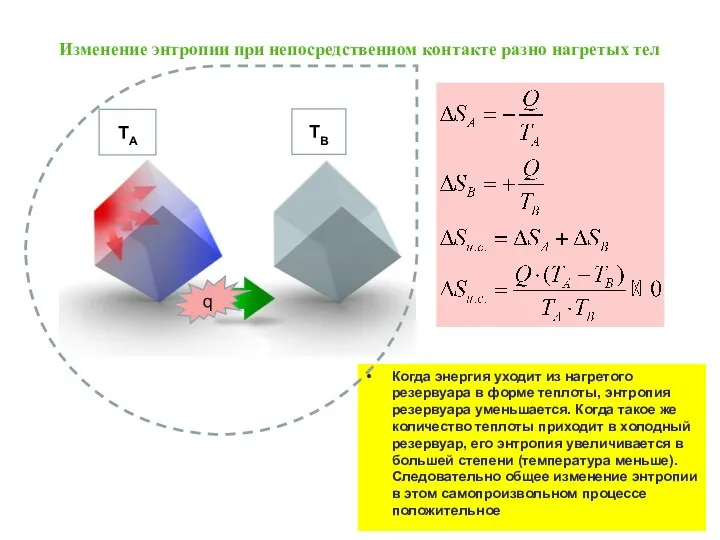
- 30. Обратим внимание, что передача эквивалентного количества тепла при разных температурах приводит к разному изменению энтропии. Чем
- 31. Изменение энтропии при непосредственном контакте разно нагретых тел Когда энергия уходит из нагретого резервуара в форме
- 32. Любой циклический процесс может быть представлен бесконечно большим числом бесконечно малых циклов Карно. Поэтому полученные соотношения
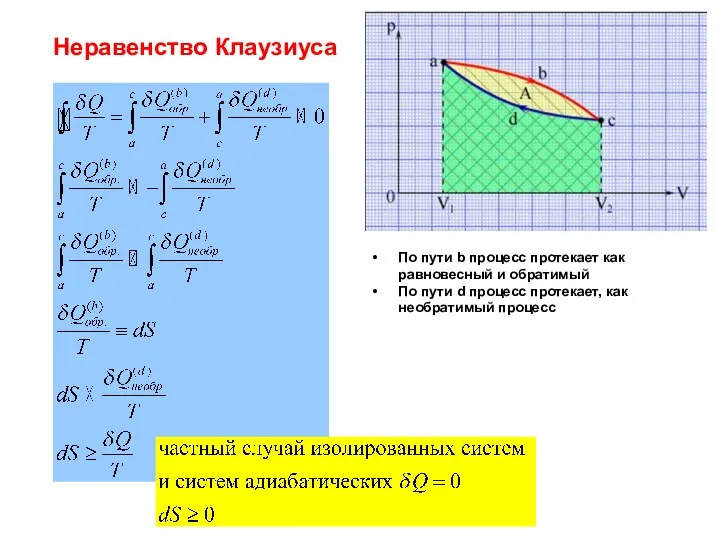
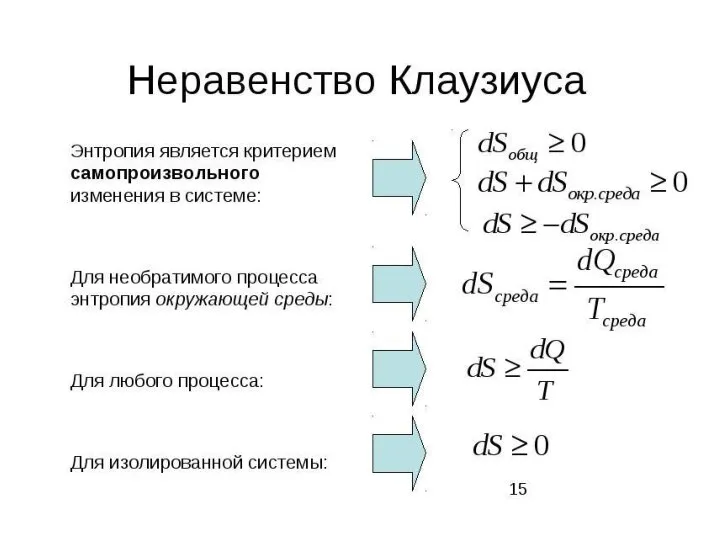
- 33. Неравенство Клаузиуса По пути b процесс протекает как равновесный и обратимый По пути d процесс протекает,
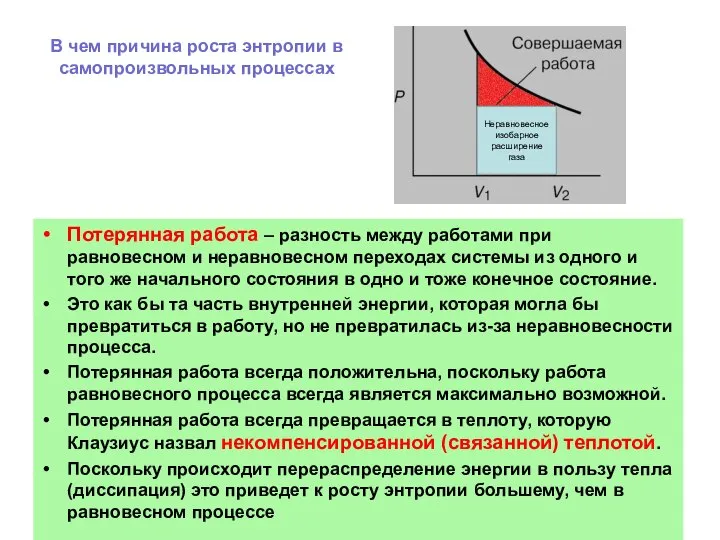
- 35. В чем причина роста энтропии в самопроизвольных процессах Потерянная работа – разность между работами при равновесном
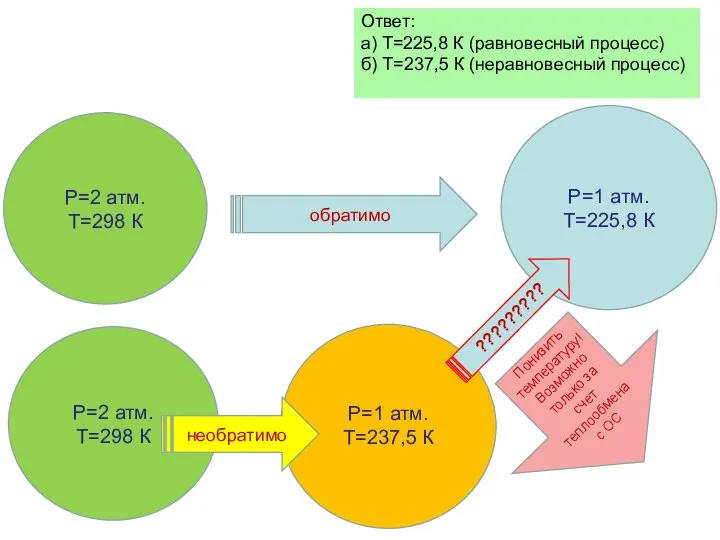
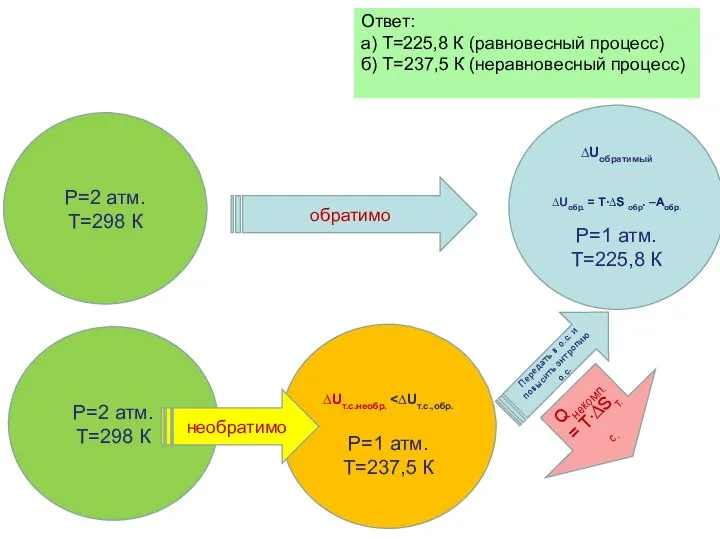
- 37. Задача Один моль Хе, находящийся при температуре 250 С и давлении 2 атмосферы расширяется адиабатически: а)
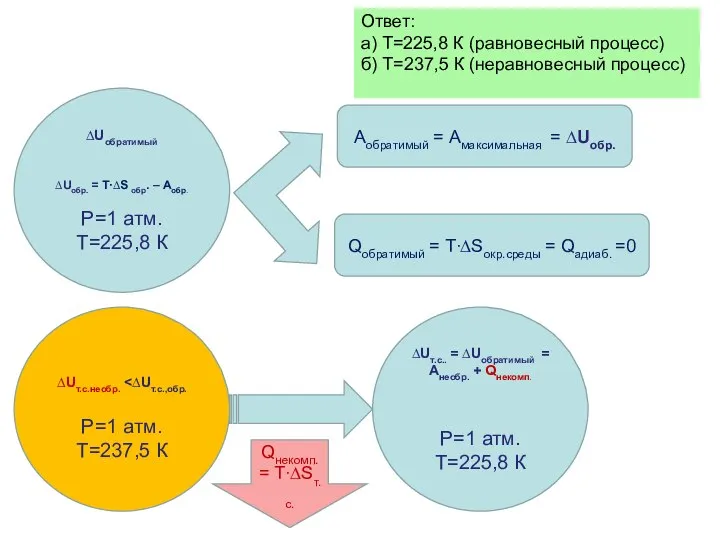
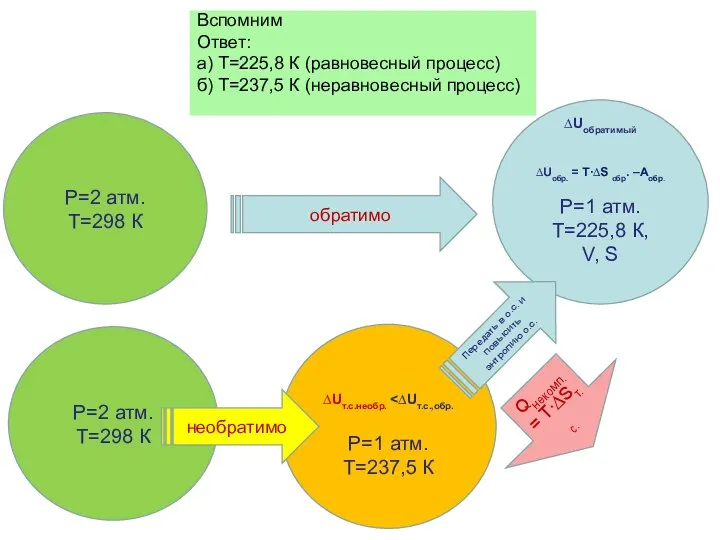
- 38. Ответ: а) Т=225,8 К (равновесный процесс) б) Т=237,5 К (неравновесный процесс) Р=1 атм. Т=225,8 К Р=1
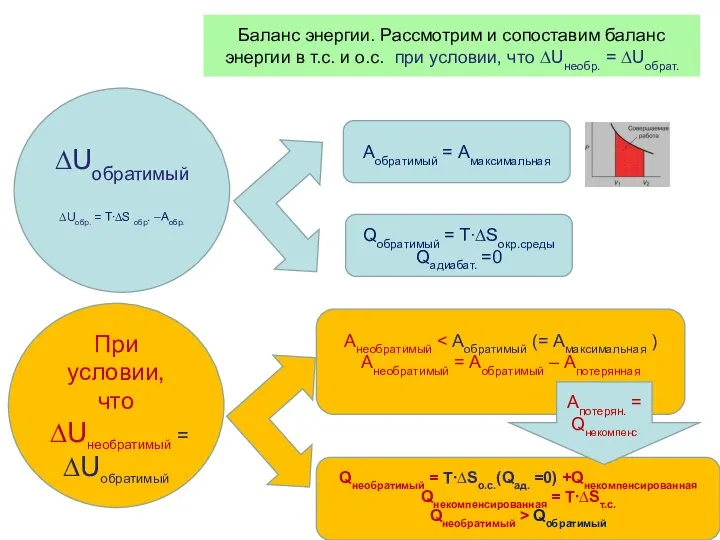
- 39. Баланс энергии. Рассмотрим и сопоставим баланс энергии в т.с. и о.с. при условии, что ∆Uнеобр. =
- 40. Ответ: а) Т=225,8 К (равновесный процесс) б) Т=237,5 К (неравновесный процесс) ∆Uобратимый ∆Uобр. = T∙∆S обр.
- 41. Ответ: а) Т=225,8 К (равновесный процесс) б) Т=237,5 К (неравновесный процесс) ∆Uобратимый ∆Uобр. = T∙∆S обр.
- 42. выводы Aнеобр. Qнеобр. > Qобр. ∆S необр. > ∆S обр. ∆U ∆U = T∙∆Sобр. – Аобр.
- 43. Статистическое толкование энтропии Уравнение Больцмана Постулат Планка Изменение энтропии в различных термодинамических процессах
- 44. События происходят в направлении их большей вероятности, т.е. того состояния, которое может быть реализовано большим числом
- 47. Система, состоящая из большого числа частиц может быть описана двумя способами: через интегрированное свойство всей системы
- 48. Термодинамическая вероятность (W) – это число неповторяющихся микросостояний , которые соответствуют данному макросостоянию вещества Состояние системы,
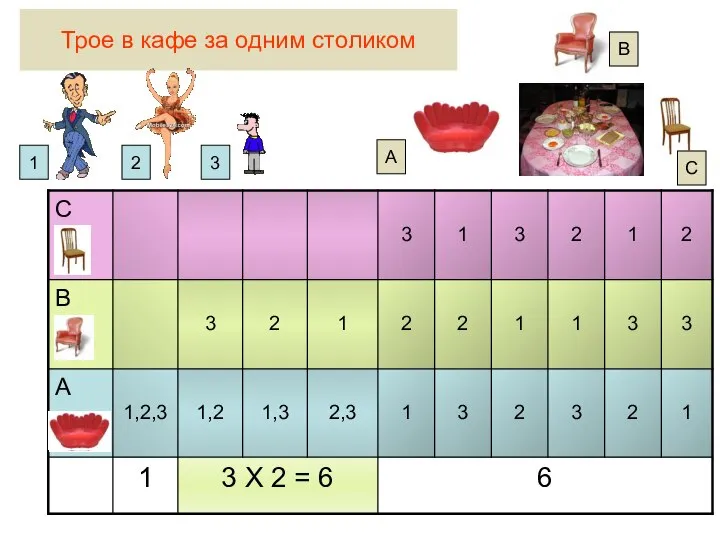
- 49. Трое в кафе за одним столиком 1 2 3 А В С
- 50. Размерность энтропии 1 э.е.= 1 Дж / мольХ К
- 51. Энтропия – мера неупорядоченности
- 52. Энтропия является функцией состояния системы Это означает, что энтропия: Является физическим свойством вещества Однозначно определена для
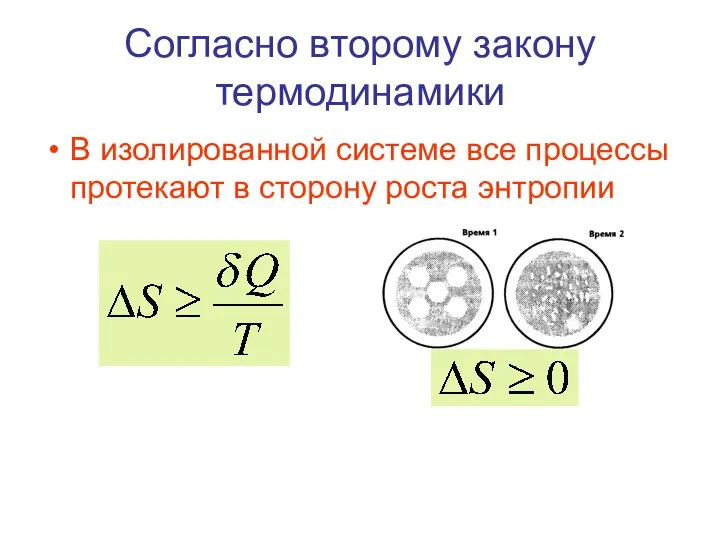
- 53. Согласно второму закону термодинамики В изолированной системе все процессы протекают в сторону роста энтропии
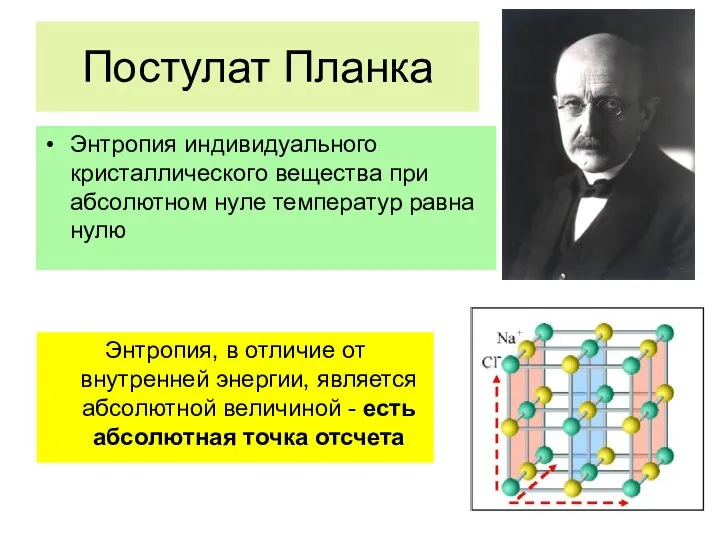
- 54. Постулат Планка Энтропия индивидуального кристаллического вещества при абсолютном нуле температур равна нулю Энтропия, в отличие от
- 55. Энтропия растет в процессах, сопровождающихся увеличением беспорядка, ростом числа частиц, а также в иных процессах, способствующих
- 56. Энтропия – это:
- 57. Энтропия – это: Свойство, которое имеет абсолютные значения величины (есть ноль отсчета – Постулат Планка) Экстенсивное
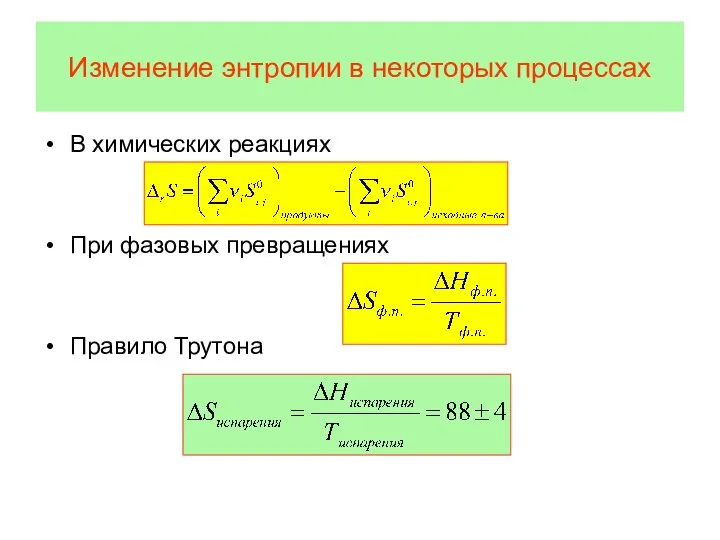
- 58. Изменение энтропии в некоторых процессах В химических реакциях При фазовых превращениях Правило Трутона
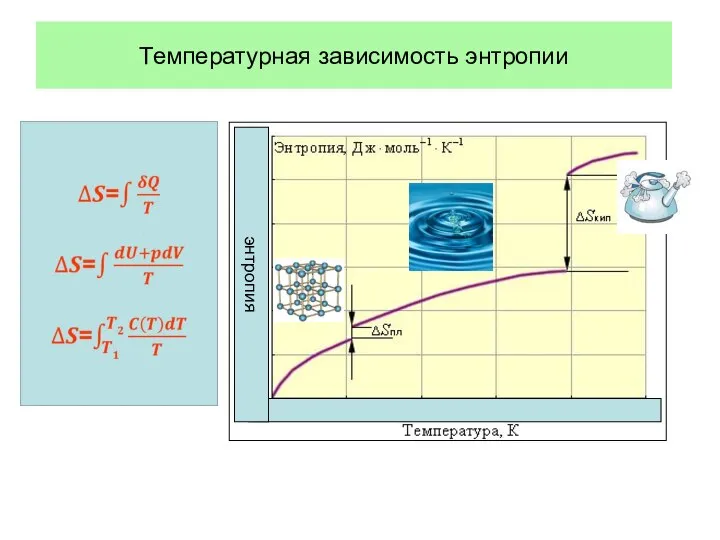
- 59. Температурная зависимость энтропии
- 61. Фундаментальное уравнение термодинамики для равновесных процессов Объединяет первое и второе начало термодинамики
- 62. Согласно второму закону термодинамики В изолированной системе все процессы протекают в сторону роста энтропии
- 63. Для неизолированных систем не все так однозначно Примеры самопроизвольных процессов, сопровождающихся уменьшением энтропии в термодинамической системе:
- 64. Неправильные выводы или что-то упустили из рассмотрения
- 65. В системе, но не во Вселенной (как в изолированной системе). Изменение энтропии состоит из двух частей:
- 68. Энтропийный и энтальпийный факторы процесса
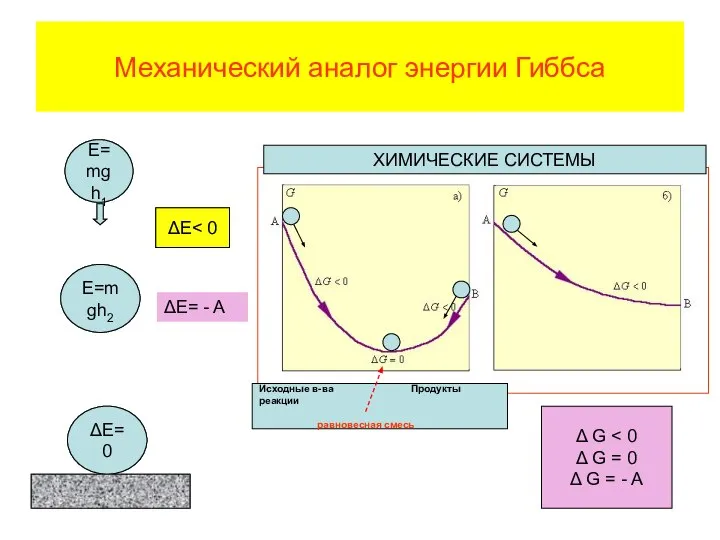
- 70. Энергия Гиббса изобарно-изотермический потенциал В самопроизвольных процессах система способна совершать работу
- 71. Положительным значениям работы соответствуют отрицательные значения изменения энергии Гиббса. Таким образом, для изобарно-изотермических условий проведения процесса
- 72. Механический аналог энергии Гиббса Δ G Δ G = 0 Δ G = - A
- 73. Энергия Гельмгольца изохорно-изотермический потенциал
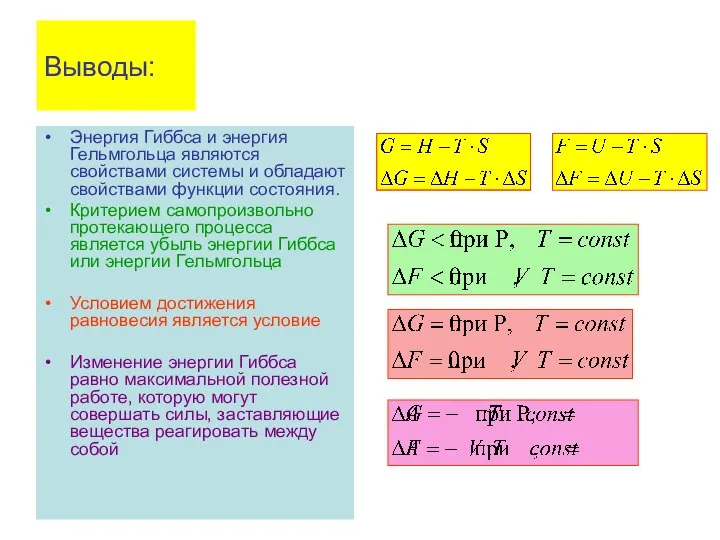
- 74. Выводы: Энергия Гиббса и энергия Гельмгольца являются свойствами системы и обладают свойствами функции состояния. Критерием самопроизвольно
- 75. Выводы: Энергия Гиббса (энергия Гельмгольца) учитывает обе тенденции - энтальпийную и энтропийную составляющие самопроизвольно протекающего процесса.
- 76. Это означает, что: 1. в самопроизвольных процессах не всегда реализуются, как благоприятные, оба фактора – и
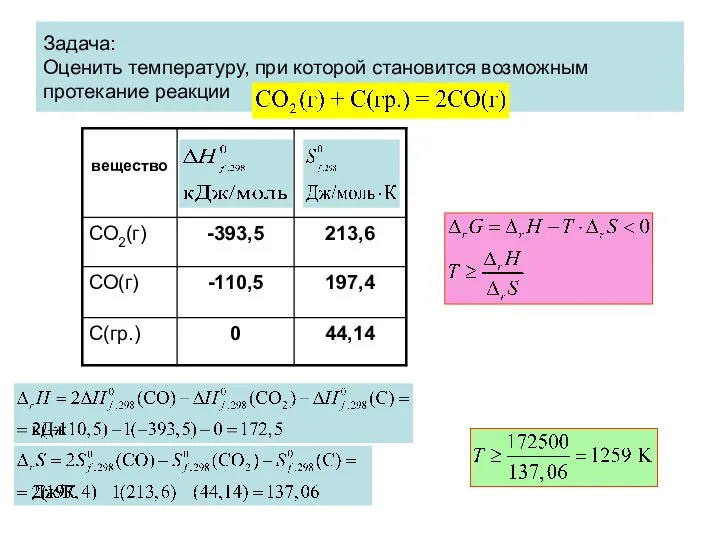
- 78. Задача: Оценить температуру, при которой становится возможным протекание реакции
- 79. Условия протекания самопроизвольного процесса при условии постоянства в системе: 1) внутренней энергии и объема 2) энтальпии
- 80. Изохорно - изоэнтропийный процесс Изобарно – изоэнтропийный процесс
- 81. Вспомним Ответ: а) Т=225,8 К (равновесный процесс) б) Т=237,5 К (неравновесный процесс) ∆Uобратимый ∆Uобр. = T∙∆S
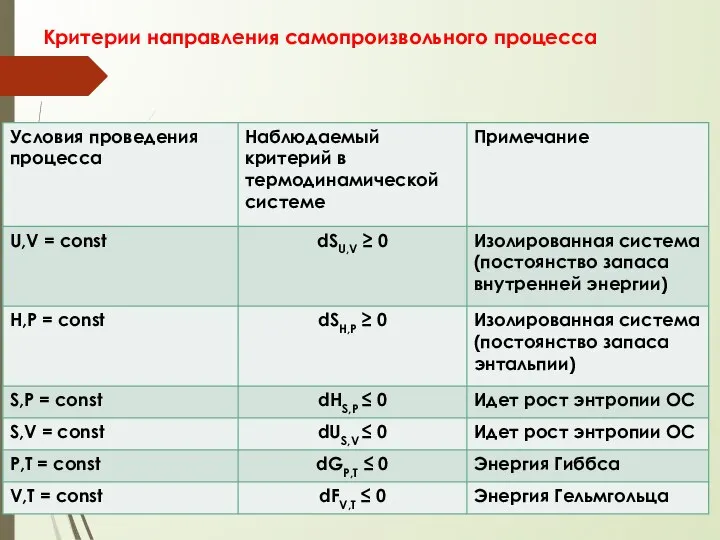
- 82. Критерии направления самопроизвольного процесса
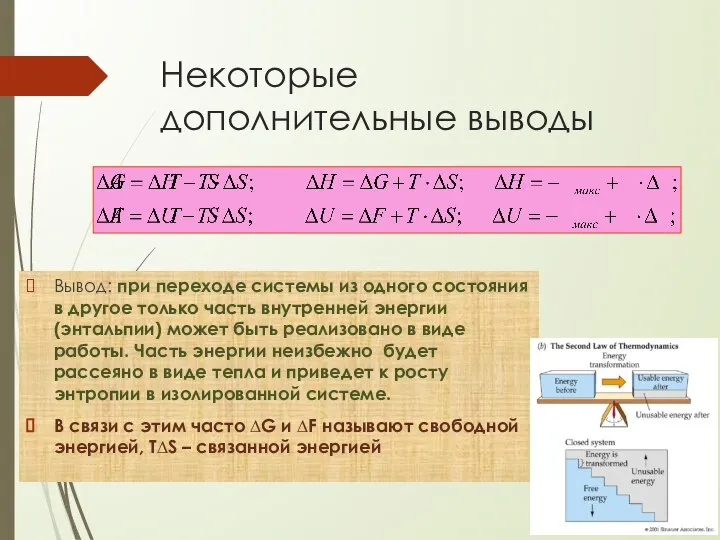
- 83. Некоторые дополнительные выводы Вывод: при переходе системы из одного состояния в другое только часть внутренней энергии
- 84. Характеристические функции Термодинамические потенциалы Характеристической называется такая функция состояния системы, посредством которой или/и посредством ее производной
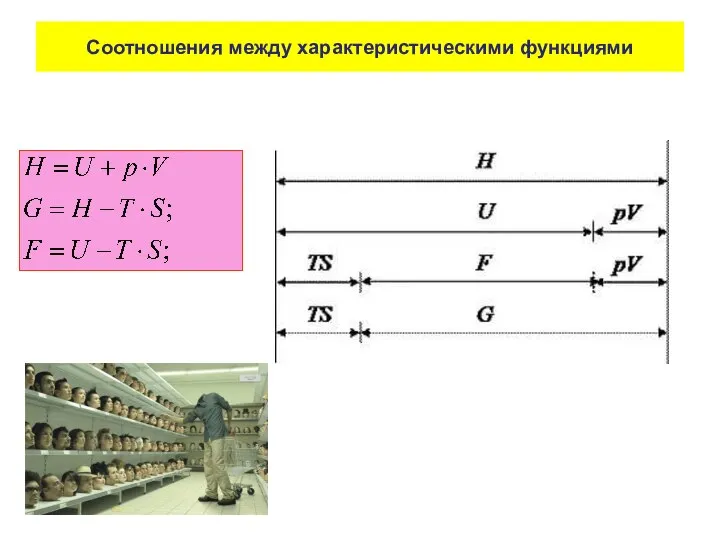
- 85. Соотношения между характеристическими функциями
- 86. Термодинамические потенциалы: Являются функциями состояния системы Позволяют установить направление и пределы самопроизвольного протекания процесса Позволяют вычислить
- 87. Фундаментальное уравнение термодинамики
- 88. Соотношения Максвелла
- 89. Задача
- 92. Скачать презентацию


























































 Диэлектрики и проводники в электрическом поле
Диэлектрики и проводники в электрическом поле Механические волны. Решение задач
Механические волны. Решение задач Презентация на тему Колебательное движение. Свободные колебания. Маятники (9 класс)
Презентация на тему Колебательное движение. Свободные колебания. Маятники (9 класс)  Сопротивление материалов. Виды нагрузок и основных деформаций
Сопротивление материалов. Виды нагрузок и основных деформаций Кинематика периодического движения (1)
Кинематика периодического движения (1) Теоретическая механика. Кинематика. Движение твердой среды
Теоретическая механика. Кинематика. Движение твердой среды Спектірлік анализ әдістері
Спектірлік анализ әдістері Решение задач ЕГЭ по физике
Решение задач ЕГЭ по физике Презентация на тему Модели атома
Презентация на тему Модели атома  Статистическое моделирование рисков продажи запасных частей
Статистическое моделирование рисков продажи запасных частей Презентация урока-лекции по теме «Электрическое поле точечного заряда. Закон Кулона» для профильного 10-го класса Подготовила уч
Презентация урока-лекции по теме «Электрическое поле точечного заряда. Закон Кулона» для профильного 10-го класса Подготовила уч Масса тела
Масса тела Сажевый фильтр
Сажевый фильтр Прямолинейное равноускоренное движение
Прямолинейное равноускоренное движение Учимся мыслить
Учимся мыслить Динамика материальной точки
Динамика материальной точки Теплоёмкость газа
Теплоёмкость газа Классификация помех в устройствах ЭВМ
Классификация помех в устройствах ЭВМ Статика
Статика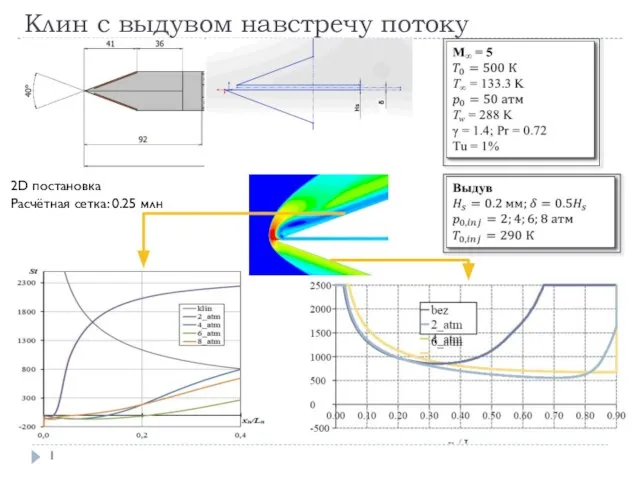 Клин с выдувом навстречу потоку
Клин с выдувом навстречу потоку Значение теплопередачи в жизни человека
Значение теплопередачи в жизни человека Соединение проводников
Соединение проводников Объяснение изменений агрегатных состояний вещества на основе молекулярно-кинетических представлений
Объяснение изменений агрегатных состояний вещества на основе молекулярно-кинетических представлений Закон сохранения момента импульса
Закон сохранения момента импульса Електромагнітні хвилі, їх використання
Електромагнітні хвилі, їх використання Заточка дереворежущего инструмента
Заточка дереворежущего инструмента Силовая схема и аппараты электропоездов ЭД4М и ЭП2Д
Силовая схема и аппараты электропоездов ЭД4М и ЭП2Д Давление твердых тел
Давление твердых тел