Содержание
- 2. Цели Цели. Повторить и систематизировать знания учеников о классификации, номенклатуре, свойствах основных классов неорганических соединений закрепить
- 3. Девиз урока «Спрашивайте и отвечайте – это девиз познания и учения».
- 4. Сегодня урок пройдет в виде теоретического похода, из которого вам необходимо принести как можно больше трофеев
- 5. Актуализация опорных знаний 1. Какие простые вещества вам известны? Как их определить по периодической системе? 2.
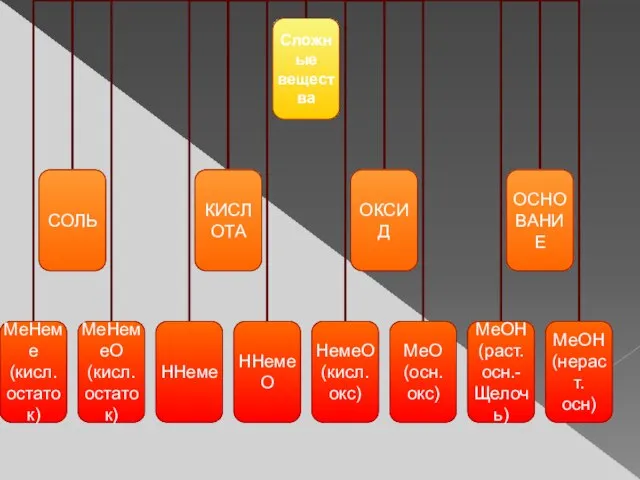
- 6. Мы выяснили, что: 1) сложные вещества делят на оксиды, кислоты, соли, основания; 2) основный оксид –
- 8. На нашем пути – речка. Чтобы перебраться через нее, необходимо построить мост, используя вещества из рюкзака.
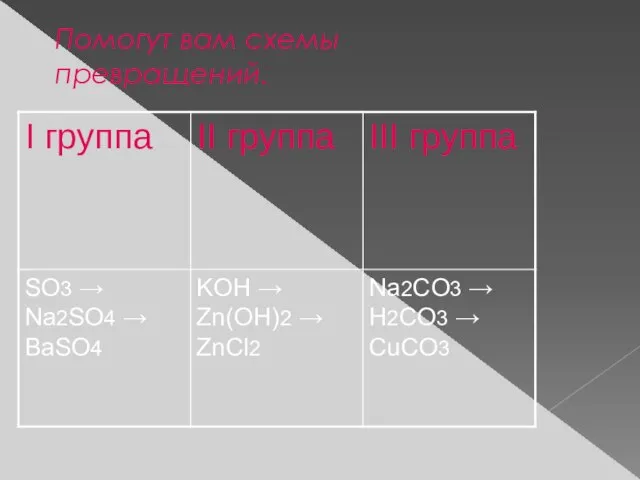
- 9. Помогут вам схемы превращений.
- 10. Вопросы классу 1. К какому типу принадлежат данные реакции? 2. Почему они происходят? 3. Какой вывод
- 11. Через речку мы перебрались, а дальше густой лес. Чтобы найти тропинку и пройти через лес, необходимо
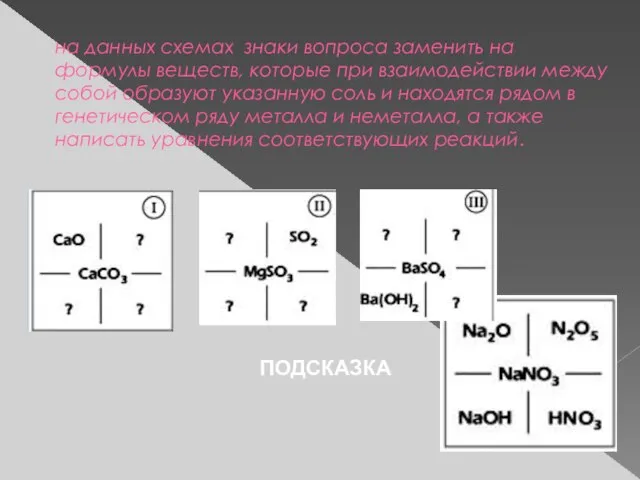
- 12. на данных схемах знаки вопроса заменить на формулы веществ, которые при взаимодействии между собой образуют указанную
- 13. Вопросы классу 1. При взаимодействии каких сложных веществ образуется соль? 2. Какой вывод можно сделать? Вывод.
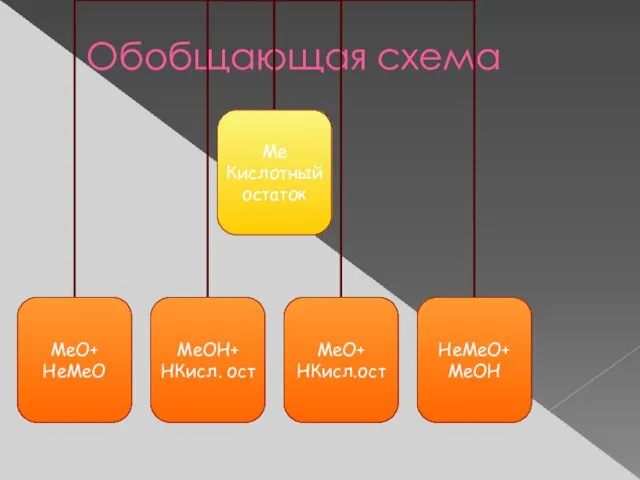
- 14. Обобщающая схема
- 15. Осталось нам преодолеть гору в виде задачи. Перед началом подъема вспомните, с какими веществами взаимодействует кислота
- 16. Ме (до Н) + HNO3 → Однако азотная кислота с металлами реагирует иначе, чем другие кислоты.
- 17. Решить задачу самостоятельно. Здесь приведено сокращенное условие задачи. Вам необходимо самостоятельно восстановить полное условие задачи и
- 18. Анализ задачи 1. Какой металл прореагировал с серной кислотой? 2. Какой объем водорода выделился? (У всех
- 19. Домашнее задание Во время путешествия к вашим рюкзакам прицепились паразиты: а) 2 атома алюминия; б) 3
- 21. Скачать презентацию














 Модель надёжности ветропарка с учётом погодных условий
Модель надёжности ветропарка с учётом погодных условий Зависимость центростремительной силы от массы, радиуса и угловой скорости
Зависимость центростремительной силы от массы, радиуса и угловой скорости Абсорбционная спектроскопия (поглощение света веществом)
Абсорбционная спектроскопия (поглощение света веществом) Передача электрической энергии. Трансформаторы
Передача электрической энергии. Трансформаторы Четырехмерный мир (пространство Минковского)
Четырехмерный мир (пространство Минковского)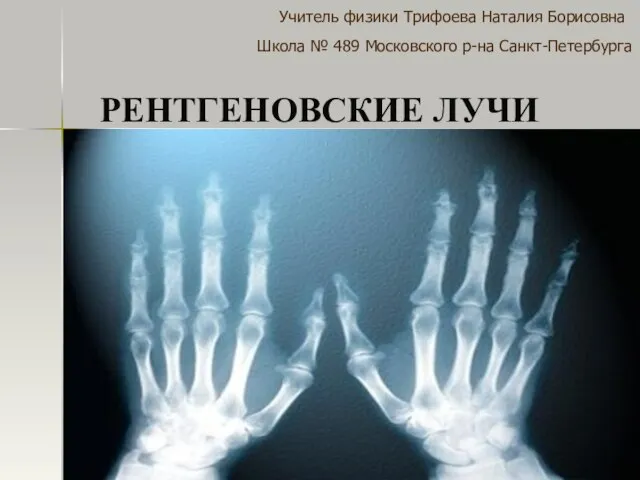 Презентация на тему Рентгеновские лучи
Презентация на тему Рентгеновские лучи  Электричество и магнетизм. Энергия электромагнитной волны. Вектор Умова-Пойнтинга. Интенсивность электромагнитной волны
Электричество и магнетизм. Энергия электромагнитной волны. Вектор Умова-Пойнтинга. Интенсивность электромагнитной волны Энергия и работа. Удары. Лекция 3
Энергия и работа. Удары. Лекция 3 Движение и его относительность
Движение и его относительность Техническое обслуживание и ремонт систем, узлов, приборов автомобилей
Техническое обслуживание и ремонт систем, узлов, приборов автомобилей Напряженность электрического поля
Напряженность электрического поля « Физика в нашей жизни»
« Физика в нашей жизни» Физика. Лекция 11. Термодинамика
Физика. Лекция 11. Термодинамика Вольт-амперная характеристика
Вольт-амперная характеристика Разновидности уравнений материальных балансов ВТП. Материальные расчеты идеальных ВТП
Разновидности уравнений материальных балансов ВТП. Материальные расчеты идеальных ВТП Физика – это наука о природе
Физика – это наука о природе Астрофизика итоги. 2021г
Астрофизика итоги. 2021г Сложение двух сил, направленных по одной прямой. Равнодействующая сила
Сложение двух сил, направленных по одной прямой. Равнодействующая сила Поляризация света
Поляризация света Сила
Сила Звуковые волны
Звуковые волны Собственный механический и магнитный моменты электрона. Спин
Собственный механический и магнитный моменты электрона. Спин Законы регулирования
Законы регулирования Электрическая система. Процесс
Электрическая система. Процесс Плавление и кристаллизация
Плавление и кристаллизация Методы измерения фокусных расстояний
Методы измерения фокусных расстояний Методы и приборы для измерения влажности газовых сред
Методы и приборы для измерения влажности газовых сред Точность механической обработки и погрешности изготовления деталей
Точность механической обработки и погрешности изготовления деталей