Содержание
- 2. Электрический ток в электролитах Задачи урока: познакомиться с явлением электролиза и его практическим применением - знать
- 3. Групповой эксперимент «электролиты» Электролитическая диссоциация Механизм проводимости Электролиз Обобщенный закон электролиза Применение электролиза (защита плаката) План
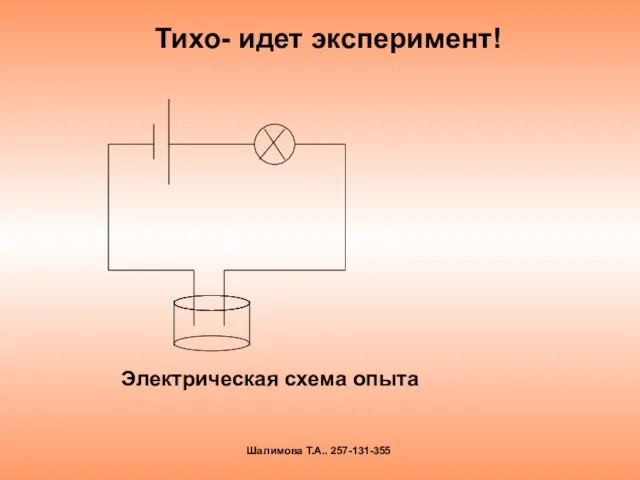
- 4. Тихо- идет эксперимент! Шалимова Т.А.. 257-131-355 Электрическая схема опыта
- 5. Запиши результаты эксперимента: 1) Сухой Сu SO4 – не проводит 2) Раствор Cu SO4 – проводит
- 6. Электролиты – вещества, растворы и расплавы которых проводят электрический ток Примеры: р-ры солей р-ры кислот р-ры
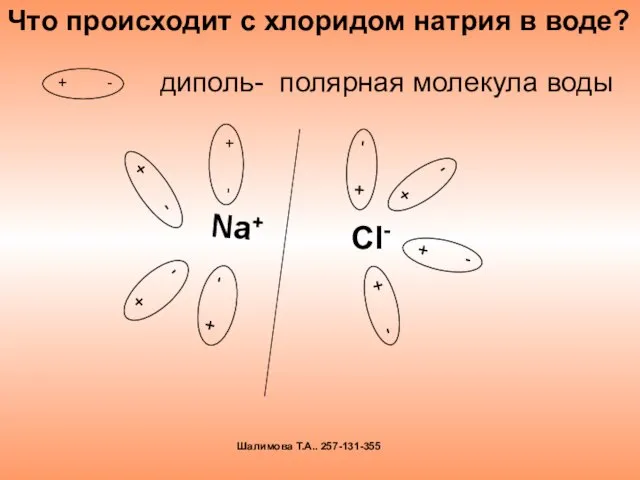
- 7. диполь- полярная молекула воды Что происходит с хлоридом натрия в воде? Шалимова Т.А.. 257-131-355
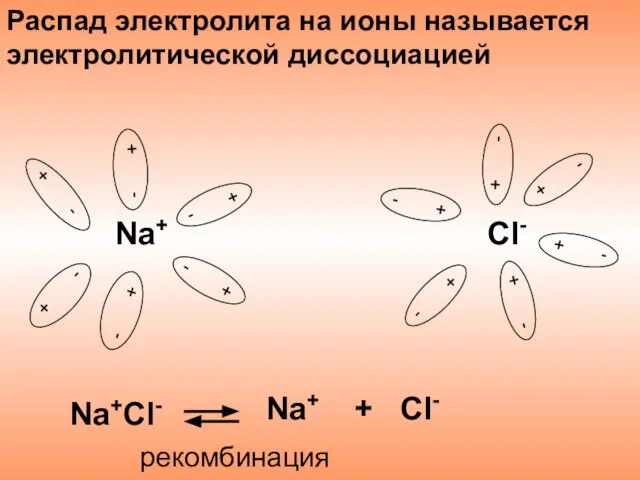
- 8. Распад электролита на ионы называется электролитической диссоциацией Na+Cl- Na+ + Cl- рекомбинация
- 9. СuSO4 Cu2+ + SO42- Проверь себя: Диссоциация медного купороса (сульфата меди) Шалимова Т.А.. 257-131-355
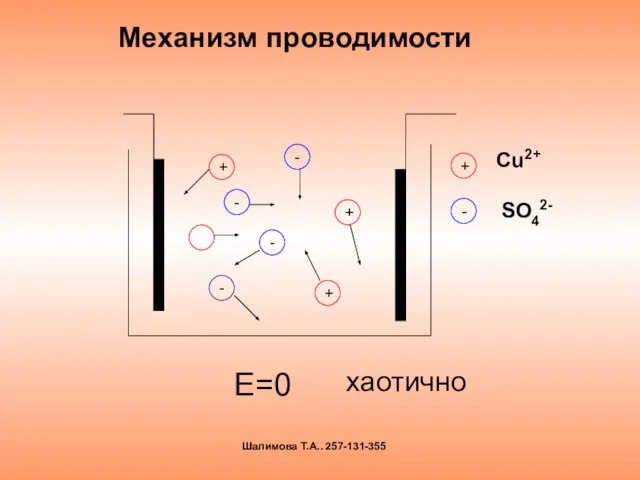
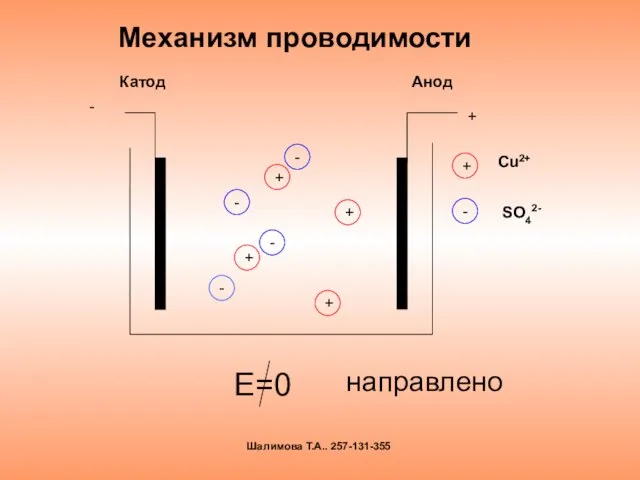
- 10. Механизм проводимости Е=0 + + + - - - - хаотично Шалимова Т.А.. 257-131-355
- 11. Механизм проводимости Е=0 направлено + + + + - - - - - + Катод Анод
- 12. Электрический ток в электролите- это направленное движение положительных и отрицательных ионов Шалимова Т.А.. 257-131-355
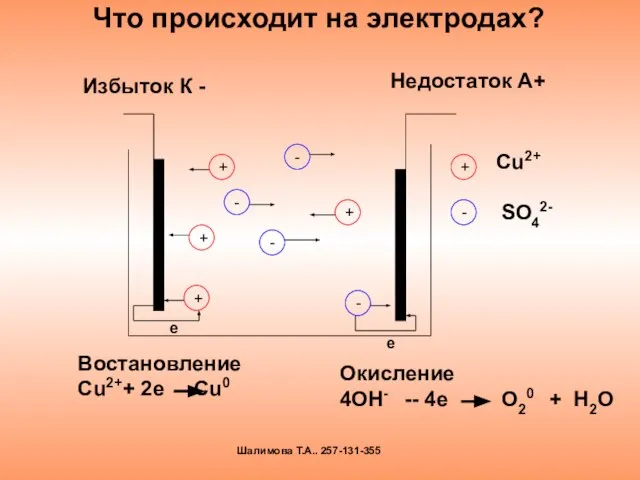
- 13. Что происходит на электродах? Избыток К - Недостаток А+ е Востановление Сu2++ 2e Cu0 Окисление 4OH-
- 14. Окислительно – восстановительные процессы под действием электрического тока называются электролизом Шалимова Т.А.. 257-131-355
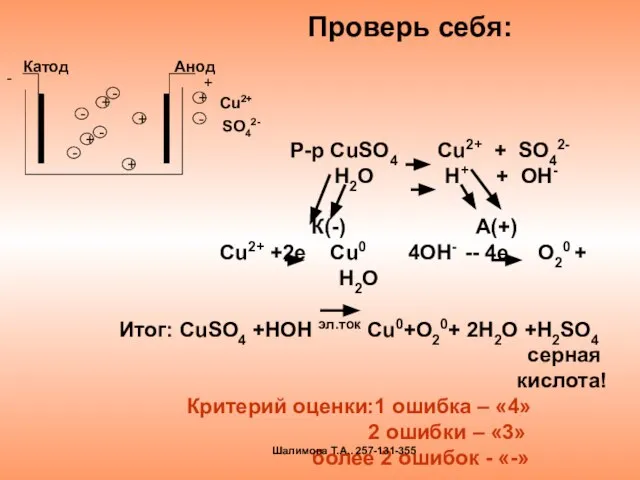
- 15. * Вспомни уроки химии и допиши схему электролиза Р-р CuSO4 Cu2+ + SO42- H2O H+ +
- 16. Правила электролиза K Ca Na Mg Al Zn Cr Fe H Cu Hg Ag An Pt
- 17. Проверь себя: Р-р CuSO4 Cu2+ + SO42- H2O H+ + OH- К(-) А(+) Сu2+ +2e Cu0
- 18. Закон электролиза был экспериментально установлен М.Фарадеем в 1832году. Английский физик Майкл Фарадей родился в предместье Лондона
- 19. m= kQ m= μ I t Fn Масса вещества, выделившегося на электроде, пропорциональна общему заряду, прошедшему
- 20. Эхо m Q k I t F Na e n μ mi N Шалимова Т.А.. 257-131-355
- 21. № 895* Модель ситуации: m = kQ = μ I t n F :μ ν =
- 22. I в Дано Си Решение m = 1,8 г = 1,8 10–3 кг m = k
- 23. II в Дано Си Решение t = 20 мин = 1,2 103 с m = k
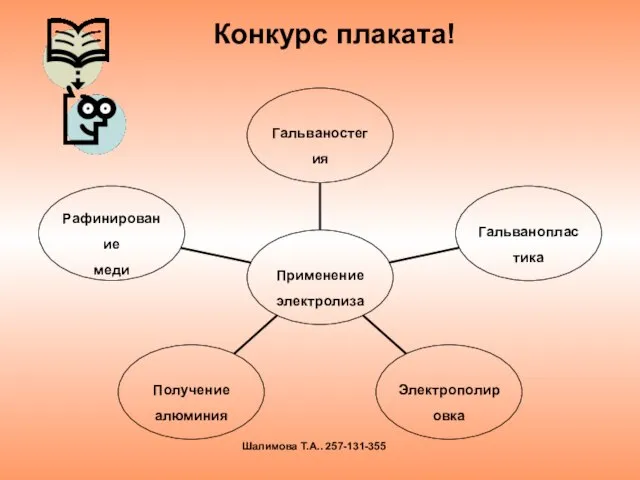
- 24. Конкурс плаката! Шалимова Т.А.. 257-131-355
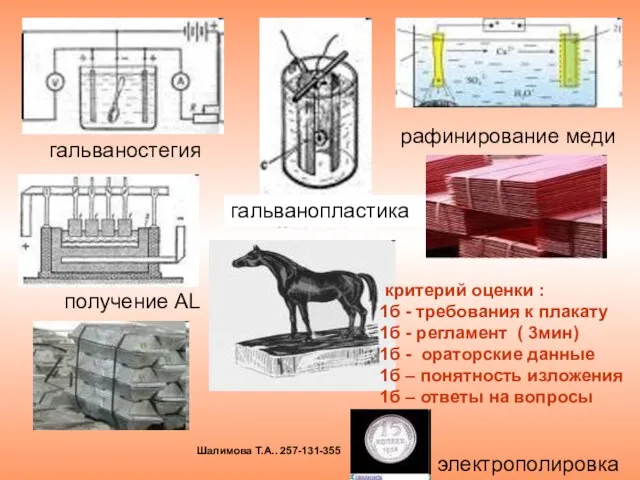
- 25. гальваностегия гальванопластика рафинирование меди электрополировка получение AL критерий оценки : 1б - требования к плакату 1б
- 26. Д/з -выучить определения: Электролиты Диполь Электролитическая диссоциация Рекомбинация Ион Электролиз Катод Анод Восстановление Окисление -анализ формул-
- 27. Использовались: - Капустин Н. П. Педагогические технологии адаптивной школы издательский центр «Академия» 2002г - О.В.Акулова и
- 29. Скачать презентацию

















 Пирометры
Пирометры Однородное и неоднородное магнитное поле
Однородное и неоднородное магнитное поле Основные требования, предъявляемые к устройствам релейной защиты
Основные требования, предъявляемые к устройствам релейной защиты Изобретения радио А.С. Поповым
Изобретения радио А.С. Поповым Электрический ток в различных средах
Электрический ток в различных средах Механическая работа. Мощность
Механическая работа. Мощность Электромагнитная индукция
Электромагнитная индукция Қозғалысты күш мөлшерімен сипаттаудағы алғашқы талпыныстар
Қозғалысты күш мөлшерімен сипаттаудағы алғашқы талпыныстар Презентация на тему Линзы. Оптическая сила линзы
Презентация на тему Линзы. Оптическая сила линзы  Радиоволны. Рудольф Генрих
Радиоволны. Рудольф Генрих Здравствуй, физика!
Здравствуй, физика! Магнитные цепи и их расчеты
Магнитные цепи и их расчеты Контактные методы экологического мониторинга
Контактные методы экологического мониторинга Скорость витания
Скорость витания Работа и мощность электрического тока
Работа и мощность электрического тока Двигатель. Классификация двигателей
Двигатель. Классификация двигателей Строение атомного ядра
Строение атомного ядра Плоские ЭМВ в неограниченных средах
Плоские ЭМВ в неограниченных средах Перший закон термодинаміки
Перший закон термодинаміки Формульный диктант Кинематика, законы Ньютона, сохранения, статика
Формульный диктант Кинематика, законы Ньютона, сохранения, статика Задача: расчет процесса водяного пара
Задача: расчет процесса водяного пара Магнитная индукция
Магнитная индукция Расчет смесителей
Расчет смесителей Прямолинейное равноускоренное движение
Прямолинейное равноускоренное движение Водяная ракета
Водяная ракета Расчёт электромагнитного поля (ЭМП)
Расчёт электромагнитного поля (ЭМП) Связь с подводными лодками
Связь с подводными лодками Линейка - как измерительный прибор в физике
Линейка - как измерительный прибор в физике