протонно-нейтронную модель ядра. Протоны и нейтроны называются нуклоны. Ядро + протон нейтрон Z – число протонов в ядре N – число нейтронов в ядре А = Z+N – массовое число А = М (округляют до целого числа)
1929 г. Скобельцын Дмитрий Владимирович открыл позитрон. Позитрон переходит с протона на нейтрон и наоборот. Нейтрон становится протоном, а протон нейтроном, в этом помогают позитрону частички нейтрино и антинейтрино.
Нейтри́но (итал. neutrino — нейтрончик, уменьшительное от neutrone — нейтрон) — общее название нейтральных фундаментальных частиц с полуцелым спином, участвующих только в слабом и гравитационном взаимодействиях и относящихся к классу лептонов. Нейтрино малой энергии чрезвычайно слабо взаимодействуют с веществом, и поэтому имеют колоссальную длину пробега в самых разных веществах: так, нейтрино имеют в воде длину свободного пробега порядка 1018 м (около ста св. лет), а практически все типы звёзд прозрачны для нейтрино. Каждую секунду через площадку на Земле площадью в 1 см² проходит около 6⋅1010 нейтрино, испущенных Солнцем, однако их влияние на вещество практически никак не ощущается.














 Масштаб аэрофотоснимков
Масштаб аэрофотоснимков Устройство и принцип работы дизельного двигателя
Устройство и принцип работы дизельного двигателя Плотность. Плотность мрамора
Плотность. Плотность мрамора Клепаные и сварные соединения
Клепаные и сварные соединения Квантовая физика. Фотоэффект
Квантовая физика. Фотоэффект Русские изобретения, которыми пользуется весь мир
Русские изобретения, которыми пользуется весь мир Деформация Сила упругости, закон Гука (Тема 1, Тема 2)
Деформация Сила упругости, закон Гука (Тема 1, Тема 2) Ветровой электрогенератор challenergy
Ветровой электрогенератор challenergy I-D диаграмма влажного воздуха
I-D диаграмма влажного воздуха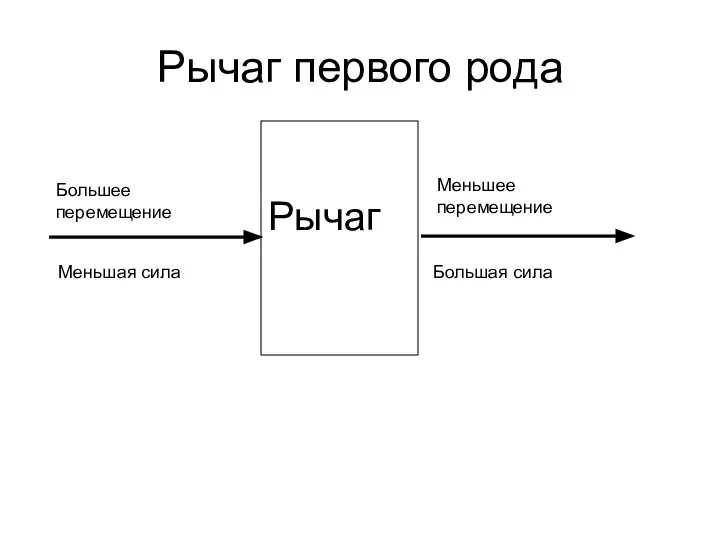 Рычаг первого рода
Рычаг первого рода Сопротивление материалов
Сопротивление материалов Тепловое расширение
Тепловое расширение А.В.Перышкин Физика, 8 класс. Решение задач
А.В.Перышкин Физика, 8 класс. Решение задач Теория и практика формообразования заготовок
Теория и практика формообразования заготовок Проверь себя!!!
Проверь себя!!! Первый пароход 4/2 класс
Первый пароход 4/2 класс Законы сохранения в механике. Лекция № 5
Законы сохранения в механике. Лекция № 5 Механика деформируемого твердого тела
Механика деформируемого твердого тела Давление твердых тел
Давление твердых тел Светофор. Внеклассное мероприятие по физике
Светофор. Внеклассное мероприятие по физике Понятие индукции
Понятие индукции Ядерный реактор
Ядерный реактор Электростатика
Электростатика Презентация на тему Давление света
Презентация на тему Давление света  Задачи на соединение проводников
Задачи на соединение проводников Презентация по физике "Скорость" -
Презентация по физике "Скорость" -  Относительность движения
Относительность движения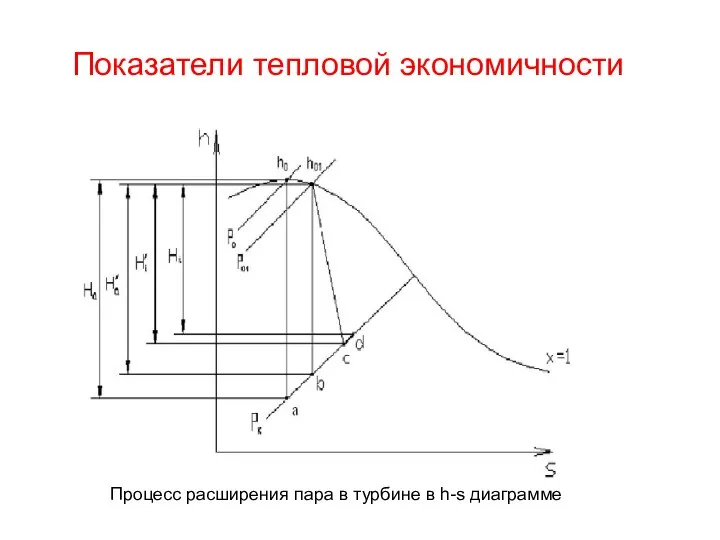 Показатели тепловой экономичности
Показатели тепловой экономичности