Содержание
- 2. Кафедра общей и медицинской химии им. проф. В.В. Хорунжего Ул. Литовская 2, от шлагбаума направо, 1
- 3. Информация о нашей кафедре (для учебы и не только) Gpmu.org→университет→структура→кафедры→кафедра общей и медицинской химии им. проф.
- 4. Необходимая литература для подготовки 1. Учебники:
- 6. 2. Учебно-методические пособия нашей кафедры
- 7. I. Основные понятия термодинамики Термодинамика – раздел науки, изучающий энергетику (законы, описывающие энергетические процессы) физических и
- 8. А) Гомогенная (однородная) система Б) Гетерогенная – разнородная система
- 9. Системы: В зависимости от характера взаимодействия с окружающей средой различают системы: ◄изолированная – отсутствие обмена энергией
- 10. Где какая система?
- 11. Термодинамические параметры интенсивные (их значения не зависят от числа частиц в системе) параметры ♦давление, температура, ♦масса
- 12. Энергия полная Е = К+П+U Е – полная энергия К (или Екин.) – кинетическая энергия (мера
- 13. Энергия Единица измерения энергии – Калории или Джоуль Калория —энергия, необходимая для нагревания 1 грамма воды
- 14. Работа (А) – изменение (передача энергии от одного тела к другому) энергии объектов, состоящих из очень
- 15. Теплота (Q)(происходит на микроуровне) – энергетическая мера хаотических форм движения частиц системы в процессе взаимодействия с
- 16. Законы термодинамики 0. Нулевой закон термодинамики: если система находится в равновесии, то температура во всех ее
- 17. Где Н-энтальпия (внутренняя энергия) А. Следовательно, при р = сonst (изобарные условия) теплота, подводимая к системе,
- 18. Cтандартные условия: Количество вещества 1 моль Давление 760 мм.рт.ст. (101,3 кПа) Температура 25°С = 298К Различают
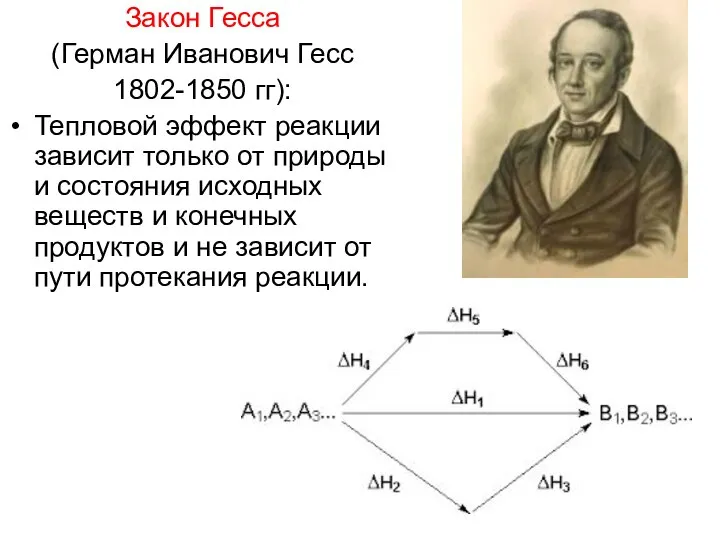
- 19. Закон Гесса (Герман Иванович Гесс 1802-1850 гг): Тепловой эффект реакции зависит только от природы и состояния
- 21. 2. Закон Термодинамики (“закон об энтропии”) В изолированных системах самопроизвольно* могут совершаться только такие необратимые процессы,
- 22. Энергия Гиббса (Джозайя Уиллард Гиббс 1839-1903 гг.) ∆G = ∆H-T∆S Обобщенная термодинамическая функция состояния системы, учитывающая
- 23. Что такое T∆S? -энтропийный фактор Часть энергии способная рассеиваться в окружающую среду в виде тепла (рост
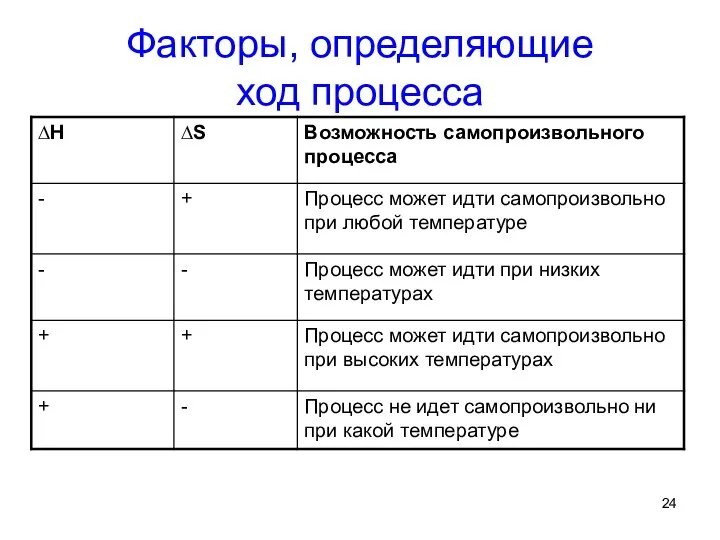
- 24. Факторы, определяющие ход процесса
- 25. Таким образом: 1. если ∆G 0); реакция самопроизвольно идет в прямом направлении 2. если ∆G>0 –
- 26. В биохимических процессах 1. ∆G Ex: гликолиз, электролитическая диссоциация АТФ+Н2О→АДФ+Ф ∆G = -30.5 кДж/моль
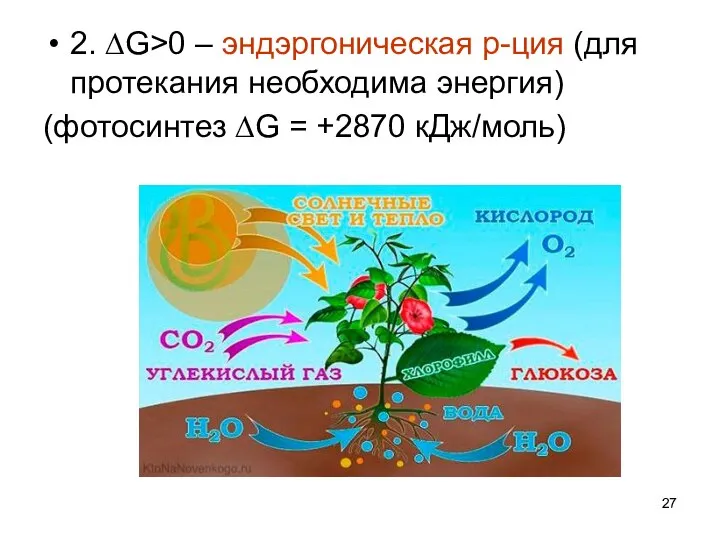
- 27. 2. ∆G>0 – эндэргоническая р-ция (для протекания необходима энергия) (фотосинтез ∆G = +2870 кДж/моль)
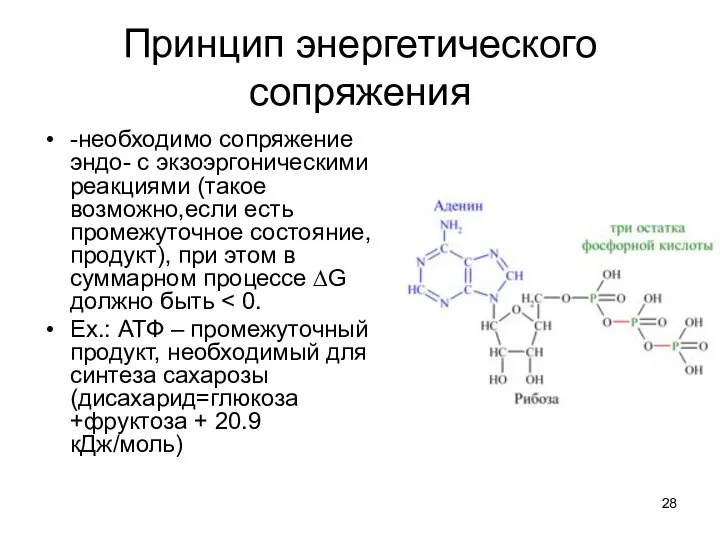
- 28. Принцип энергетического сопряжения -необходимо сопряжение эндо- с экзоэргоническими реакциями (такое возможно,если есть промежуточное состояние, продукт), при
- 30. 3. Закон термодинамики (Постулат Планка) при температуре абсолютного нуля (Т=0 К) энтропия идеальных кристаллов любого простого
- 31. Хотя в последние годы в США была достигнута Т = 900 нК Всё-таки! “Perpetuum Mobile” невозможен!
- 32. Неравновесные процессы (Теорема И. Р. Пригожина) -производство энтропии открытой системой, находящейся в стационарном состоянии, стремится к
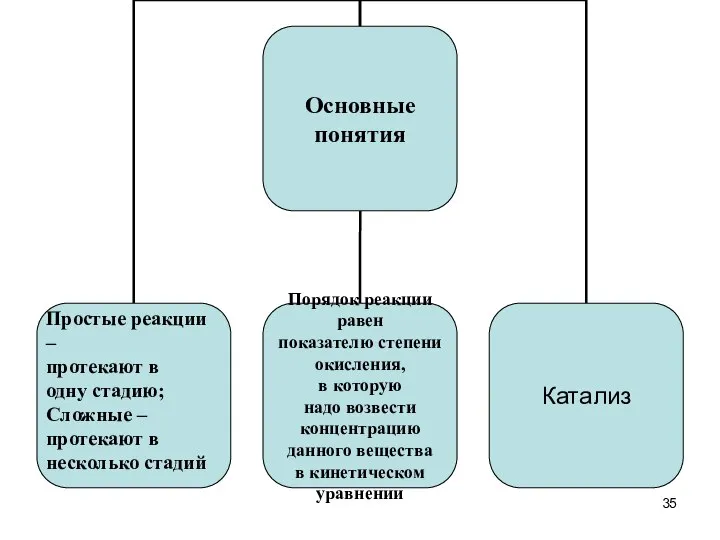
- 33. II. Кинетика химических реакций -исследование закономерностей протекания химических процессов во времени (в зависимости от: температуры, давления,
- 34. Понятия к повторению: 1. Факторы, влияющие на скорость реакции (концентрации исходных веществ, температура, природа и агрегатное
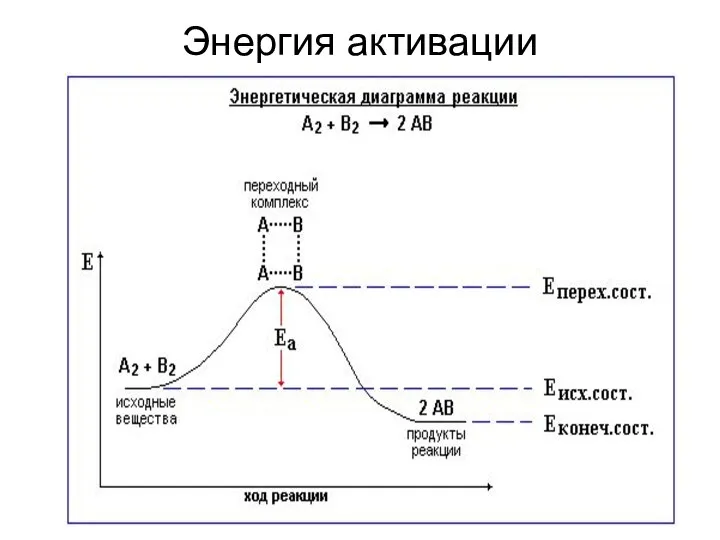
- 36. Энергия активации Энергия активации (Еа) – избыточная энергия, необходимая для вступления реагирующих веществ в реакцию при
- 37. Уравнение Больцмана Согласно уравнению Больцмана NEa/N = e-Ea/RT Где NEa число частиц с большей, чем Еа
- 38. Уравнение Больцмана В 1872 г. Л.Больцман предложил статистическую формулировку второго закона термодинамики : изолированная система эволюционирует
- 39. Уравнение Больцмана На могильном камне Больцмана выбита установленная им формула S = k ln W связывающая
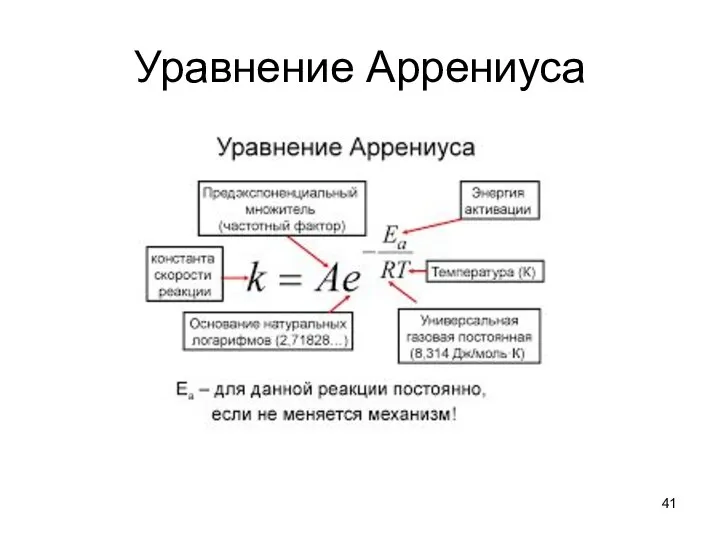
- 40. Уравнение Аррениуса Повышение температуры от Т1 до Т2 увеличивает долю молекул с достаточной энергией для реакции.
- 41. Уравнение Аррениуса
- 42. Энергия активации
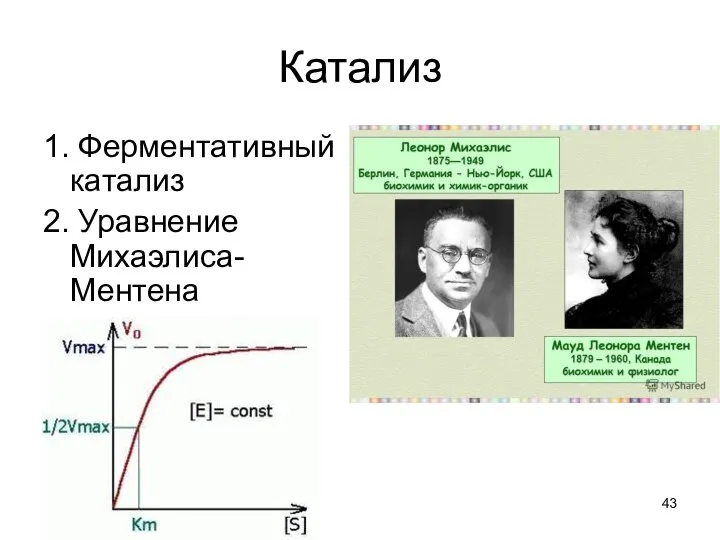
- 43. Катализ 1. Ферментативный катализ 2. Уравнение Михаэлиса-Ментена
- 44. Впервые кинетическое описание ферментативных реакций сделали Михаэлис и Ментен. КМ – const Михаэлиса, учитывающая величины const
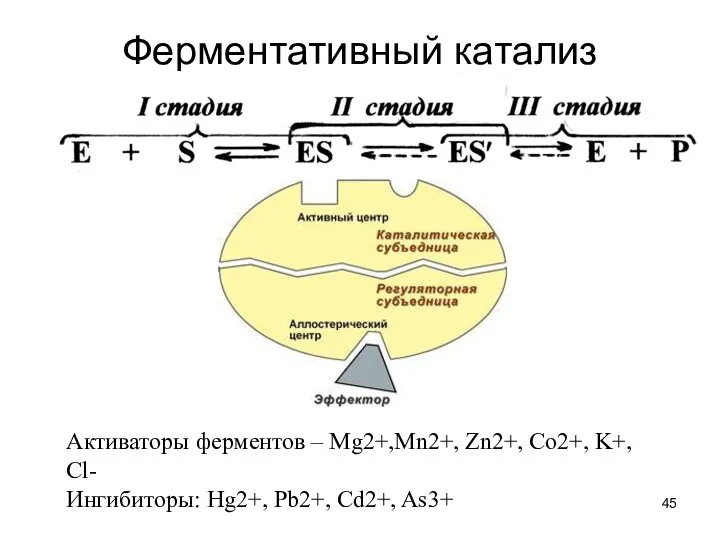
- 45. Ферментативный катализ Активаторы ферментов – Mg2+,Mn2+, Zn2+, Co2+, K+, Cl- Ингибиторы: Hg2+, Pb2+, Cd2+, As3+
- 46. Обозначения: Е – активный центр фермента S – субстрат ES – фермент-субстратный комплекс Р – продукт
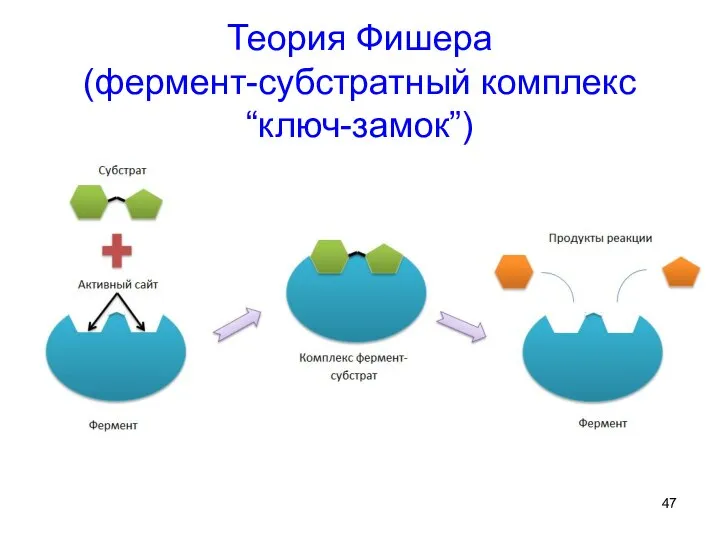
- 47. Теория Фишера (фермент-субстратный комплекс “ключ-замок”)
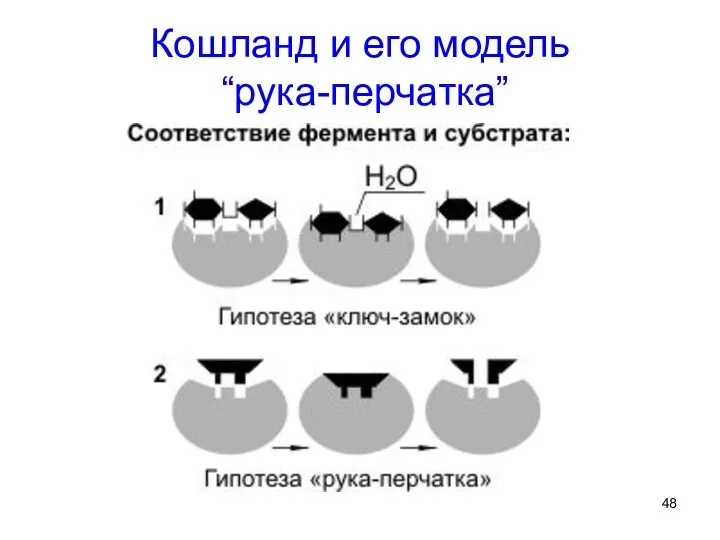
- 48. Кошланд и его модель “рука-перчатка”
- 50. Скачать презентацию




































 Физика элементарных частиц
Физика элементарных частиц Графическое представление физического процесса - функция
Графическое представление физического процесса - функция Способы увеличения и уменьшения давления твёрдых тел
Способы увеличения и уменьшения давления твёрдых тел Механическое движение (7 класс)
Механическое движение (7 класс) Электродинамика
Электродинамика Приспособления к швейной машине. Обметывание петель
Приспособления к швейной машине. Обметывание петель Свободные и вынужденные колебания. Колебательные системы. (9 класс)
Свободные и вынужденные колебания. Колебательные системы. (9 класс) Магнитное поле
Магнитное поле Статика
Статика Презентация на тему Механические колебания (11 класс)
Презентация на тему Механические колебания (11 класс)  Равномерное движение
Равномерное движение История изобретения телефона. Канада
История изобретения телефона. Канада laboratorn_2
laboratorn_2 Вязко-упругие свойства суспензий наночастиц
Вязко-упругие свойства суспензий наночастиц Презентация на тему Самоиндукция (9 класс)
Презентация на тему Самоиндукция (9 класс)  Использование электромагнитной индукции
Использование электромагнитной индукции Викторина по физике
Викторина по физике Духовно-нравственное воспитание на уроках физики
Духовно-нравственное воспитание на уроках физики Архимедова сила. 7 класс
Архимедова сила. 7 класс Газовые законы
Газовые законы Давление твердых тел
Давление твердых тел Понятие классической – макроскопической теории электромагнитного поля
Понятие классической – макроскопической теории электромагнитного поля Лазер
Лазер Атомно-абсорбционная спектроскопия
Атомно-абсорбционная спектроскопия Свойства веществ
Свойства веществ PVD метод
PVD метод Система обнаружения и блокировки излучения радиосигнала
Система обнаружения и блокировки излучения радиосигнала Прямолинейное равноускоренное движение. Ускорение
Прямолинейное равноускоренное движение. Ускорение