Слайд 2В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном.

Многие из них мы привыкли видеть в каком-либо одном состоянии. Например, железо – в твёрдом, спирт - в жидком, водород - в газообразном. Однако есть и такие, которые в нашей жизни встречаются сразу в трёх агрегатных состояниях, например , вода: твёрдое состояние – лёд, жидкое – вода, газообразное – водяной пар. В различных состояниях вещества обладают разными свойствами. Давайте попробуем разобраться почему?
Слайд 3Цель урока – познакомить учащихся со свойствами твёрдых тел, жидкостей и газов,

и объяснить их с точки зрения молекулярного строения вещества..
Задачи урока:
1. Воспитательная: формировать познавательный интерес к предмету, коммуникабельность, умение излагать свою точку зрения.
2. Образовательная: формировать умения применять полученные знания о молекулярном строении вещества для объяснения свойств твёрдых тел, жидкостей и газов.
3. Развивающая: формировать у учащихся навыки исследовательской деятельности и работы с учебником, развивать умения выделять главное, сравнивать и анализировать.
Слайд 4Блиц-опрос.
Из чего состоят все тела?
Что называют молекулами?
Из чего состоят молекулы?
Отличаются ли между

собой молекулы одного и того же вещества?
Почему при нагревании все тела расширяются, а при охлаждении сжимаются?
Что вы можете сказать о величине промежутков между молекулами твёрдых тел, жидкостей и газов?
Какое явление называют диффузией?
Почему диффузия в разных телах происходит с разной скоростью?
Почему твёрдые тела и жидкости не распадаются на отдельные молекулы?
Что вы можете сказать о силах взаимодействия между молекулами твёрдых тел, жидкостей и газов?
Слайд 5Давайте попробуем исследовать и сравнить основные свойства твёрдых тел, жидкостей и газов.

Слайд 6Строение твёрдых тел, жидкостей и газов.

Слайд 7Нам известно, что молекулы одного и того же вещества (например, воды) не

отличаются друг от друга, но в чём же причина столь разных свойств вещества в различных агрегатны х состояниях?
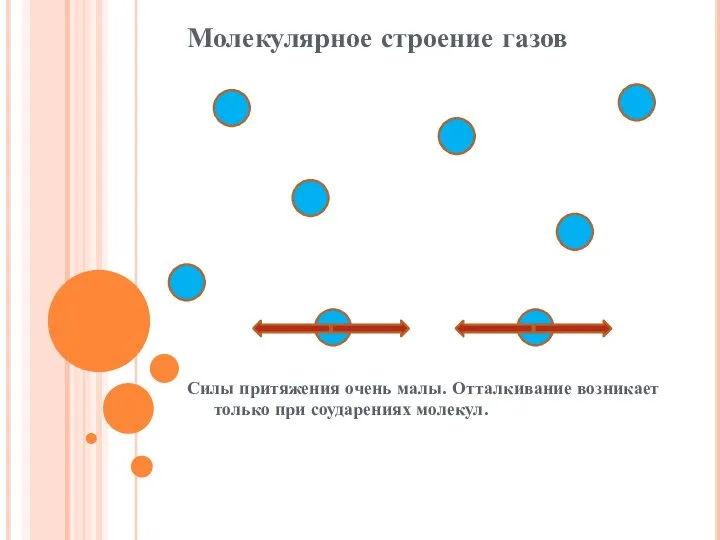
Слайд 8Молекулярное строение газов
«Х А О С ! ! !»
Характер движения молекул. Расположение

молекул.
Слайд 9Молекулярное строение газов
Силы притяжения очень малы. Отталкивание возникает только при соударениях молекул.
Слайд 10Молекулярное строение жидкостей
«Х А О С ! ! !»
Характер движения молекул. Расположение
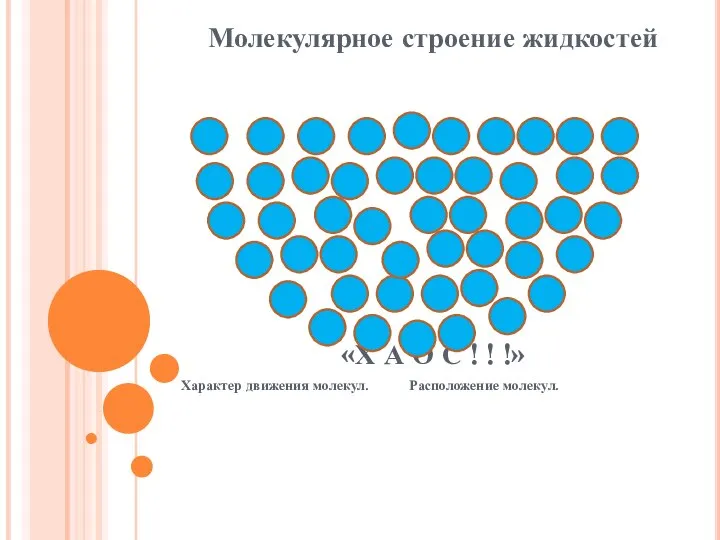
молекул.
Слайд 11Молекулярное строение жидкостей
Молекулы жидкости расположены близко друг к другу. Расстояние между молекулами

меньше размеров молекул, поэтому взаимодействие между молекулами велико, но не такое большое, как между молекулами твёрдых тел. Молекулы жидкости подвижны, они способны перескакивать с места на место. Поэтому жидкости сохраняют свой объём, но не сохраняют форму и текучи.
Слайд 12Молекулярное строение
твёрдых тел
«П О Р Я Д О К !!!»
Порядок в расположении

молекул.
Колеблются на месте.
Расстояние между молекулами соизмеримо с размерами молекул.
Поэтому взаимодействие между молекулами огромное.
Слайд 13Почему газы не имеют форму и не сохраняют объём?
Молекулы взаимодействуют слабо.

Слайд 14Почему
жидкости
не имею формы,
но сохраняют
объём?
Молекулы взаимодействуют
сильно,
но перескоки
возможны.

Слайд 15Почему твёрдые тела имеют форму и сохраняют объём?
Молекулы взаимодействуют очень сильно и

перескоки невозможны.














 Презентация на тему Теплопередача и ее виды
Презентация на тему Теплопередача и ее виды  I закон термодинамики
I закон термодинамики Теория движения военных колесных машин. Лекция 3
Теория движения военных колесных машин. Лекция 3 Будущие технологии. Викторина
Будущие технологии. Викторина Атомно-абсорбционные методы. АSS
Атомно-абсорбционные методы. АSS Молекулярная физика
Молекулярная физика Типы линз. Формула линзы. Применение насадочных линз в фотографии
Типы линз. Формула линзы. Применение насадочных линз в фотографии Двухмерный мир в поверхности цилиндра
Двухмерный мир в поверхности цилиндра Презентация на тему Атмосферное давление
Презентация на тему Атмосферное давление  Компьютерная поддержка урока физики
Компьютерная поддержка урока физики Презентация на тему: Идеальный газ в МКТ
Презентация на тему: Идеальный газ в МКТ Динамика. Законы Ньютона: область применимости
Динамика. Законы Ньютона: область применимости Основные понятия квантовой механики
Основные понятия квантовой механики Источники света
Источники света Полупроводники
Полупроводники Почему радуга разноцветная?
Почему радуга разноцветная? Элементы релятивистской механики. Лекция № 8
Элементы релятивистской механики. Лекция № 8 Магнитное поле Земли
Магнитное поле Земли Атомные электрические станции. Вариант №26
Атомные электрические станции. Вариант №26 Электрическая цепь. Последовательное и параллельное соединение проводников
Электрическая цепь. Последовательное и параллельное соединение проводников Подборка заданий по кинематике (из открытого банка заданий ЕГЭ 2015-2016 уч. год )
Подборка заданий по кинематике (из открытого банка заданий ЕГЭ 2015-2016 уч. год ) Интерференция волн
Интерференция волн Общие понятия о машинах. Показатели работоспособности машин
Общие понятия о машинах. Показатели работоспособности машин Кипение. Удельная теплота парообразования. Решение задач
Кипение. Удельная теплота парообразования. Решение задач Презентация на тему Механические колебания (11 класс)
Презентация на тему Механические колебания (11 класс)  Паровая машина Ползунова
Паровая машина Ползунова Аналогово-цифровой контроллер
Аналогово-цифровой контроллер Наклонная плоскость
Наклонная плоскость