Содержание
- 2. Побочная подгруппа 8 группы периодической системы охватывает три триады d – элементов. Первую триаду образуют элементы:
- 3. Вторую триаду образуют элементы: Ru (рутений), Rh (родий), Pd (палладий).
- 4. Третью триаду: Os (осмий), Ir (иридий), Pt (платина).
- 5. Общая электронная формула: […] ns 0÷2 (n–1)d 6÷10
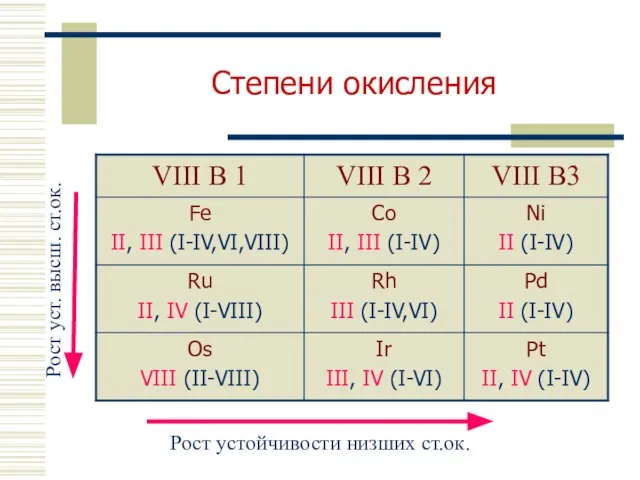
- 6. Степени окисления
- 7. Простые вещества
- 8. Распространение в природе и важнейшие минералы 4. Fe – 4,65% 22. Ni – 0,015% 30. Co
- 9. Халькогениды Пирротин Fe0,877S Пирит FeS2 Смальтин (Ni,Co,Fe)As2 Кобальтин CoAsS Арсенопирит NiAsS Никелин NiAs Хлоантит (Co,Ni)As2 Пентландит
- 10. Семейство железа: Fe, Co и Ni Простые в-ва: пирофорность высокодисперсн. порошков, получаемых по р-ции (способность твёрдого
- 11. Химические свойства Fe, Co и Ni Взаимодействие с O2: Fe + O2 (150 °C) → «Fe3O4»
- 12. Семейство железа : Fe [Ar] 4 s2 3d6 Co [Ar] 4 s2 3d7 Ni [Ar] 4
- 13. Железо один из наиболее распространенных элементов в земной коре (4,65%). Встречается в виде скоплений железных руд,
- 14. Железо входит в состав следующих минералов: Fe2 O3 Fe2 O3 · H2O Fe3 O4 Fe CO3
- 15. Fe(II) может образовывать комплексные соединения. Координационное число для Fe (II) = 6. При растворении в воде
- 16. Наиболее широко применяется K4 [Fe(CN)6 ] · 3H2O – желтая кровяная соль. Она служит реактивом для
- 17. Соли Fe(II) – восстановители. 10 Fe S O4 +2KMnO4 + 8 H2SO4→ 5Fe2 (S O4 )3
- 18. Соединения Fe (III) Fe2O3 - красно-бурый порошок, нерастворимый в воде, входит в состав краски охры, амфотерный.
- 19. Fe(OH)3 – очень слабое основание, обладает аморфными свойствами. Доказать аморфные свойства Fe(OH)3 можно: Fe(OH)3 + 3HCl
- 20. Соли Fe(III) гидролизируются сильнее, чем соли Fe (II), при этом окраска растворов становится желто-коричневой. Например, гидролиз
- 21. Соединения Fe (VI) Для соединений Fe (VI) известна H2FeO4 – железная кислота, но она не может
- 22. Ферраты, кристаллические вещества, имеют окраску от пурпурно-красной до фиолетовой, при нагревании разлагаются. Ферраты – сильные окислители,
- 23. КОБАЛЬТ
- 24. Был получен в 1735 году шведским химиком Брандтом. В природе чисто кобальтовые руды встречаются редко. Распространенным
- 25. Соединения кобальта (II) CoO (II) – серо-зеленые кристаллы. Получают термическим разложением CoCO3 → CoO + CO2
- 26. При действии соли Co2+ и избытка NH4OH в присутствии NH4Cl образуются : [Co(NH3)6]2+ → [Co(NH3)6]3+ легко
- 27. Аквакомплексы [Co(H2O)6]2+ розового цвета. Эта же окраска характерна для кристаллогидратов CoCl2∙6 H2O, CoSO4∙6 H2O, но безводная
- 28. Соединения кобальта(III) Известно ограниченное число простых соединений Co3+. Они не устойчивы, обладают окислительными свойствами и легко
- 29. Амфотерные свойства Co(OH)3 выражены гораздо слабее, чем у Fe(OH)3. При действии на Co(OH)3 кислород содержащих кислот,
- 30. Для Co3+ характерны многочисленные комплексные соединения: [Co(H2O)6]Cl3 – катионные Na3[Co(NO2)6] – анионные [Co(NH3)3(NO2)3] – нейтральные Строение:
- 31. sp3d2 – гибридизация, если лигандом является H2O, то образуется внешнеорбитальный высокоспиновый комплекс. d2sp3 – гибридизация, если
- 32. Например: гидратная [Co(NH3)4 Cl2] Cl ∙ H2O – розовый [Co(NH3)4 Cl∙ H2O] Cl2 – коричневый ионизационная
- 33. НИКЕЛЬ
- 34. Впервые был получен в 1751г. Кронштадтом. Никель довольно распространен на земле. Содержится обычно в сульфидных медно-никелевых
- 35. Соединения Ni (II) NiO (II) – оксид, зеленые кристаллы, нерастворимые в воде, образуются при термическом разложении
- 36. Из катионных комплексов Ni2+ устойчивы октаэдрические аква и аминокомплексы. Аквакомплекс [Ni(H2O)6]2+ имеет ярко-зеленую окраску, образуется при
- 37. Соединения Ni (III) Ni(OH)2 зеленого цвета, проявляет основные свойства, не окисляется кислородом воздуха, поэтому получить Ni(OH)3
- 39. Скачать презентацию



![Общая электронная формула: […] ns 0÷2 (n–1)d 6÷10](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-4.jpg)





![Семейство железа : Fe [Ar] 4 s2 3d6 Co [Ar] 4 s2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-11.jpg)



![Наиболее широко применяется K4 [Fe(CN)6 ] · 3H2O – желтая кровяная соль.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-15.jpg)










![Аквакомплексы [Co(H2O)6]2+ розового цвета. Эта же окраска характерна для кристаллогидратов CoCl2∙6 H2O,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-26.jpg)


![Для Co3+ характерны многочисленные комплексные соединения: [Co(H2O)6]Cl3 – катионные Na3[Co(NO2)6] – анионные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-29.jpg)

![Например: гидратная [Co(NH3)4 Cl2] Cl ∙ H2O – розовый [Co(NH3)4 Cl∙ H2O]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-31.jpg)



![Из катионных комплексов Ni2+ устойчивы октаэдрические аква и аминокомплексы. Аквакомплекс [Ni(H2O)6]2+ имеет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/837017/slide-35.jpg)

 Алкадиены
Алкадиены Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Расчет по химическим уравнениям
Расчет по химическим уравнениям Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Химия жиров (липидов)
Химия жиров (липидов) Основи масообміну
Основи масообміну География. Уральские самоцветы
География. Уральские самоцветы Общие химические свойства неметаллов
Общие химические свойства неметаллов Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Химическая лаборатория
Химическая лаборатория Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Карбоновые кислоты
Карбоновые кислоты Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Химическая коррозия
Химическая коррозия Общие способы получения металлов
Общие способы получения металлов 11 типы связей
11 типы связей Соединения азота
Соединения азота Биохимия крови
Биохимия крови Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача
Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача Гидролиз солей
Гидролиз солей Самородные металлы
Самородные металлы Презентация на тему Алканы
Презентация на тему Алканы