Содержание
- 2. СОДЕРЖАНИЕ Ведение 1. Общая характеристика белковых молекул 1.1. Элементный состав белков 1.2. Аминокислотный состав белков 1.2.1.
- 3. 3.Физико-химические свойства белков 3.1. Общие свойства 3.2. Электрические свойства белковых молекул 3.3. Растворимость белков 3.4. Денатурация
- 4. Условные обозначения Глицин Гиперссылка Глоссарий Шаг назад Шаг вперед К содержанию Видеофрагмент - - - -
- 5. Ведение Белки или протеины (от греч. protos–первый, важнейший) – это высокомолекулярные азотсодержащие органические вещества, линейные гетерополимеры,
- 6. Кроме понятия «белок», в химии встречается термины «пептид» и «полипептид». Пептидом обычно называют олигомер, состоящий не
- 7. Совокупность белковых молекул имеющихся в организме называется протеомом. Термин "протеом" предложил в 1994 году австралийский исследователь
- 8. Основные химические элементы, входящие в состав белков С(углерод) – 50-55% O(кислород) – 21-23% H(водород) – 6,5-7,3%
- 9. 1.2. Аминокислотный состав белков Белки построены в основном двадцатью стандартными (основными, природными, белковыми, кодируемыми) α -
- 10. Аминокислоты входящие в состав белка являются α-аминокислотами и представляют собой производные карбоновых кислот, у которых один
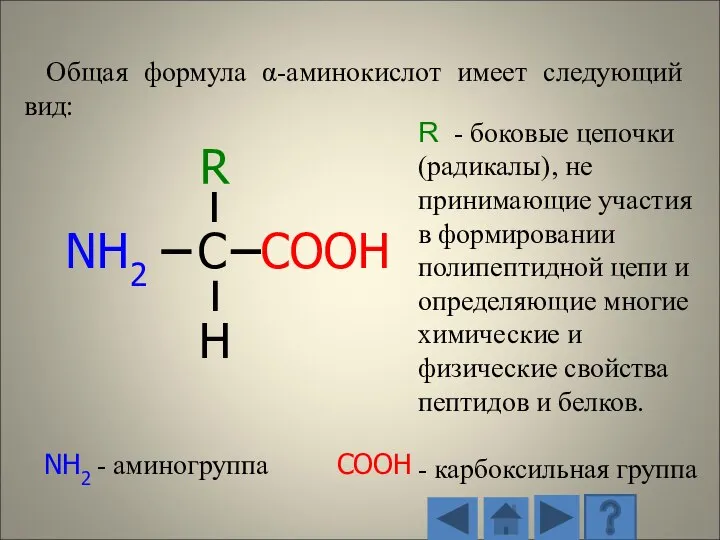
- 11. Общая формула α-аминокислот имеет следующий вид: R - боковые цепочки (радикалы), не принимающие участия в формировании
- 12. Природные аминокислоты имеют тривиальные названия, которые происходят иногда от источника из которого аминокислота была выделена. Например,
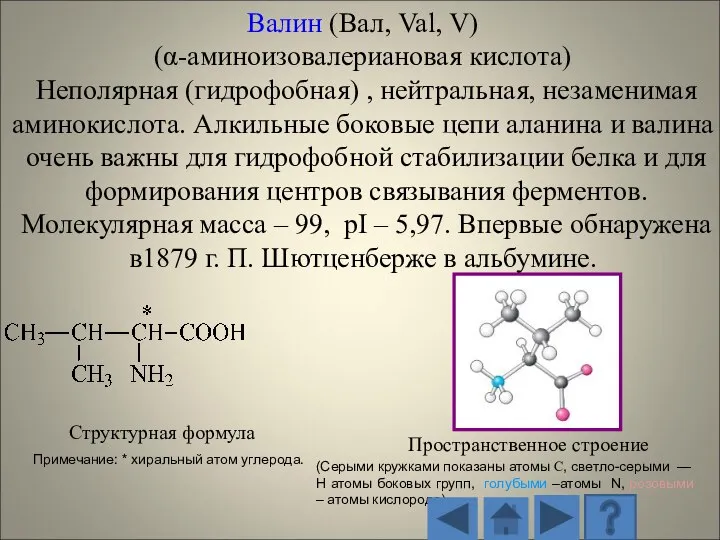
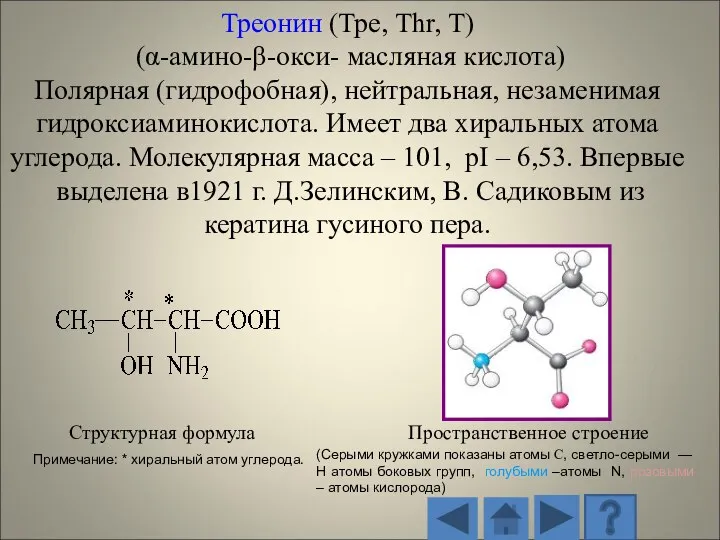
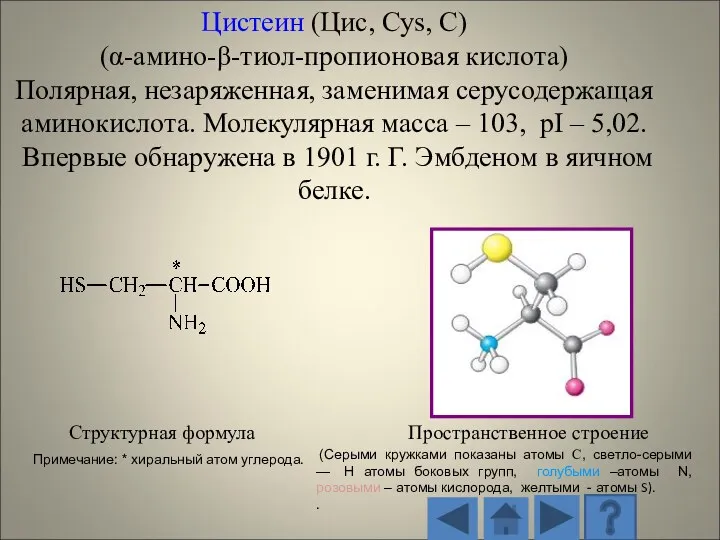
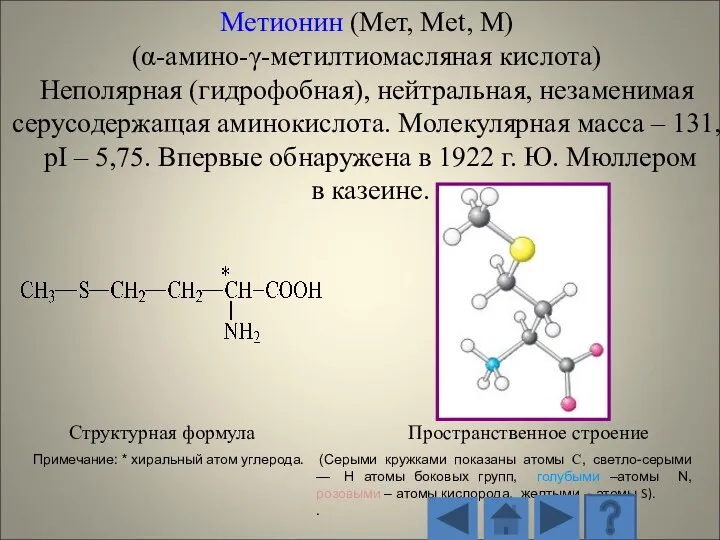
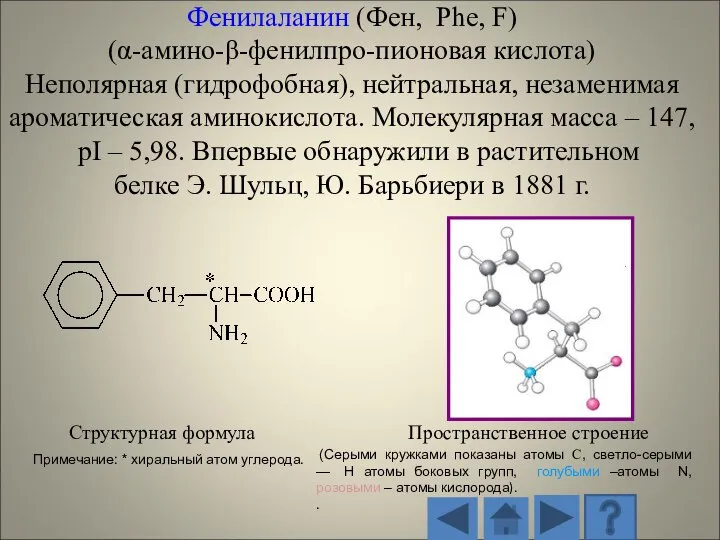
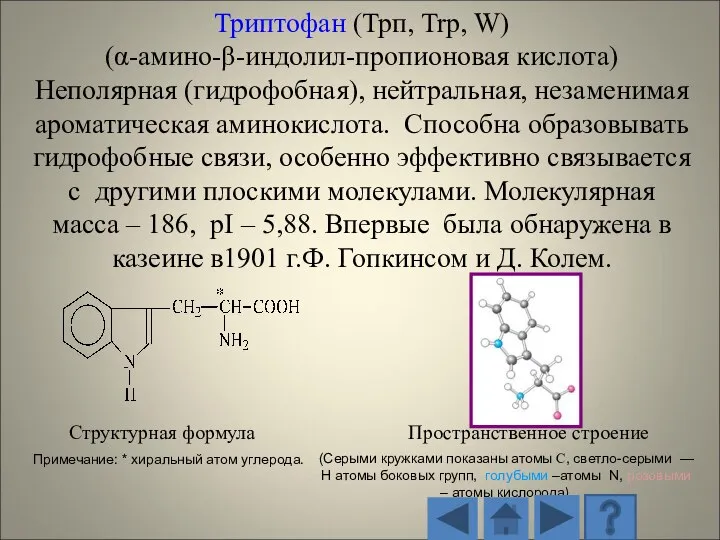
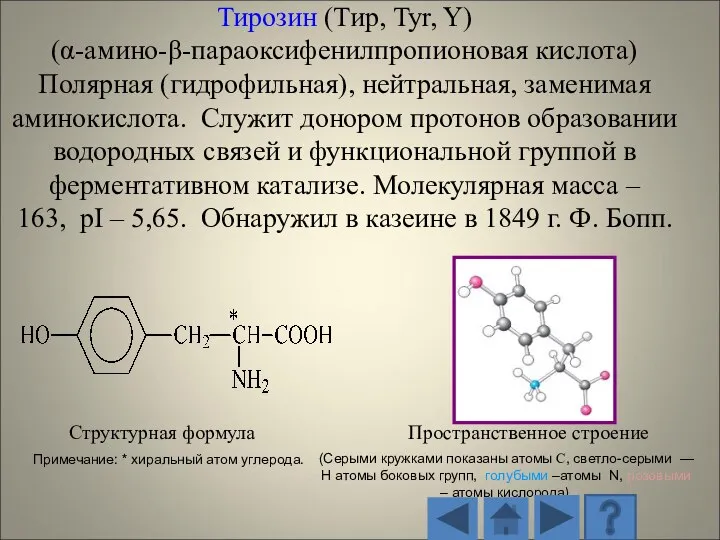
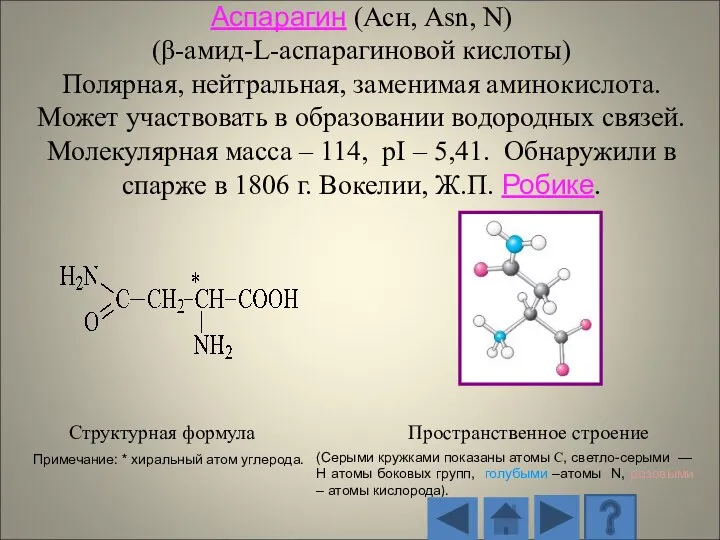
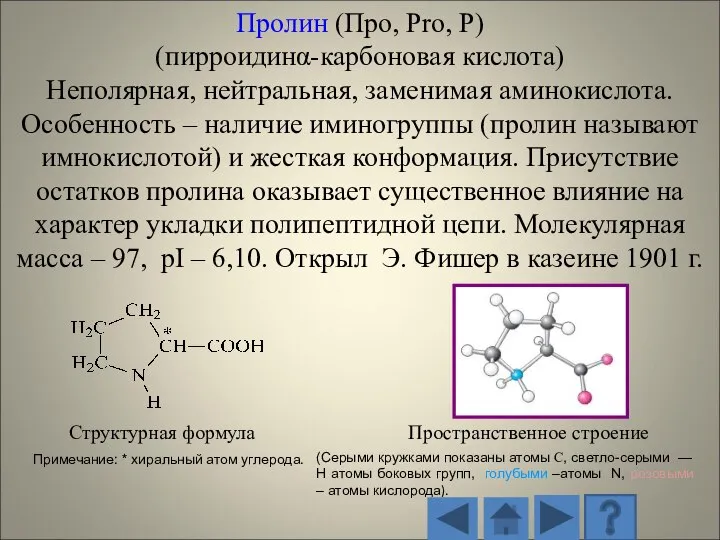
- 13. 1.2.1. Характеристика стандартных аминокислот Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H
- 14. Структурная формула Пространственное строение радикала (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп,
- 15. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 16. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 17. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 18. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 19. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 20. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 21. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 22. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 23. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 24. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 25. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 26. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 27. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 28. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 29. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 30. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 31. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
- 32. Структурная формула Пространственное строение (Серыми кружками показаны атомы С, светло-серыми — H атомы боковых групп, голубыми
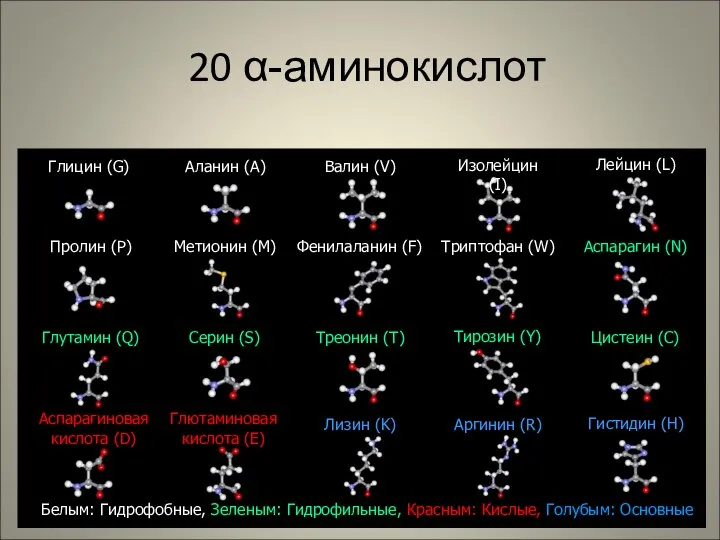
- 33. 20 α-аминокислот Глицин (G) Глютаминовая кислота (E) Аспарагиновая кислота (D) Метионин (M) Треонин (T) Серин (S)
- 34. Важным свойством аминокислот является оптическая изомерия. Это свойство связано с наличием в молекуле всех природных аминокислот,
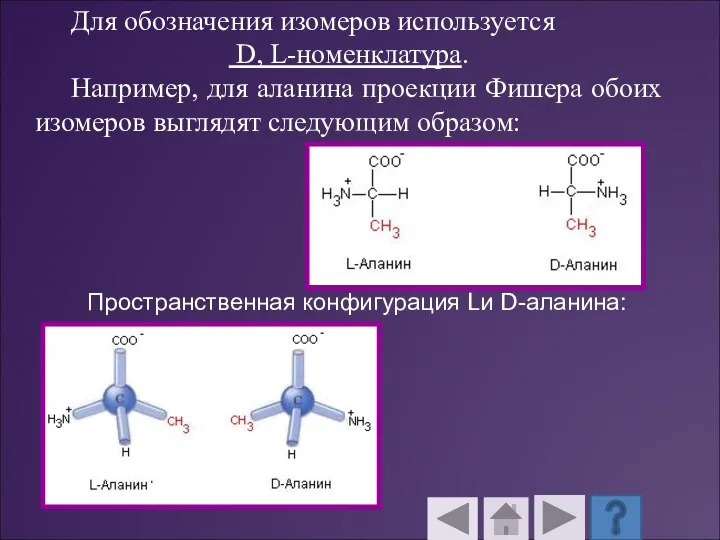
- 35. Для обозначения изомеров используется D, L-номенклатура. Например, для аланина проекции Фишера обоих изомеров выглядят следующим образом:
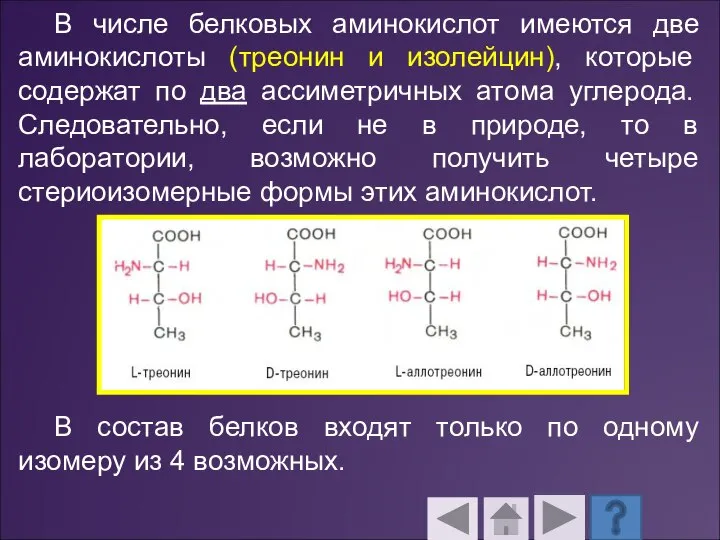
- 36. В числе белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два ассиметричных атома
- 37. L - и D-изомеры могут взаимно превращаться друг в друга. Этот процесс называется рацемизацией. Все аминокислоты,
- 38. В белке зубов – дентине – L-аспарагиновая кислота самопроизвольно рацемизуется при температуре человеческого тела со скорость
- 39. 1.2.3. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Физические свойства Аминокислоты представляют собой кристаллические вещества с высокими (выше 250С0) температурами
- 40. Химические свойства Аминокислоты содержат амино- и карбоксильную группы. В силу этого они проявляют амфотерные свойства, то
- 41. Химические свойства При растворении аминокислоты в воде, например, глицина, его карбоксильная группа диссоциирует с образованием иона
- 42. Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион
- 43. Кислотно-основные свойства В кислой среде аминокислота, присоединяя ион водорода, образует катион: В щелочной среде образуется анион:
- 44. Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов
- 45. Для α-аминокислот характерны следующие химические реакции: реакции по карбоксильной группе; реакции по аминогруппе; биологически важные реакции.
- 46. 1.2.4.Классификация α-аминокислот В зависимости от подхода можно выделить следующие типы классификаций аминокислот:
- 47. Химическая классификация В соответствии с химической структурой радикала аминокислоты делят на алифатические, ароматические, а также аминокислоты,
- 48. Алифатические Моноаминомонокарбоновые: аланин, валин, глицин, изолейцин, лейцин. Оксимоноаминокарбоновые: серин, треонин. Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота, за
- 49. Ароматические: фенилаланин, тирозин - Гетероциклические: триптофан, гистидин, пролин (также входит в группу иминокислот) - Иминокислоты: пролин
- 50. Физико-химическая классификация основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических
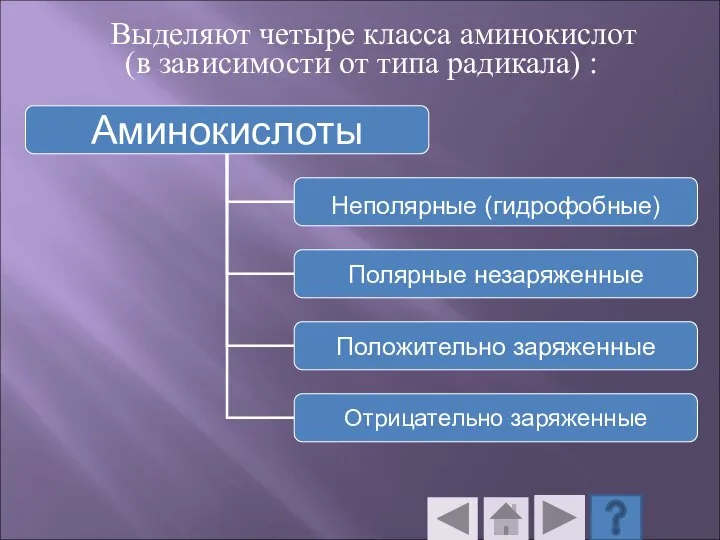
- 51. Выделяют четыре класса аминокислот (в зависимости от типа радикала) :
- 52. К неполярным (гидрофобным) относятся аминокислоты с неполярными алифатическими (аланин, валин, лейцин, изолейцин) или ароматическими (фенилаланин и
- 53. Полярные незаряженные аминокислоты в сравнении с неполярными лучше растворяются в воде, более гидрофильны, так как их
- 54. К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин, в ионизированном виде они имеют суммарный положительный
- 55. К отрицательно заряженным аминокислотам относятся аспарагиновая и глутаминовая кислоты. Они содержат по две карбоксильные и по
- 56. Биологическая классификация основана на способности аминокислот, принимающие участие в построении белков человеческого тела, синтезироваться в нашем
- 57. Заменимые аминокислоты могут синтезироваться в организме человека (их 10). Незаменимые аминокислоты, их еще называют "эссенциальные» не
- 59. Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
- 60. C 1981 г. в США разрешено использование низкокалорийной добавки для придания продуктам сладкого вкуса - аспартама.
- 61. Аргинин содержится в твороге, морепродуктах,грецких орехах,шоколаде. Валин содержится в зерновых, мясе, грибах, арахисе, сое Гистидин содержится
- 62. Интересно знать! Исключительно важную роль играет сбалансированность питания человека по аминокислотам. При недостатке незаменимых аминокислот в
- 63. 1.2.5. Производные аминокислот Нестанда́ртные аминокисло́ты — аминокислоты, которые, хотя и не входят в список встречающихся во
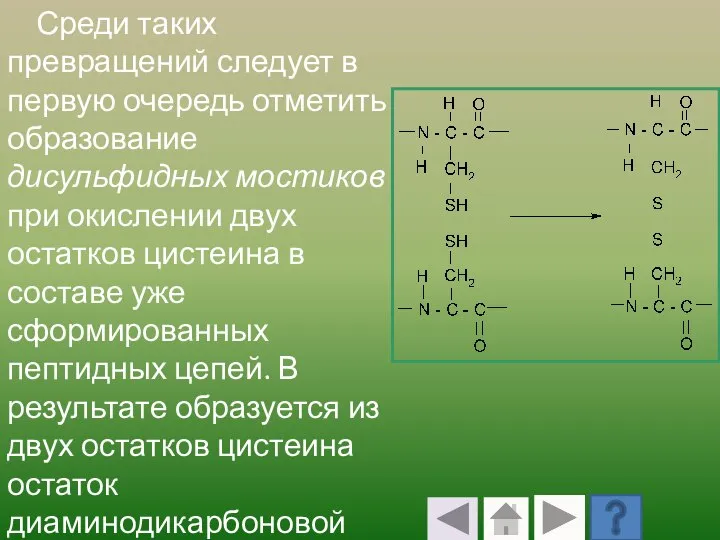
- 64. Среди таких превращений следует в первую очередь отметить образование дисульфидных мостиков при окислении двух остатков цистеина
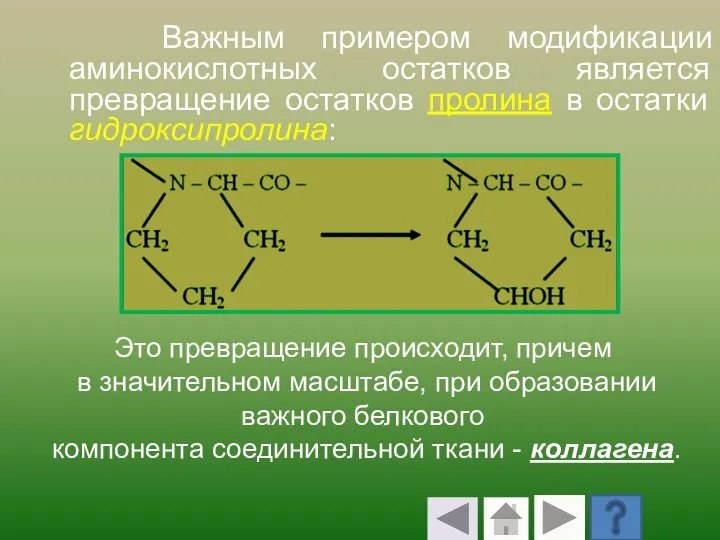
- 65. Важным примером модификации аминокислотных остатков является превращение остатков пролина в остатки гидроксипролина: Это превращение происходит, причем
- 66. Еще одним весьма важным видом модификации белков является фосфорилирование гидроксогрупп остатков серина, треонина и тирозина, например:
- 67. По составу белковой молекулы 1.3. Простые и сложные белки
- 68. Простые белки Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Альбумины
- 69. Альбумины (от лат. albumen, род. падеж albuminis - белок) - водорастворимые глобулярные белки, входящие в состав
- 70. Сывороточный альбумин составляет примерно 60% от общего количества белков плазмы крови. Молекулярный вес его - 69
- 71. Глобулины — слаборастворимые в воде белки, растворимы в разбавленных растворах солей, входят в состав растительных и
- 72. Гистоны белки, обладающие щелочными свойствами и входящие в состав комплексов с ДНК (хроматин, нуклеосомы) в ядрах
- 73. Сложные белки содержат небелковый компонент — простетическую группу. В зависимости от химической природы простетической группы протеиды
- 74. Металлопротеины белки, в составе которых имеются ионы металлов (медь, железо, цинк, молибден, марганец и др.). Строение
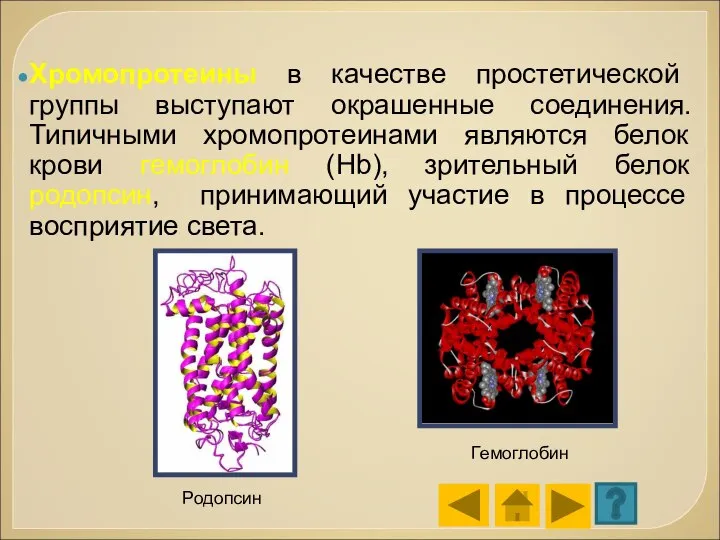
- 75. Хромопротеины в качестве простетической группы выступают окрашенные соединения. Типичными хромопротеинами являются белок крови гемоглобин (Hb), зрительный
- 76. Фосфопротены в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью.
- 77. Фосфопротены могут терять фосфатную группу (дефосфорилирование), могут при определенных условиях быть снова фосфорилированы. Одни белки проявляют
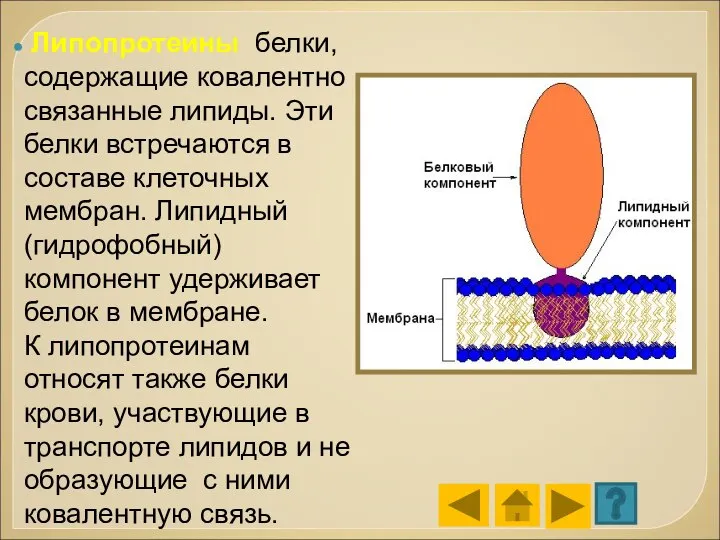
- 78. Липопротеины белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент
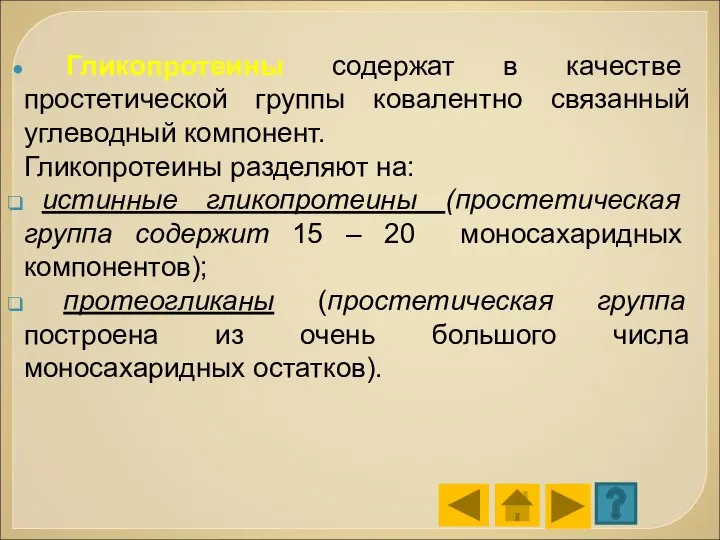
- 79. Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на: истинные гликопротеины (простетическая
- 81. Гликопротеины широко распространены в природе. Они входят в состав клеточных мембран, клеточных стенок, соединительной ткани, встречаются
- 82. Нуклеопротеины - состоят из белков и нуклеиновых кислот, крайние рассматриваются как простетические группы. ДНП-дезоксирибонуклеопротеиды. РНП-рибонуклеопротеиды. ДНП
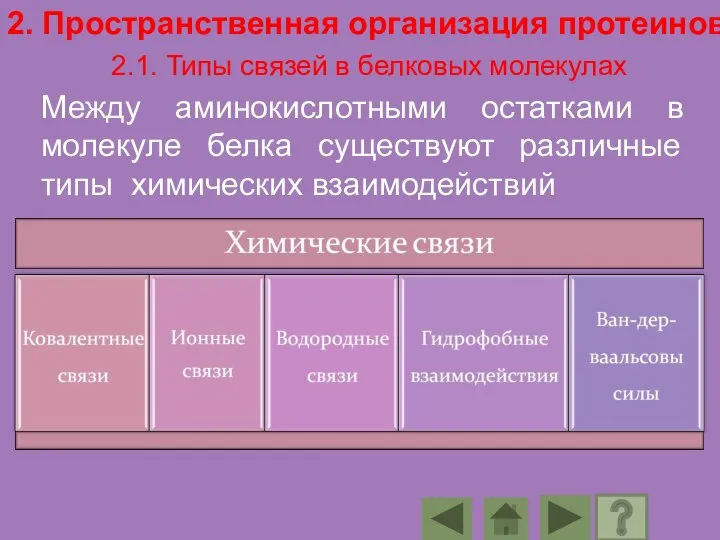
- 83. 2. Пространственная организация протеинов 2.1. Типы связей в белковых молекулах Между аминокислотными остатками в молекуле белка
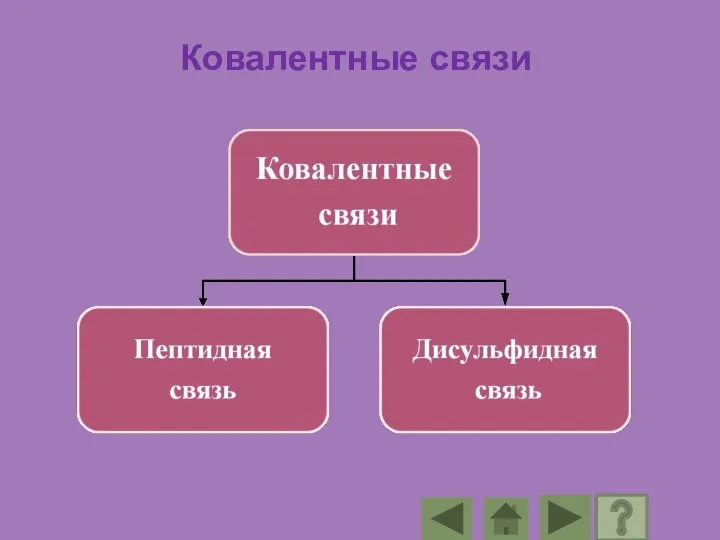
- 84. Ковалентные связи
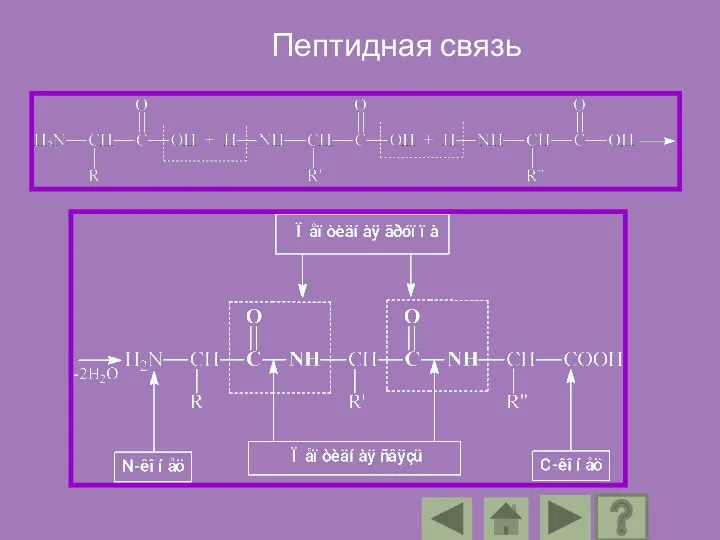
- 85. По своей природе пептидная связь является ковалентной. Ее образование происходит за счет α-аминогруппы одной аминокислоты и
- 86. Название пептида образуется из названия аминокислотных остатков пептидной цепи путем замены их окончаний на окончание –ил
- 87. Пептидная связь
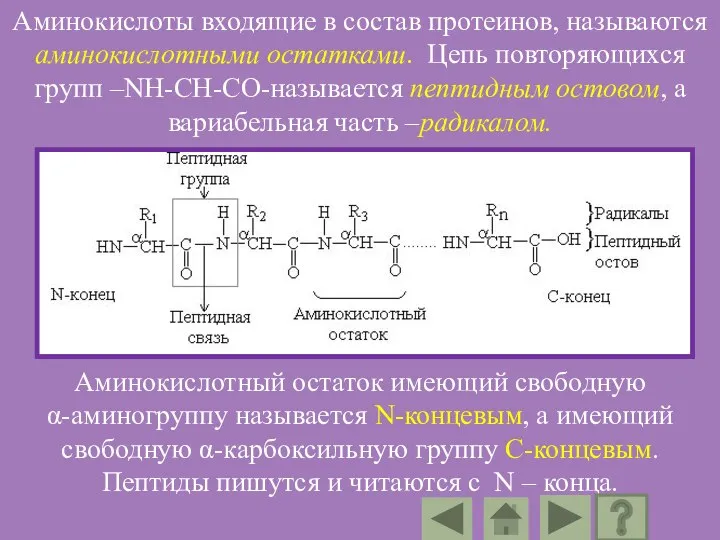
- 88. Аминокислоты входящие в состав протеинов, называются аминокислотными остатками. Цепь повторяющихся групп –NH-CH-CO-называется пептидным остовом, а вариабельная
- 89. В пептидах выделяют особую структуру – пептидную группу. Ее образуют атомы кислорода, углерода, азота и водорода.
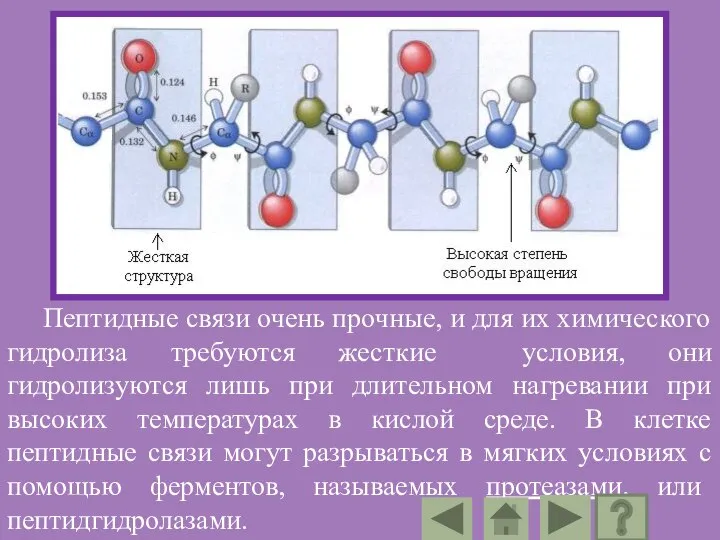
- 90. Свойства пептидной группы: Пептидная группа имеет жесткую планарную структуру, т.е. все атомы, входящие в нее, располагаются
- 91. Пептидные связи очень прочные, и для их химического гидролиза требуются жесткие условия, они гидролизуются лишь при
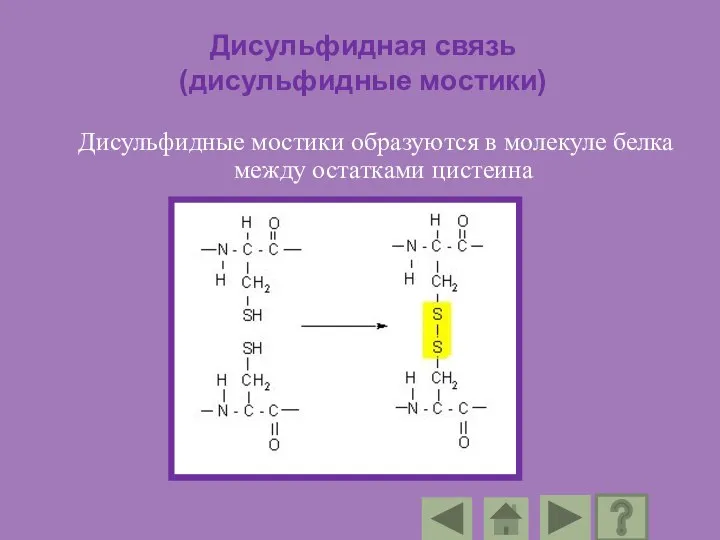
- 92. Дисульфидная связь (дисульфидные мостики) Дисульфидные мостики образуются в молекуле белка между остатками цистеина
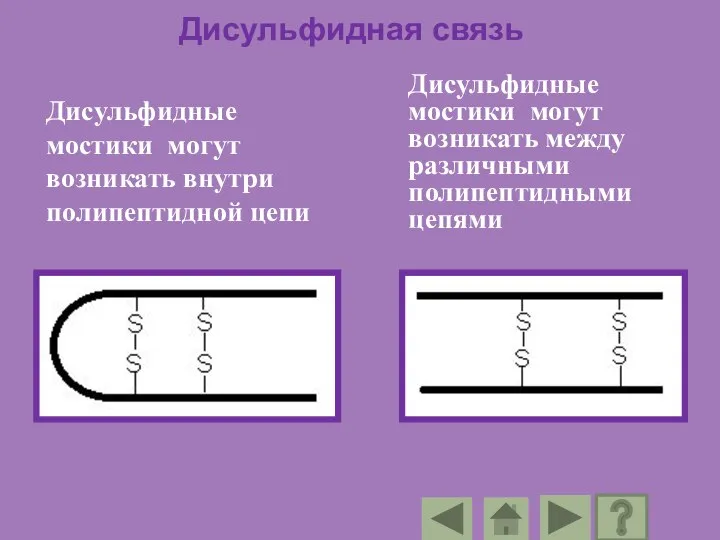
- 93. Дисульфидная связь Дисульфидные мостики могут возникать внутри полипептидной цепи Дисульфидные мостики могут возникать между различными полипептидными
- 94. Интересно знать! С помощью химической завивки волосам можно придать другую форму. Для этого волосы обрабатывают раствором
- 95. Ионные связи Ионные связи возникают между радикалами аминокислотных остатков, имеющих противоположные заряды, например, между положительно заряженной
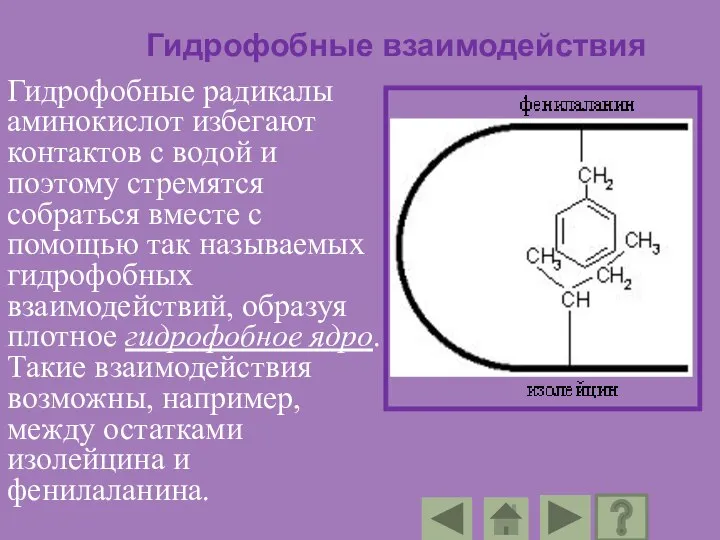
- 96. Гидрофобные взаимодействия Гидрофобные радикалы аминокислот избегают контактов с водой и поэтому стремятся собраться вместе с помощью
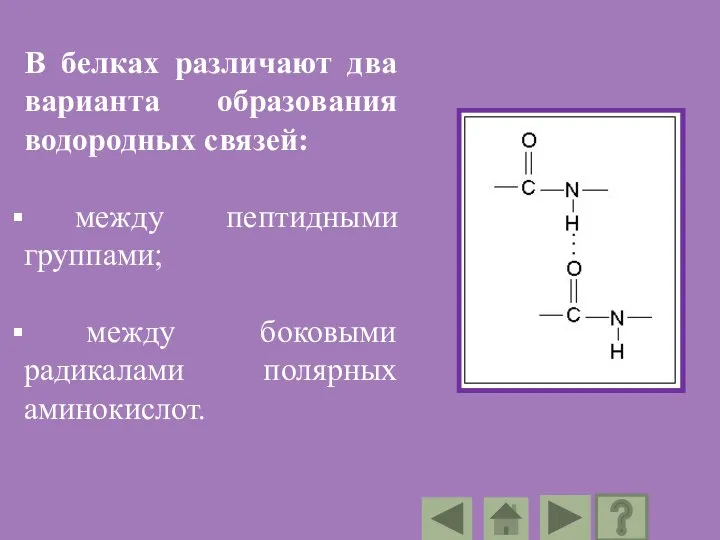
- 97. Водородные связи Водородная связь в молекуле белка образуется между имеющим частично положительный заряд атомом водорода одной
- 98. В белках различают два варианта образования водородных связей: между пептидными группами; между боковыми радикалами полярных аминокислот.
- 99. Ван-дер-ваальсовы силы Ван-дер-ваальсовы силы имеют электростатическую природу. Они возникают между разноименными полюсами диполя. В молекуле белка
- 100. Рассмотренные выше химические связи принимают участие в формировании структуры белковых молекул
- 101. 2.2. Уровни организации белковых молекул
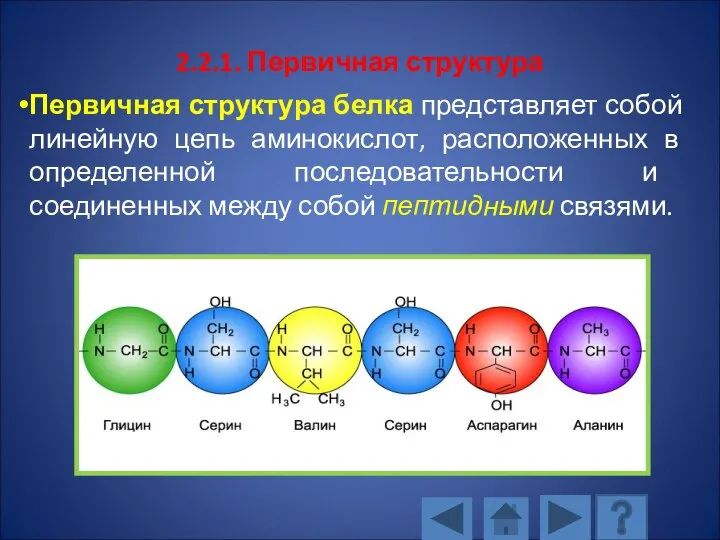
- 102. 2.2.1. Первичная структура Первичная структура белка представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и
- 103. Первичная структура белка характеризуется: аминокислотным составом; последовательностью аминокислотных остатков; количеством аминокислотных остатков.
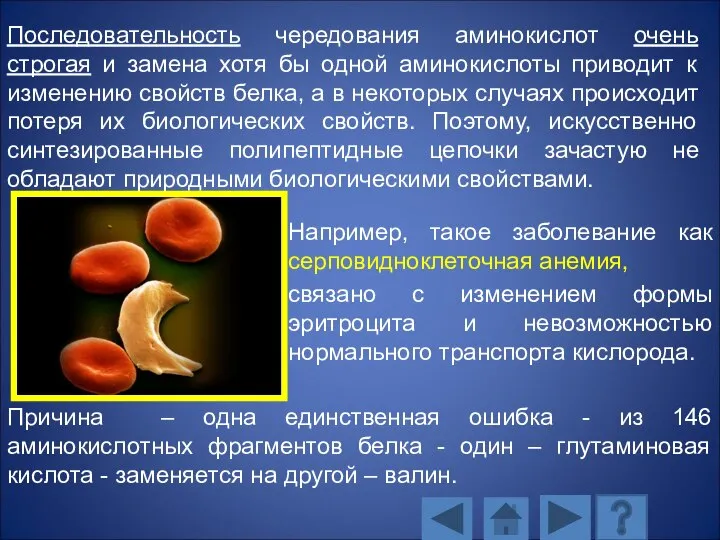
- 104. Например, такое заболевание как серповидноклеточная анемия, связано с изменением формы эритроцита и невозможностью нормального транспорта кислорода.
- 105. Фред Сенгер Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные
- 106. 2.2.2. Вторичная структура Вторичная структура белка образуется в процессе укладки первичной структуры в пространстве в виде
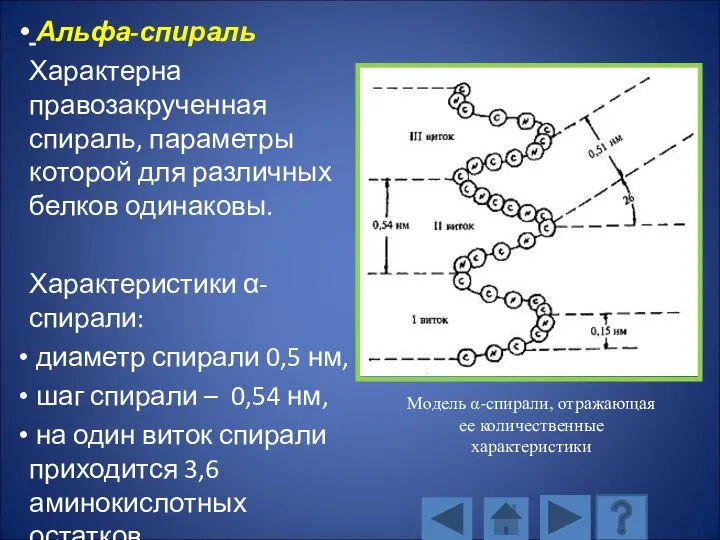
- 107. Альфа-спираль Характерна правозакрученная спираль, параметры которой для различных белков одинаковы. Характеристики α-спирали: диаметр спирали 0,5 нм,
- 108. Альфа-спираль Водородные связи, фиксирующие альфа-спираль расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную
- 109. Некоторые аминокислотные остатки препятствуют образованию α-спирали: Например, если в цепи подряд расположено несколько положительно или отрицательно
- 110. В остатке пролина при атоме азота, образующем пептидную связь с другой аминокислотой, нет атома водорода, поэтому
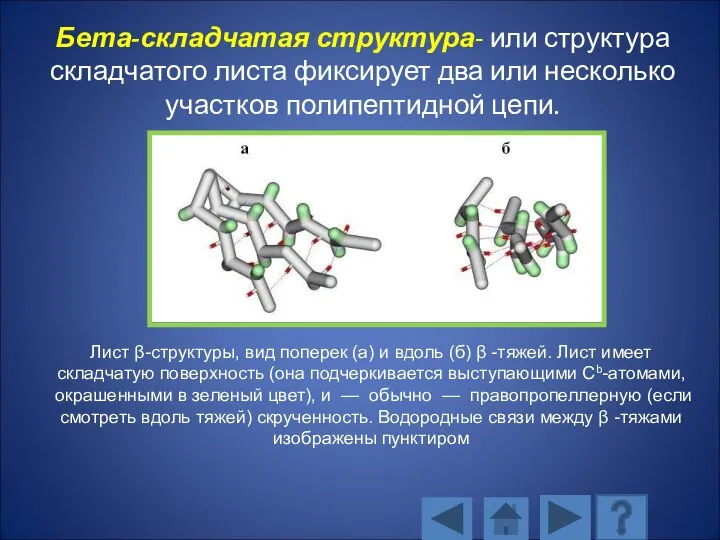
- 111. Бета-складчатая структура- или структура складчатого листа фиксирует два или несколько участков полипептидной цепи. Лист β-структуры, вид
- 112. Цепи могут быть параллельны или антипараллельны.
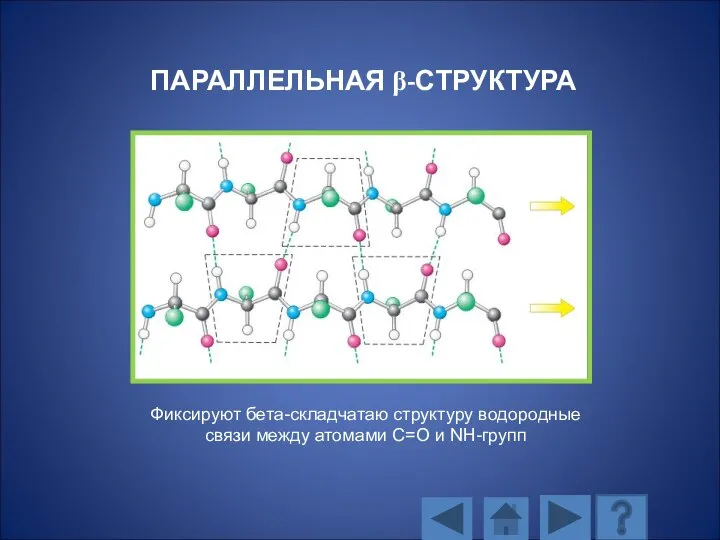
- 113. ПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА Фиксируют бета-складчатаю структуру водородные связи между атомами С=О и NH-групп
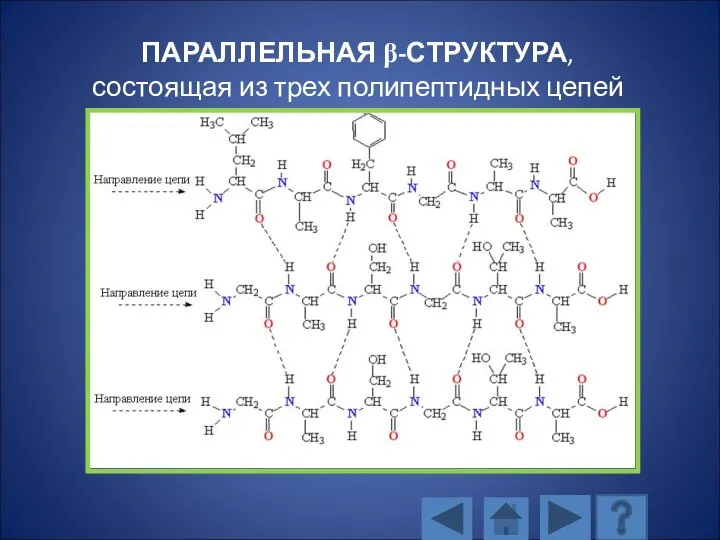
- 114. ПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных цепей
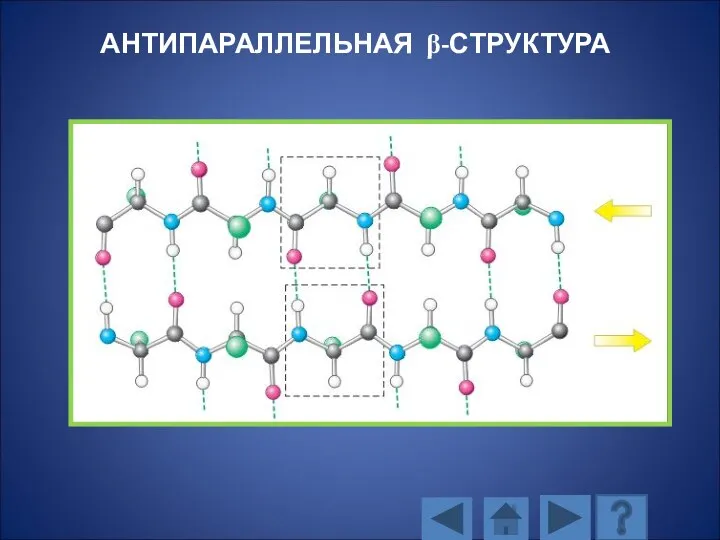
- 115. АНТИПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА
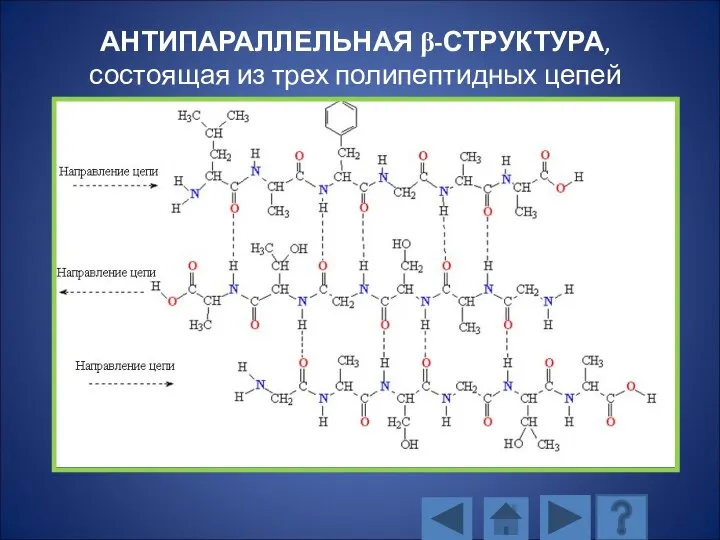
- 116. АНТИПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных цепей
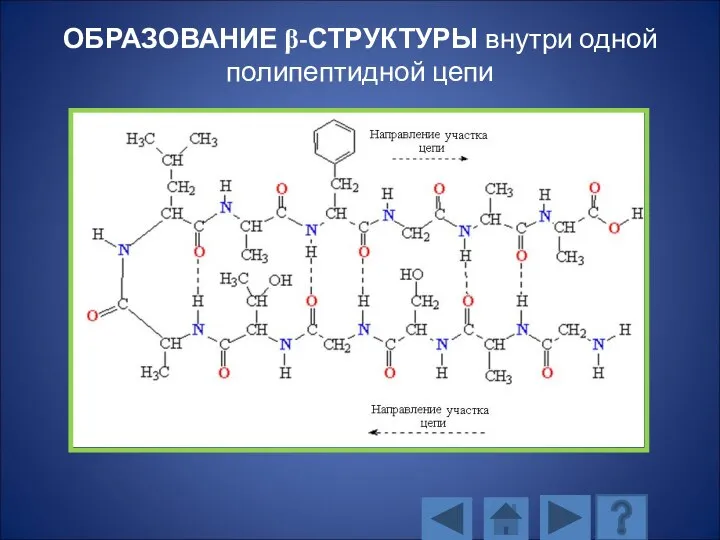
- 117. ОБРАЗОВАНИЕ β-СТРУКТУРЫ внутри одной полипептидной цепи
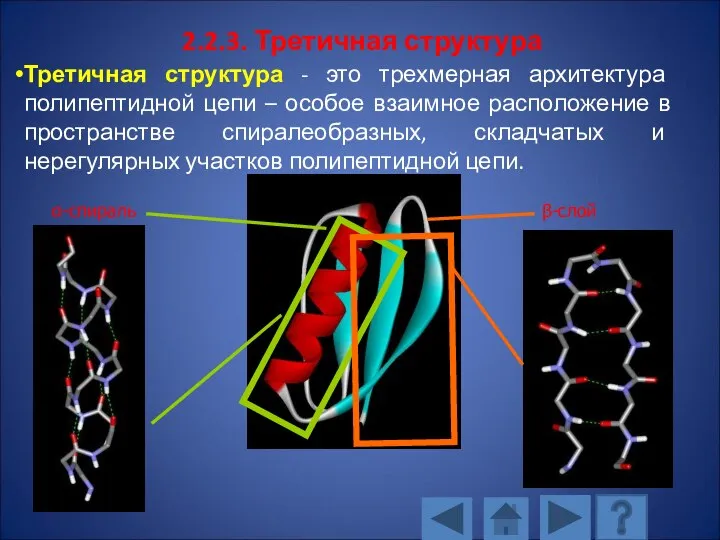
- 118. 2.2.3. Третичная структура Третичная структура - это трехмерная архитектура полипептидной цепи – особое взаимное расположение в
- 119. У разных белков третичной структуры различна. В формировании третичной структуры участвуют дисульфидные связи и все слабые
- 120. В фибриллярных белках (например, коллаген, эластин) молекулы имеют вытянутую форму и обычно формируют волокнистые структуры тканей.
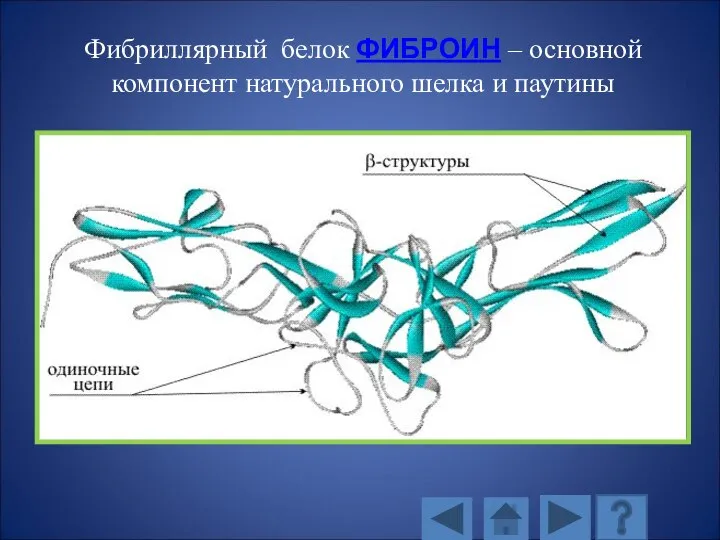
- 121. Фибриллярный белок ФИБРОИН – основной компонент натурального шелка и паутины
- 122. В организме млекопитающих коллаген —составляет 25% общего белка. Этот белок имеет необычный аминокислотный состав: -1/З составляет
- 123. В глобулярных белках молекулы имеют форму шара или эллипса. Обычно гидрофобные участки находятся в глубине молекулы,
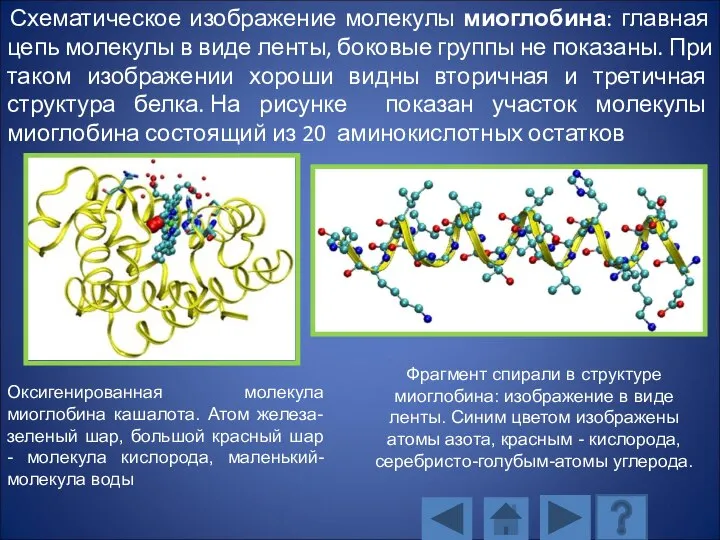
- 124. Миоглобин – кислород-связывающий белок. Молекула состоит из одной полипептидной цепи, состоящей из 153 аминокислотных остатков, и
- 125. Схематическое изображение молекулы миоглобина: главная цепь молекулы в виде ленты, боковые группы не показаны. При таком
- 126. Можем ли мы определить трехмерную форму белка по его аминокислотной последовательности? Сейчас это пока невозможно. Предопределение
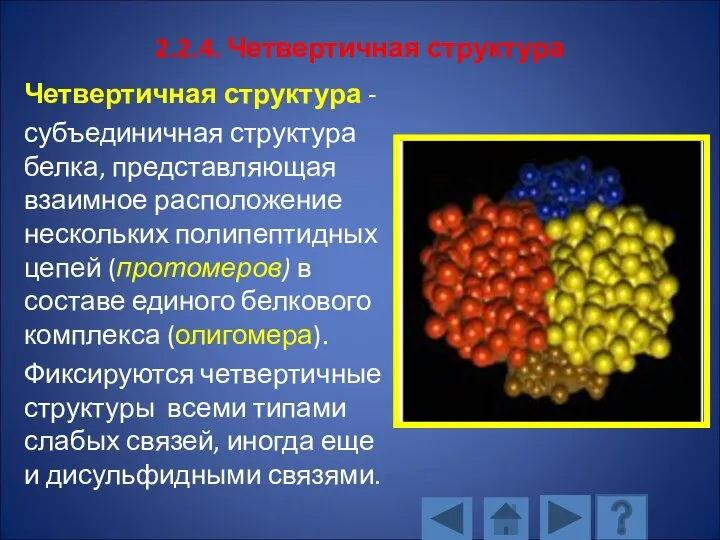
- 127. 2.2.4. Четвертичная структура Четвертичная структура - субъединичная структура белка, представляющая взаимное расположение нескольких полипептидных цепей (протомеров)
- 128. Число протомеров может варьировать в широких пределах. Чаще в молекуле олигомерного белка содержится 2 или 4
- 129. Молекула гемоглобина состоит из гема и четырех полипептидных цепей двух различных типов – двух α-цепей и
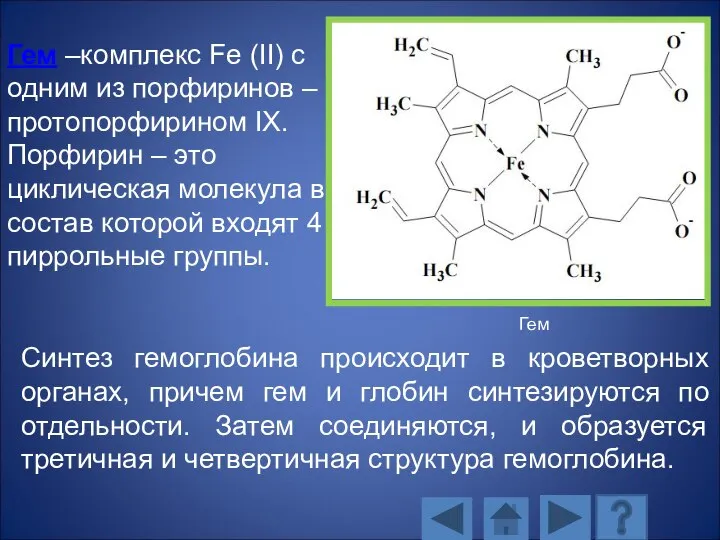
- 130. Гем –комплекс Fe (II) с одним из порфиринов – протопорфирином IX. Порфирин – это циклическая молекула
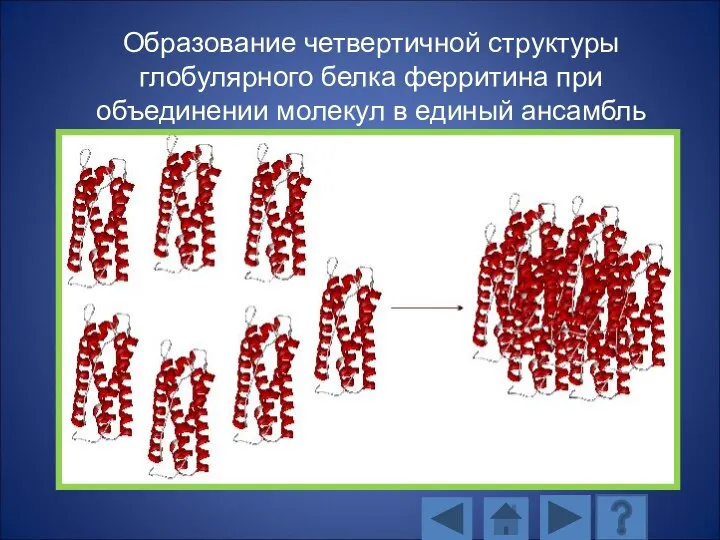
- 131. Образование четвертичной структуры глобулярного белка ферритина при объединении молекул в единый ансамбль
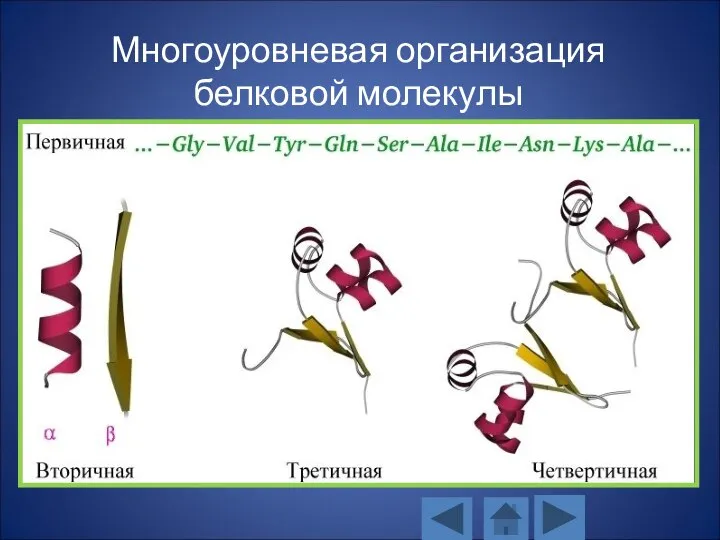
- 132. Многоуровневая организация белковой молекулы Первичная структура (Последовательность (цепочка) аминокислот) Вторичная структура (α-спираль, β-слой) Третичная структура (Трехмерная
- 133. Многоуровневая организация белковой молекулы
- 134. 2.3. Фолдинг Правильное сворачивание ( фолдинг ) полипептидных цепей некоторых белков в клетках эукариот обеспечивается специфическими
- 135. Шапероны обеспечивают: укладку новосинтезированные белков после выхода с рибосом в стабильную трехмерную структуру, укладку мультибелковых комплексов,
- 136. 3.1. Общие свойства Характерными физическими свойствами белков являются: высокая вязкость растворов, способность к набуханию, оптическая активность,
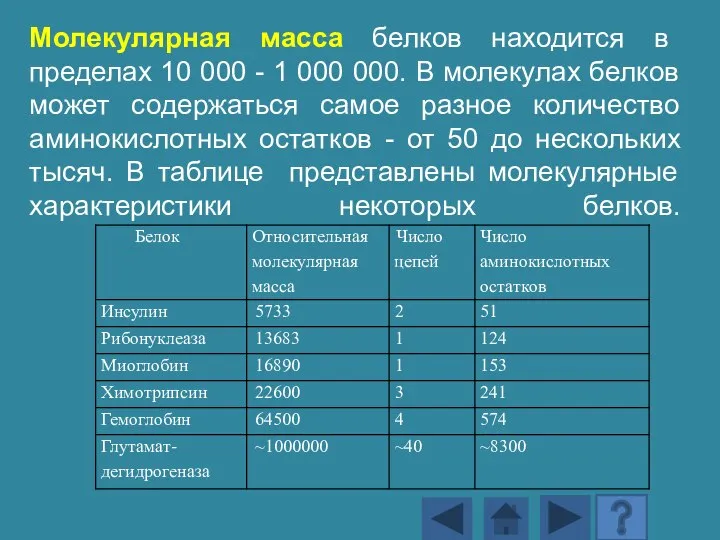
- 137. Молекулярная масса белков находится в пределах 10 000 - 1 000 000. В молекулах белков может
- 138. Сложность состава и высочайшую молекулярную массу белков можно подтвердить даже этой малой информацией:
- 139. НАТИВНОСТЬ - это уникальный комплекс физических, физико-химических, химических и биологических свойств белковой молекулы, который принадлежит ей,
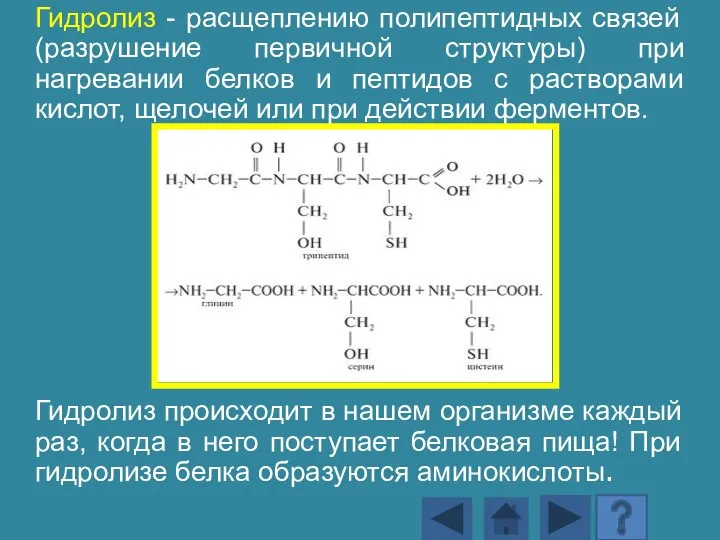
- 140. Гидролиз - расщеплению полипептидных связей (разрушение первичной структуры) при нагревании белков и пептидов с растворами кислот,
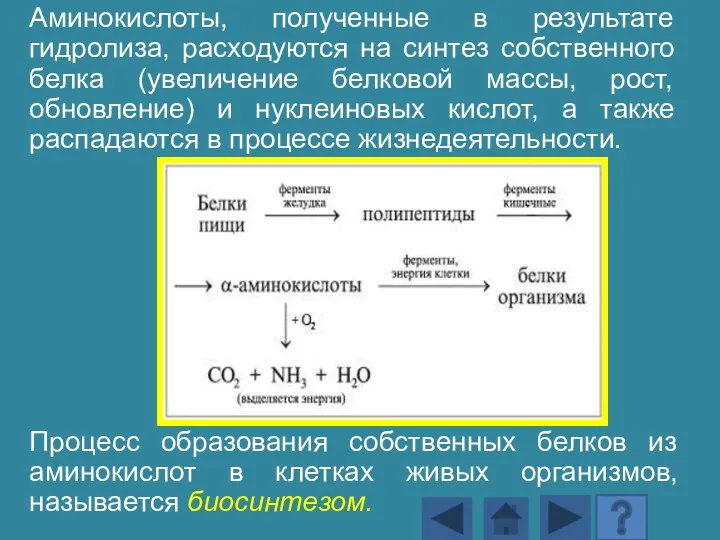
- 141. Аминокислоты, полученные в результате гидролиза, расходуются на синтез собственного белка (увеличение белковой массы, рост, обновление) и
- 142. 3.2.Электрические свойства белковых молекул Определяются присутствием на поверхности молекул белка положительно и отрицательно заряженных аминокислотных остатков.
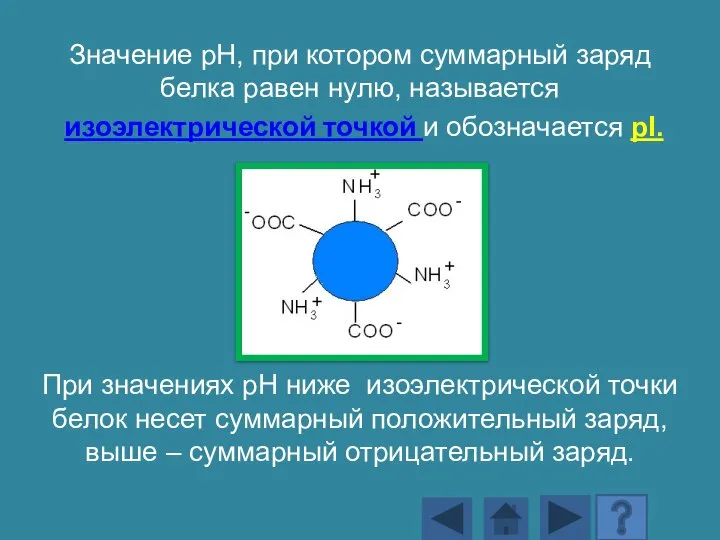
- 143. Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI. При
- 144. Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Ниже приведены изоэлектрические
- 145. В изоэлектрической точке растворимость белка минимальна, так как его молекулы в таком состоянии электронейтральны и между
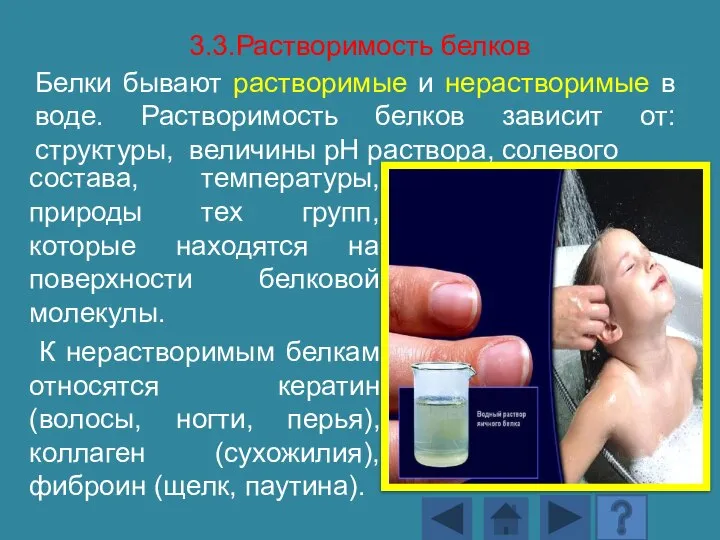
- 146. 3.3.Растворимость белков Белки бывают растворимые и нерастворимые в воде. Растворимость белков зависит от: структуры, величины рН
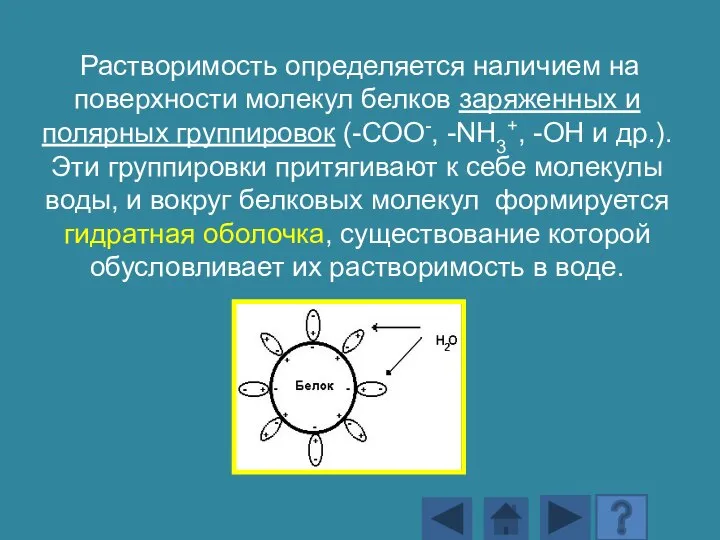
- 147. Растворимость определяется наличием на поверхности молекул белков заряженных и полярных группировок (-СОО-, -NH3+, -OH и др.).
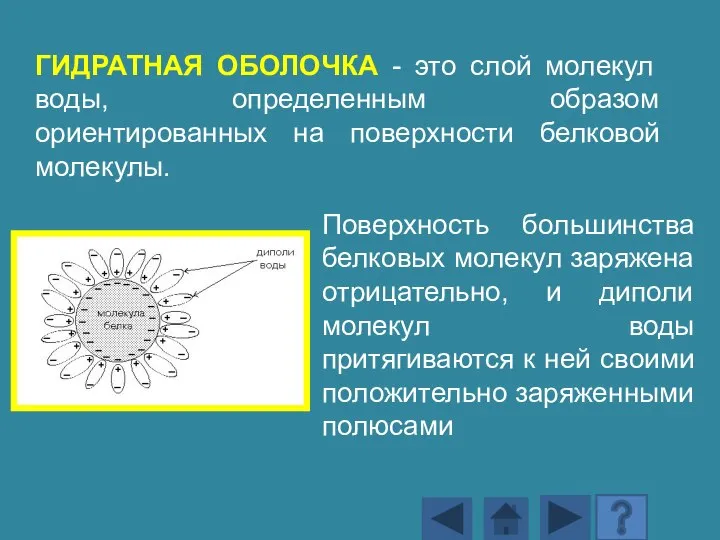
- 148. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными
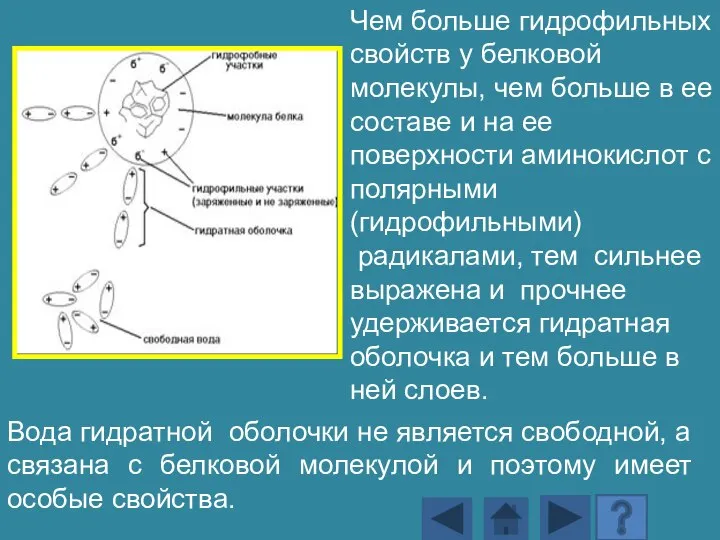
- 149. Чем больше гидрофильных свойств у белковой молекулы, чем больше в ее составе и на ее поверхности
- 150. Реакции осаждения делят на два вида. Обратимое осаждение белков предполагает выпадение белка в осадок под действием
- 151. Обратимое осаждение белков Для данного типа осаждения белков употребляют соли щелочных и щелочноземельных металлов (более часто
- 152. Осаждения с потерей нативных свойств белка - процесс необратимый. С белка снимается гидратная оболочка и заряд,
- 153. При кипячении белок выпадает в осадок. При нагревании до высоких температур усиливается тепловое движение молекул, ослабляются
- 154. Соли тяжелых металлов образуют соединения с SH-группами белков. Ядовиты для человека и животных. В медицинской практике
- 155. Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки
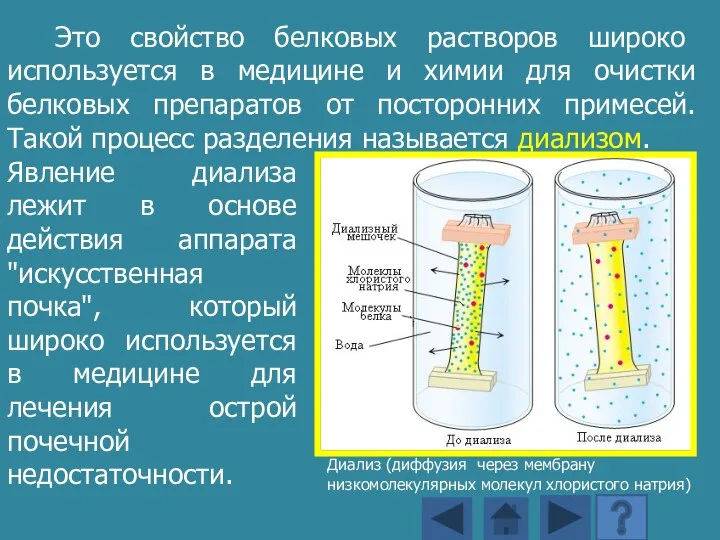
- 156. Водорастворимые белки образуют в воде коллоидные растворы. Эти растворы характеризуются высокой вязкостью, способностью рассеивать лучи видимого
- 157. Явление диализа лежит в основе действия аппарата "искусственная почка", который широко используется в медицине для лечения
- 158. При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее
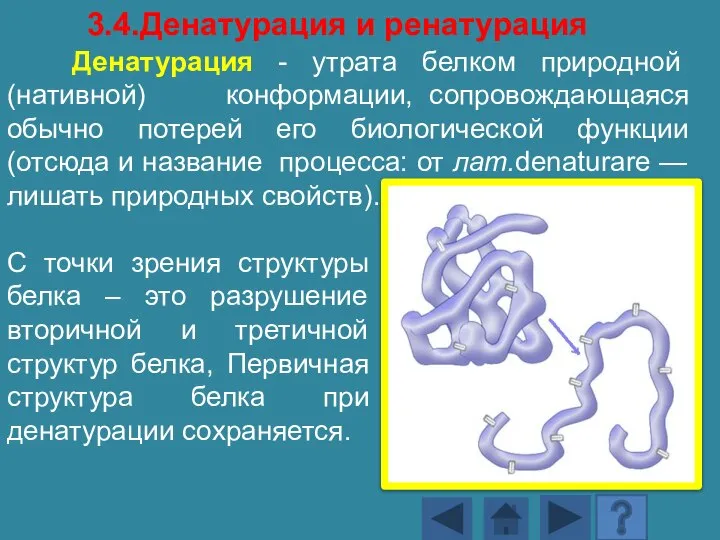
- 159. Денатурация - утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции (отсюда и название
- 160. Факторы, вызывающие денатурацию Физические факторы Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию.
- 161. Денатурация может быть обратимой (ренатурация) и необратимой. Самый известный случай денатурации белка в быту — это
- 162. Денатурация белков происходит в желудке, где имеется сильнокислая среда (рН 0,5 - 1,5), и это способствует
- 163. Ренатурация (обратимая денатурация) – восстановление физико-химических и биологических свойств белка (нативной структуры) при снятии денатурирующего фактора.
- 164. При денатурации белков в клетках, в живом организме вырабатываются специфические белки шапероны, которые: - «узнают» частично
- 165. 3.5. Качественные (цветные) реакции на белки
- 166. 3.5. Качественные реакции на белки Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II) в
- 167. Реакция обязана наличию пептидных связей в белках а также продуктах их гидролиза – пептидах: Интенсивность окраски
- 168. Нингидриновая реакция Сущность реакции состоит в образовании соединения, окрашенного в сине-фиолетовый цвет, состоящего из нингидрина и
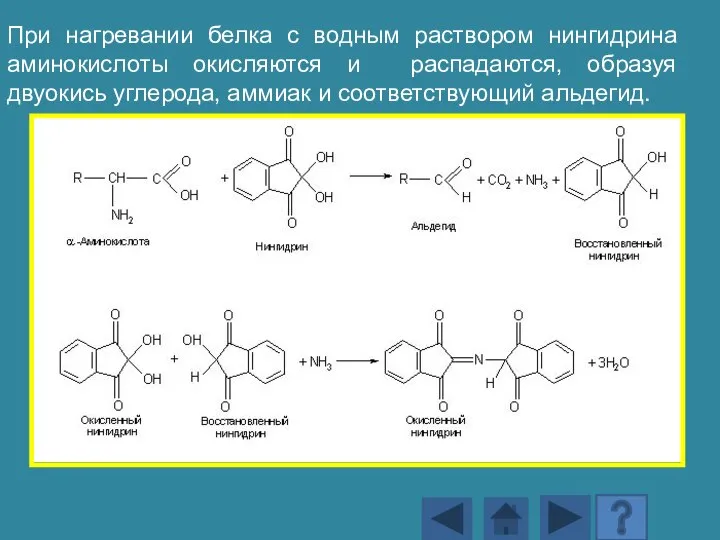
- 169. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя двуокись углерода, аммиак и
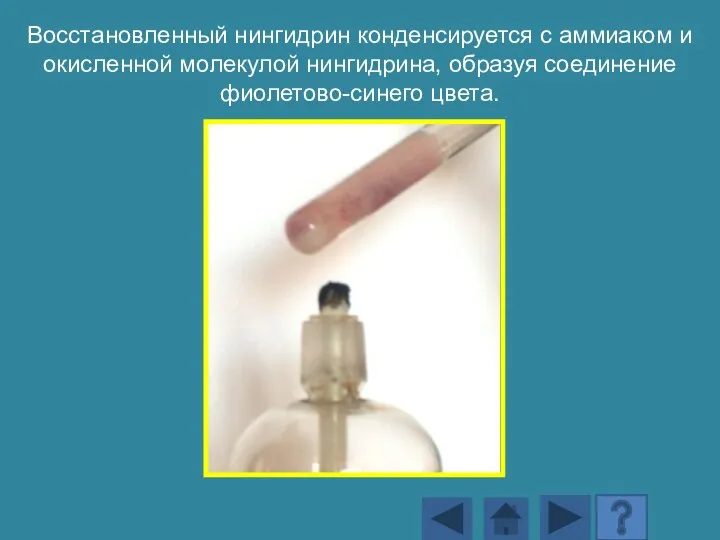
- 170. Восстановленный нингидрин конденсируется с аммиаком и окисленной молекулой нингидрина, образуя соединение фиолетово-синего цвета.
- 171. Интенсивность окраски полученного сине-фиолетового комплекса (пурпур Руэманна), пропорциональна количеству α-аминокислот. Желатин Яичный альбумин
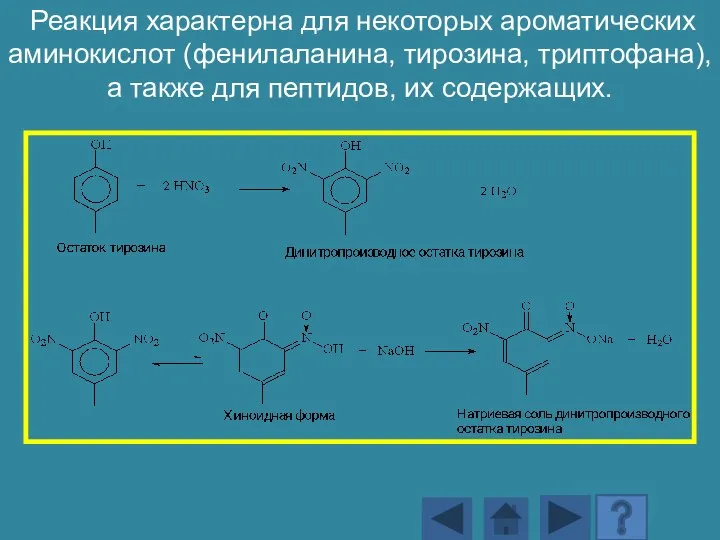
- 172. Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических
- 173. Реакция характерна для некоторых ароматических аминокислот (фенилаланина, тирозина, триптофана), а также для пептидов, их содержащих.
- 174. При действии азотной кислоты образуется нитросоединение желтого цвета. Нитропроизводные могут реагировать со щелочью с образованием натриевой
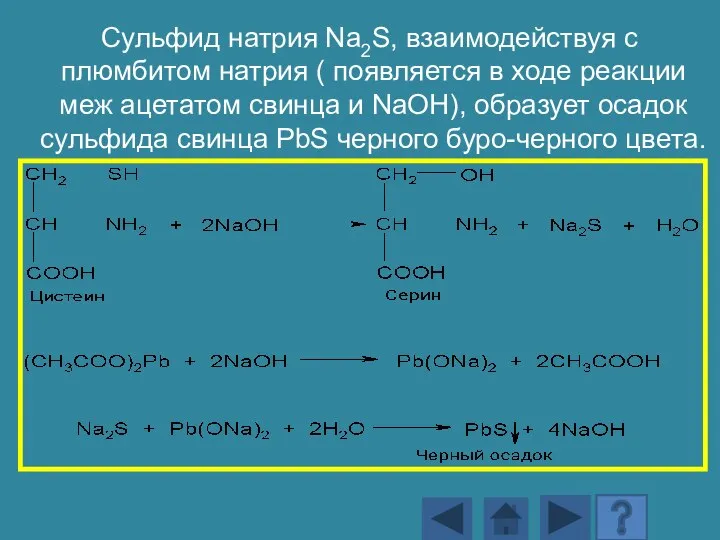
- 175. Реакция Фоля Реакция на серусодержащие аминокислоты, в ходе которой появляется черное либо бурое окрашивание сульфида свинца
- 176. Сульфид натрия Na2S, взаимодействуя с плюмбитом натрия ( появляется в ходе реакции меж ацетатом свинца и
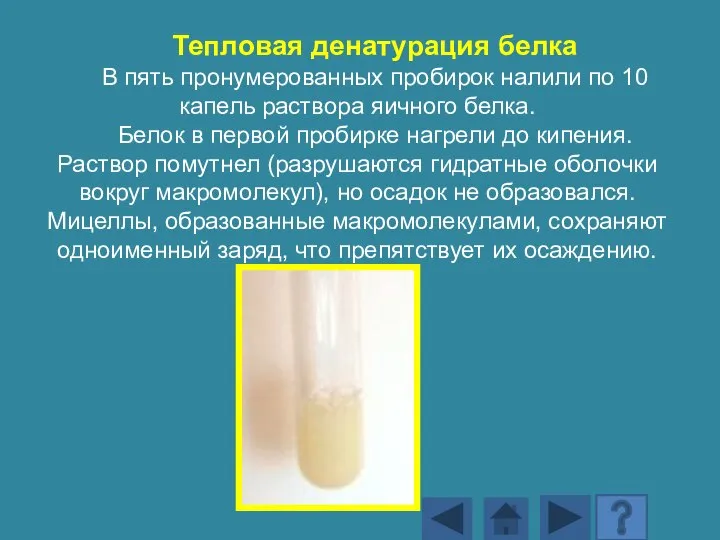
- 177. Тепловая денатурация белка При нагревании белки денатурируют. На процесс денатурации оказывают сильное влияние рН раствора и
- 178. Тепловая денатурация белка В пять пронумерованных пробирок налили по 10 капель раствора яичного белка. Белок в
- 179. Тепловая денатурация белка К раствору белка во второй пробирке добавили одну каплю 1 %-го раствора уксусной
- 180. Тепловая денатурация белка К раствору белка в третьей пробирке прибавили 1 – 2 капли 10 %-го
- 181. Тепловая денатурация белка В четвертую пробирку добавили 1 – 2 капли 10 %-го раствора гидроксида натрия
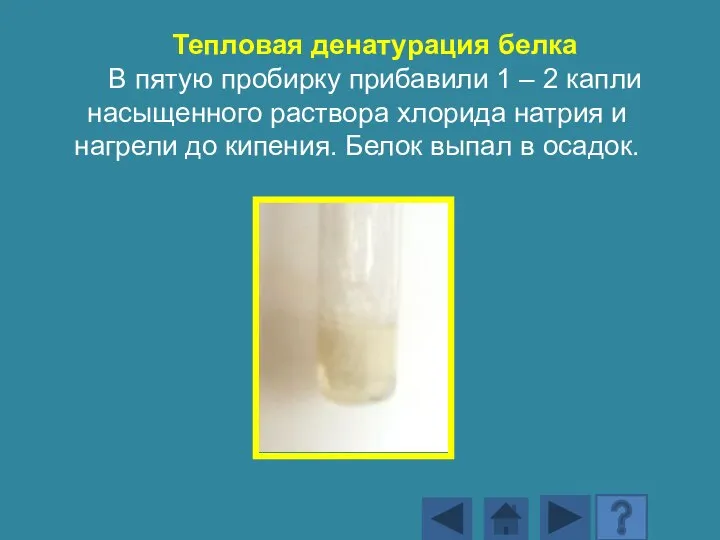
- 182. Тепловая денатурация белка В пятую пробирку прибавили 1 – 2 капли насыщенного раствора хлорида натрия и
- 183. Интересно знать! Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными
- 184. Белки могут выполнять все известные в природе функции, кроме одной - синтезировать сами себя. Основные функции
- 185. 4.1. Ферментативная функция Самый многообразный и наиболее специализированный класс белков составляют ферменты – белки, обладающие каталитической
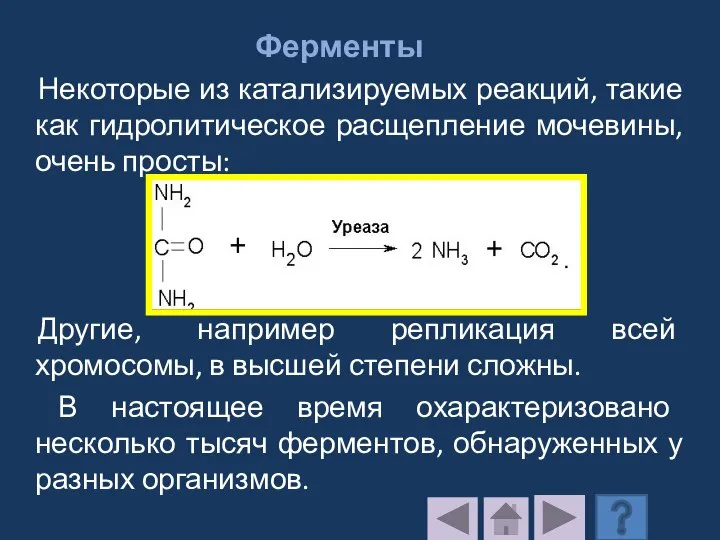
- 186. Ферменты Некоторые из катализируемых реакций, такие как гидролитическое расщепление мочевины, очень просты: Другие, например репликация всей
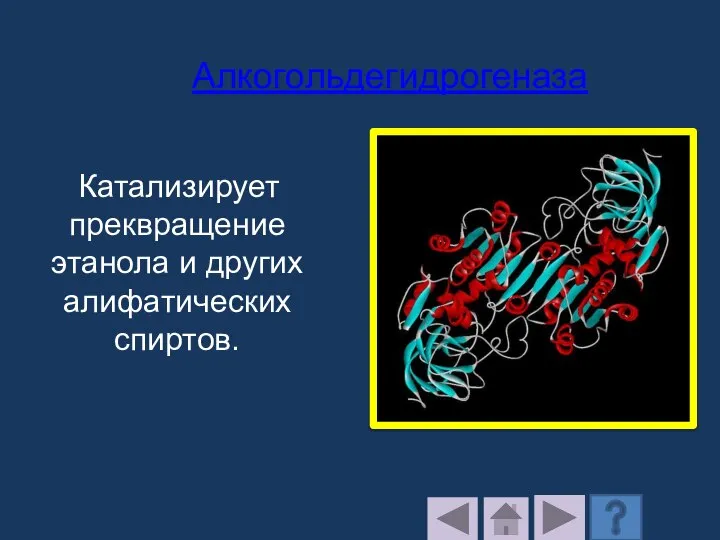
- 187. Катализирует преквращение этанола и других алифатических спиртов. Алкогольдегидрогеназа
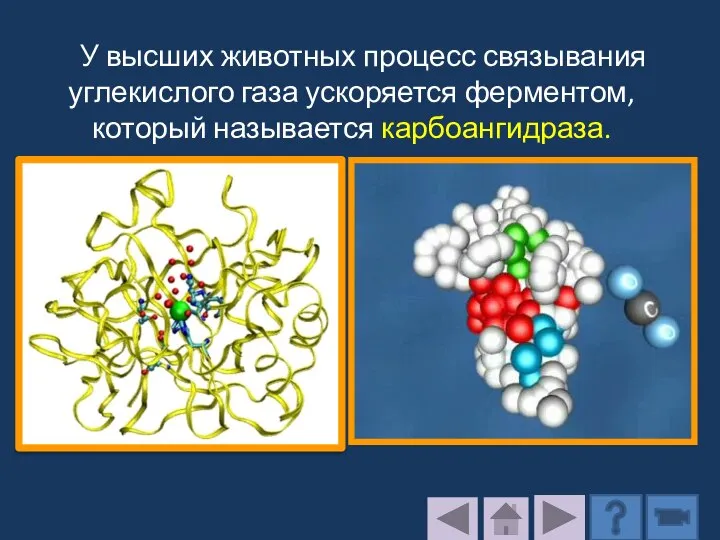
- 188. У высших животных процесс связывания углекислого газа ускоряется ферментом, который называется карбоангидраза.
- 189. В процессе пищеварения участвуют группы ферментов катализирующие расщепление определенных веществ: – амилазы, катализирующие расщепление крахмала на
- 190. Интересно знать! Созданы препараты содержащие ферменты поджелудочной железы. Например, мезим-форте®, который содержит 4200 ЕД амилазы, 3500
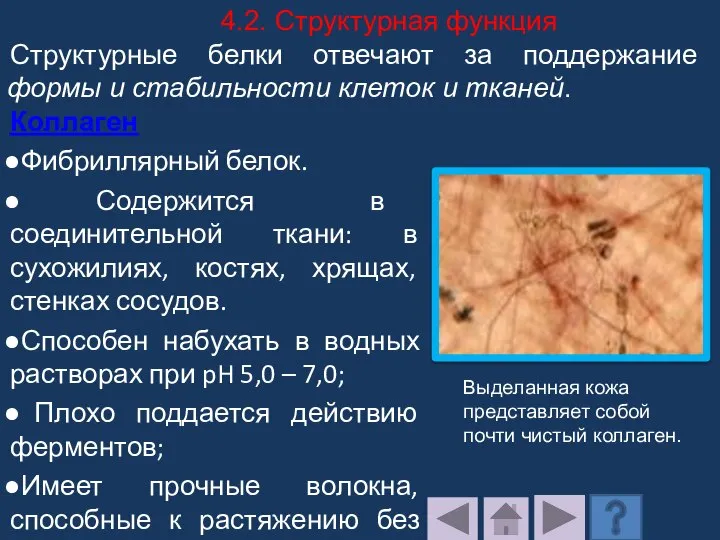
- 191. Коллаген Фибриллярный белок. Содержится в соединительной ткани: в сухожилиях, костях, хрящах, стенках сосудов. Способен набухать в
- 192. Интересно знать! Коллаген является наиболее известным препаратом для коррекции морщин и других дефектов кожи. Содержание собственного
- 193. Кератин Нерастворимый прочный белок. Содержится в волосах, рогах, копытах, шерсти, ногтях, панцире, перьях.
- 194. Структурные белки Эластин Cтруктурный белок способный растягиваться в двух измерениях. Содержится в связках, стенках капилляров и
- 195. Фиброин Главный компонент шелковых нитей и паутины. Имеет мягкие подвижные волокна. Обладает структурой антипараллельного складчатого листа
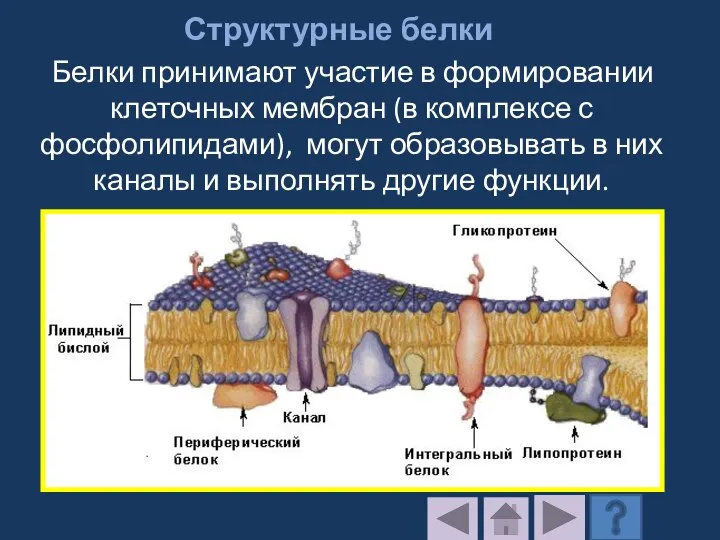
- 196. Структурные белки Белки принимают участие в формировании клеточных мембран (в комплексе с фосфолипидами), могут образовывать в
- 197. 4.3. Транспортная функция Транспортные белки переносят специфические молекулы и ионы. Внутрь клетки через биологическую мембрану должны
- 198. Бактериородопсин проводит протон через мембрану. Сидящие на a-спиралях бактериородопсина гидрофобные группы обращены "наружу", к (тоже гидрофобным)
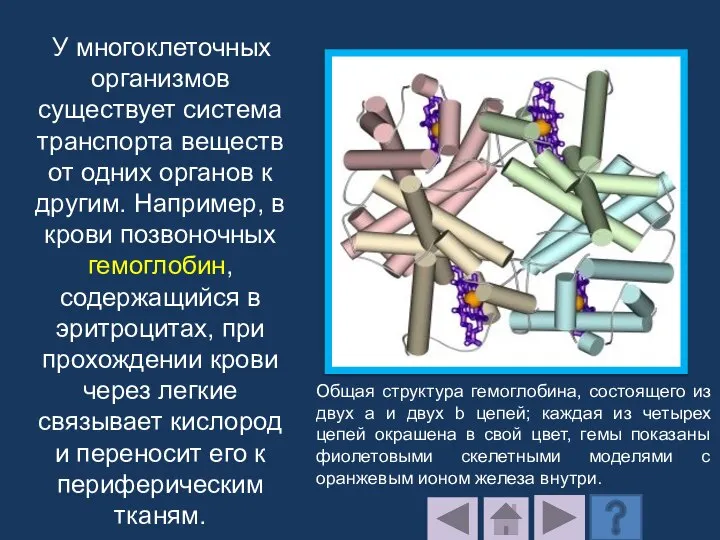
- 199. У многоклеточных организмов существует система транспорта веществ от одних органов к другим. Например, в крови позвоночных
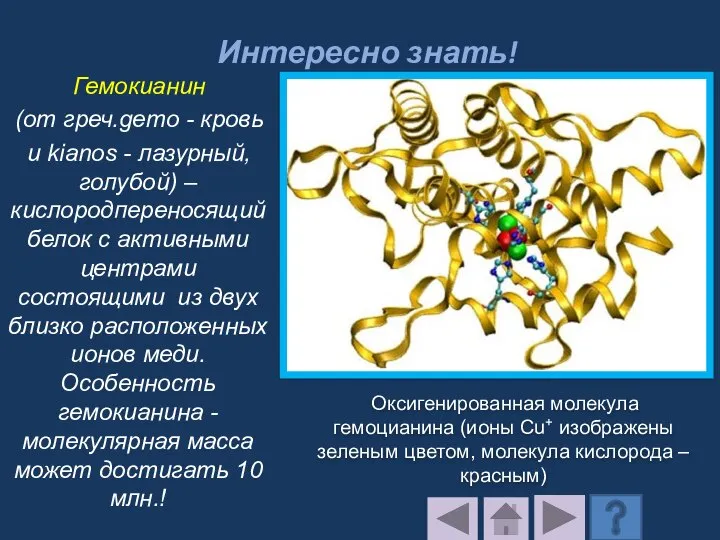
- 200. Интересно знать! Гемокианин (от греч.gemo - кровь и kianos - лазурный,голубой) –кислородпереносящий белок с активными центрами
- 201. Интересно знать! Кислород переносится «голубой кровью» у кальмаров, омаров, крабов, осьминогов, каракатиц, улиток, пауков.
- 202. Транспортные белки В плазме крови многоклеточных организмов находится транспортный белок - сывороточный альбумин, который обладает способностью
- 203. В семенах многих растений запасены пищевые белки, потребляемые на первых стадиях развития зародыша. К запасным белкам
- 204. К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений.
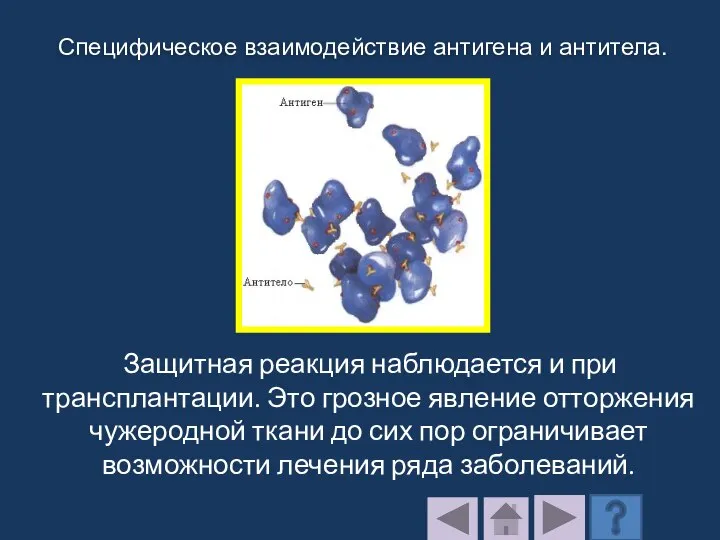
- 205. Защитная реакция наблюдается и при трансплантации. Это грозное явление отторжения чужеродной ткани до сих пор ограничивает
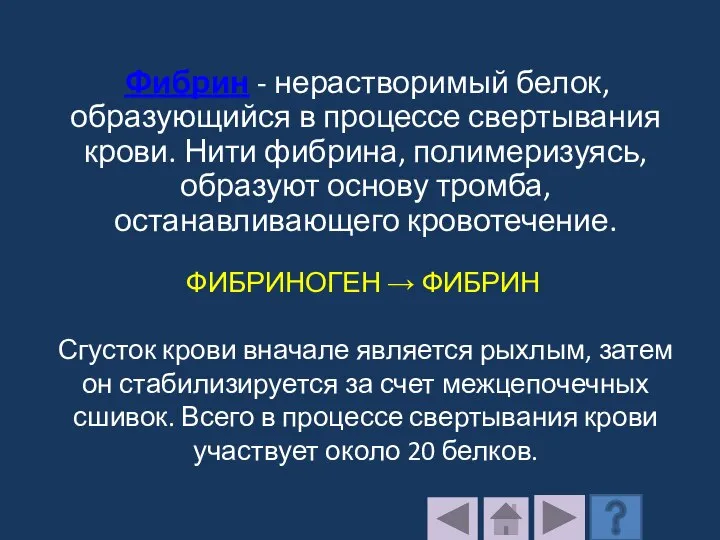
- 206. Фибрин - нерастворимый белок, образующийся в процессе свертывания крови. Нити фибрина, полимеризуясь, образуют основу тромба, останавливающего
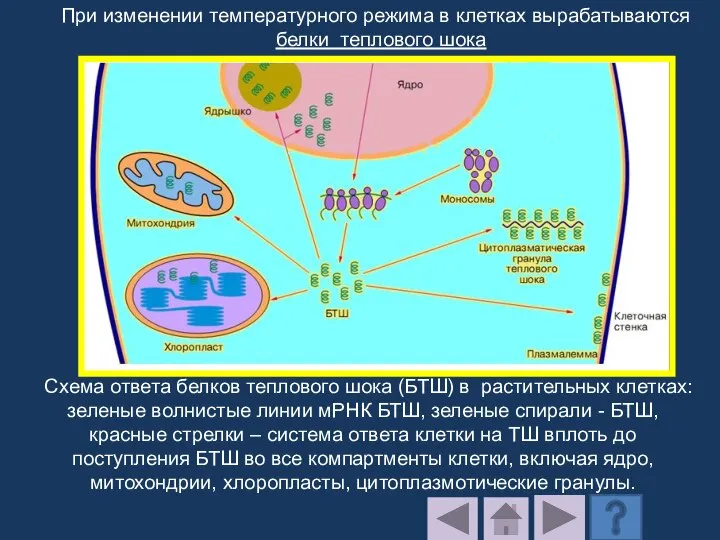
- 207. Стрессовые белки синтезируются в растениях в ответ на различные экстремальные воздействия: окислительный стресс, повышение и понижение
- 208. Схема ответа белков теплового шока (БТШ) в растительных клетках: зеленые волнистые линии мРНК БТШ, зеленые спирали
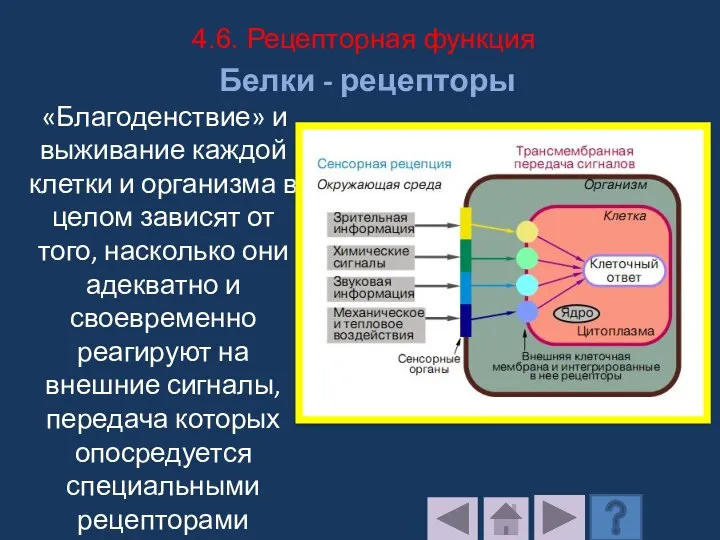
- 209. Белки - рецепторы «Благоденствие» и выживание каждой клетки и организма в целом зависят от того, насколько
- 210. Белки - рецепторы Существует три основных типа рецепторов, интегрированных во внешнюю клеточную мембрану: рецепторы, сопряженные с
- 211. Рецепторы, сопряженные с G–белками G- белки – это регуляторы, включающие или выключающие активность других молекул. Когда
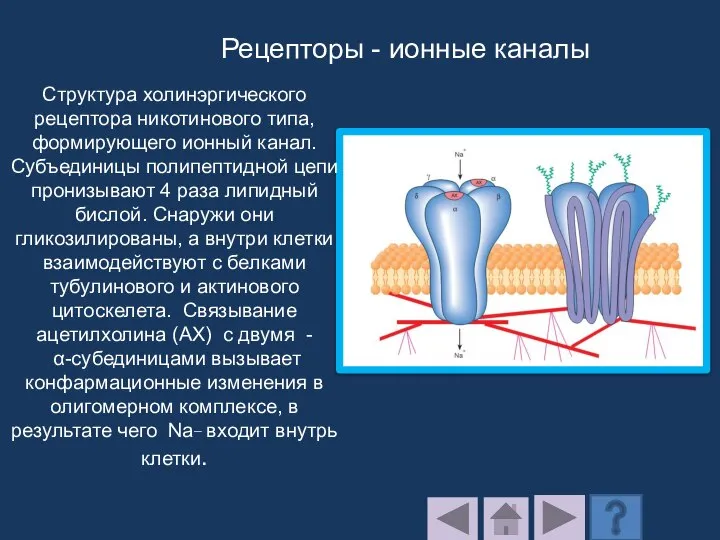
- 212. Структура холинэргического рецептора никотинового типа, формирующего ионный канал. Субъединицы полипептидной цепи пронизывают 4 раза липидный бислой.
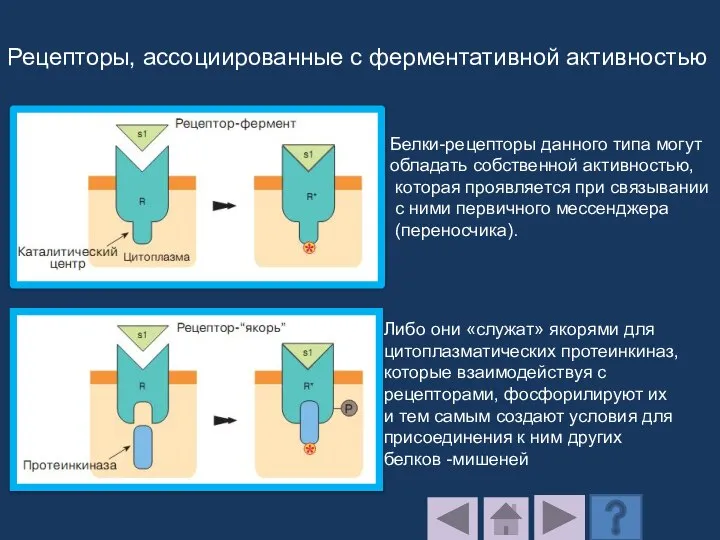
- 213. Рецепторы, ассоциированные с ферментативной активностью Белки-рецепторы данного типа могут обладать собственной активностью, которая проявляется при связывании
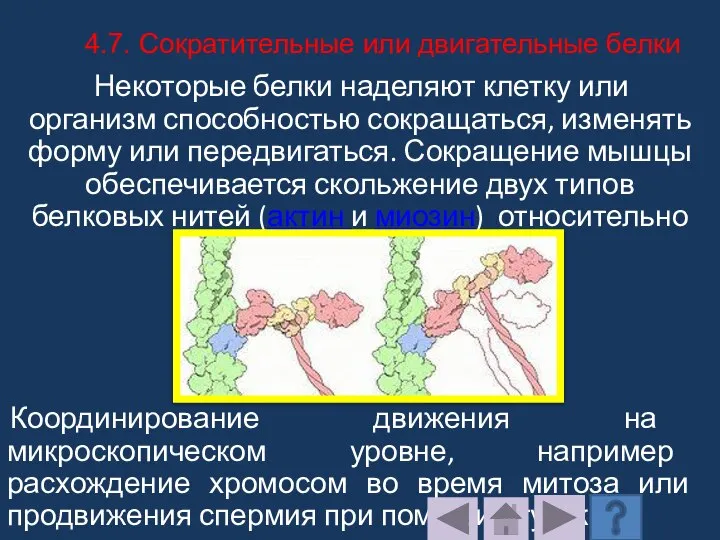
- 214. Некоторые белки наделяют клетку или организм способностью сокращаться, изменять форму или передвигаться. Сокращение мышцы обеспечивается скольжение
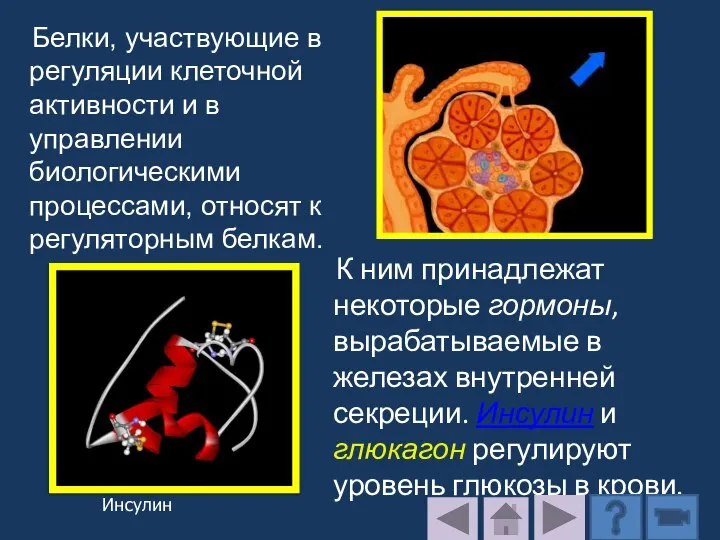
- 215. Белки обладают чрезвычайно широкой биологической активностью. Они регулируют работу сердечно-сосудистой, иммунной, половой, эндокринной, пищеварительной и других
- 216. К ним принадлежат некоторые гормоны, вырабатываемые в железах внутренней секреции. Инсулин и глюкагон регулируют уровень глюкозы
- 217. Окситоцин человека Пептидные гормоны Окситоцин Стимулирует сокращение матки у беременных самок. Стимулирует выделение молока из молочных
- 218. Вазопрессин человека Пептидные гормоны Вазопрессин Обладает сильным антидиуретическим действием (регулирует водный обмен), стимулируя реабсорбцию воды почками.
- 219. Гормон роста (соматотропин) определяет размеры тела, секретируется передней долей гипофиза. Гормоном роста соматотропин называют за то,
- 220. Недостаток гормона роста в детском возрасте связан в основном с генетическими дефектами и вызывает задержку роста
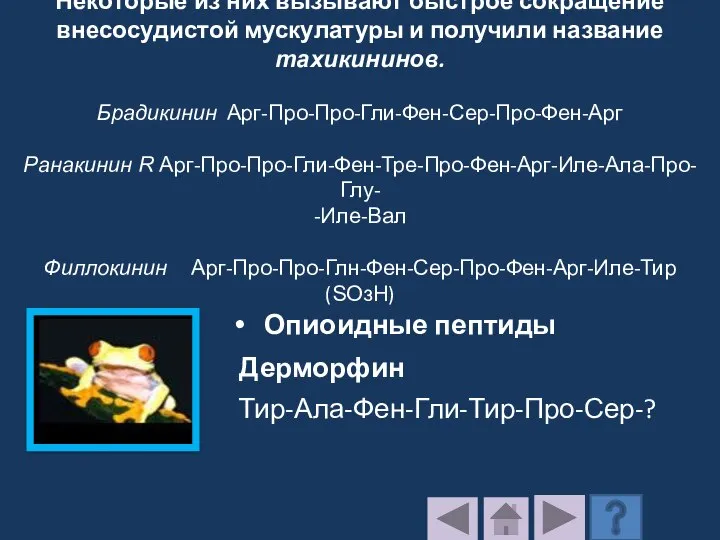
- 221. 4.9. Токсины Большая группа фармакологически активных пептидов, в том числе брадикинин, физалемин, церулеин и др., найдены
- 222. Некоторые из них вызывают быстрое сокращение внесосудистой мускулатуры и получили название тахикининов. Брадикинин Арг-Про-Про-Гли-Фен-Сер-Про-Фен-Арг Ранакинин R
- 223. Токсины Мелиттин — основной компонент пчелиного яда, содержание его в целом яде достигает 50%. Это сильный
- 224. токсины Все токсические полипептиды змей делят на: - токсины, специфически блокирующие Н-холинорецепторы субсинаптической мембраны скелетной мускулатуры
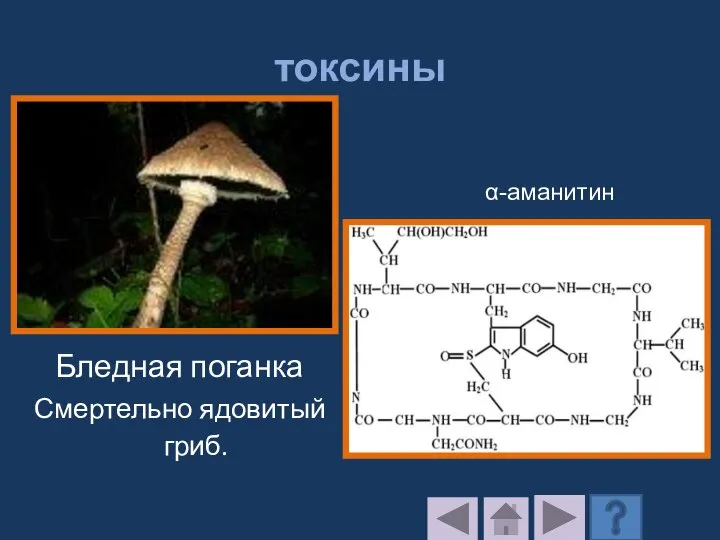
- 225. токсины Бледная поганка Смертельно ядовитый гриб. α-аманитин
- 226. Интересно знать! Нобелевская премия по химии 2008 года присуждена трём биологам — японцу Осаму Шимомуре и
- 227. Белки используют в промышленности для окрашивания тканей, при рафинировании сахара, в различных операциях по фотографии
- 228. Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания,
- 229. Кроме выше рассмотренных функций, белки участвуют в экспрессии генетической информации, передаче нервных импульсов, поддерживают онкотическое давление
- 230. Белки как необходимые компоненты пищи Необходимые для человека белки содержат продукты питания различного происхождения. Животные продукты
- 231. Содержание белка в животных продуктах Мясо, рыба и птица усваиваются организмом в разной степени и поэтому
- 232. Содержание белка в растительных продуктах Бобовые и крупы отличаются особенно высоким содержанием белка. Чечевица, соя и
- 233. Дефицит белка в питании уменьшает устойчивость организма к инфекциям, так как снижается уровень образования антител. Нарушается
- 234. Заключение Сегодня на «коротком» пути от гена к белку (он весь умещается в пределах одной клетки)
- 235. После того, как синтезирована аминокислотная последовательность белка, получившийся продукт еще не стал белком в химическом и
- 236. Пространственную структуру белка сегодня можно определить лишь экспериментально - с помощью рентгеноструктурного анализа кристаллов белка или
- 238. Скачать презентацию

























































































































































 Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Наноматеріали. Тіт Лукрецій Кар
Наноматеріали. Тіт Лукрецій Кар Презентация на тему Занимательная химия
Презентация на тему Занимательная химия  Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Анализ объектов окружающей среды. Сопоставление и выбор методов анализа
Анализ объектов окружающей среды. Сопоставление и выбор методов анализа Соли. Применение солей
Соли. Применение солей Полимеры и пластмассы
Полимеры и пластмассы Бромистый этил
Бромистый этил Вода. Физические свойства воды
Вода. Физические свойства воды Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Спирты (алканолы)
Спирты (алканолы) Актуальные задачи химии
Актуальные задачи химии Щелочноземельные металлы
Щелочноземельные металлы Химия – наука, преобразующая мир для учеников. 7-8 классов
Химия – наука, преобразующая мир для учеников. 7-8 классов Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Актиний. Нахождение в природе
Актиний. Нахождение в природе Индиго-краситель
Индиго-краситель ATOMPP
ATOMPP Полезные ископаемые
Полезные ископаемые Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  Антитела. Что такое антитела?
Антитела. Что такое антитела? Термохимия. Задания
Термохимия. Задания Химические свойства алкенов. Получение
Химические свойства алкенов. Получение