Содержание
- 2. Цели: Охарактеризовать положение галогенов в Периодической системе Д.И.Менделеева. Охарактеризовать особенности строения атомов галогенов. Охарактеризовать физические свойства.
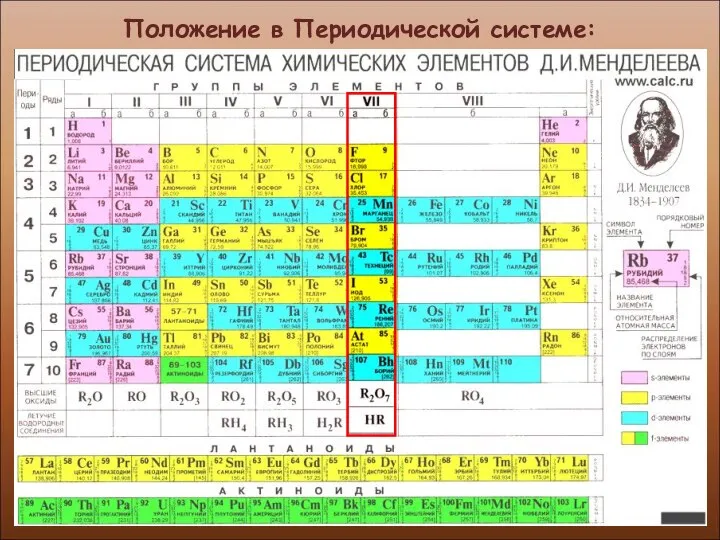
- 3. Положение в Периодической системе:
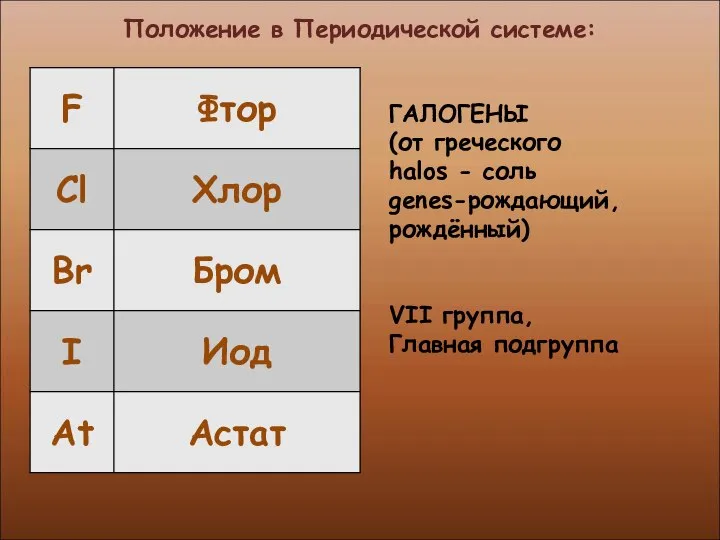
- 4. Положение в Периодической системе: ГАЛОГЕНЫ (от греческого halos - соль genes-рождающий, рождённый) VII группа, Главная подгруппа
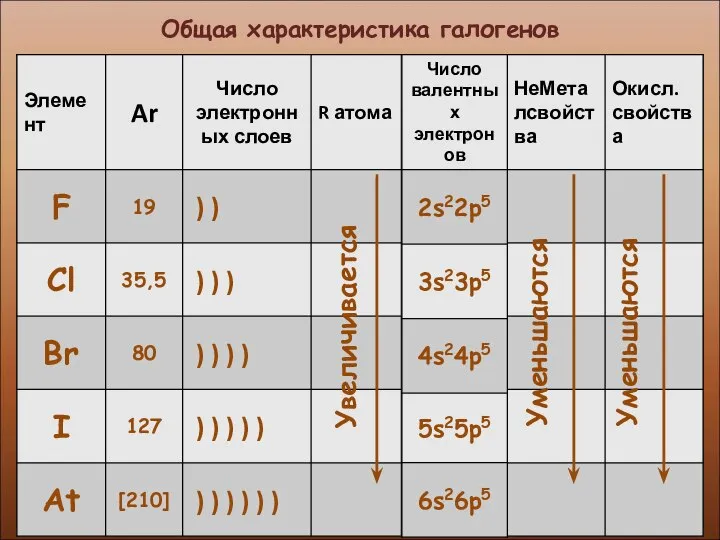
- 5. Общая характеристика галогенов
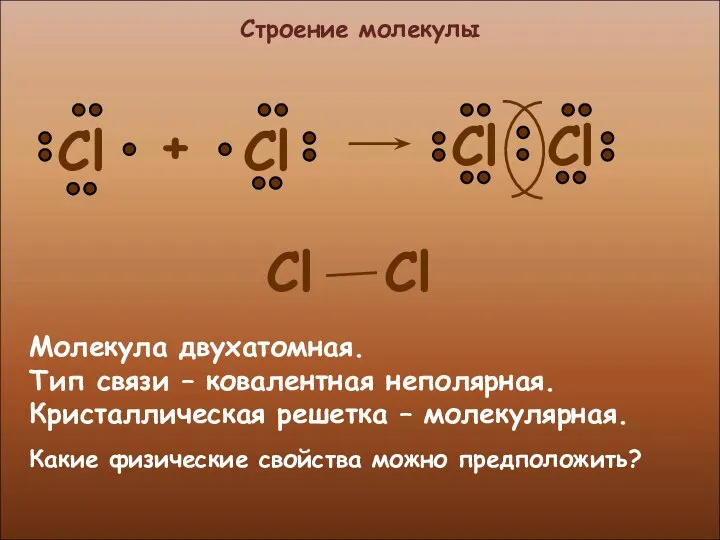
- 6. Строение молекулы Молекула двухатомная. Тип связи – ковалентная неполярная. Кристаллическая решетка – молекулярная. Какие физические свойства
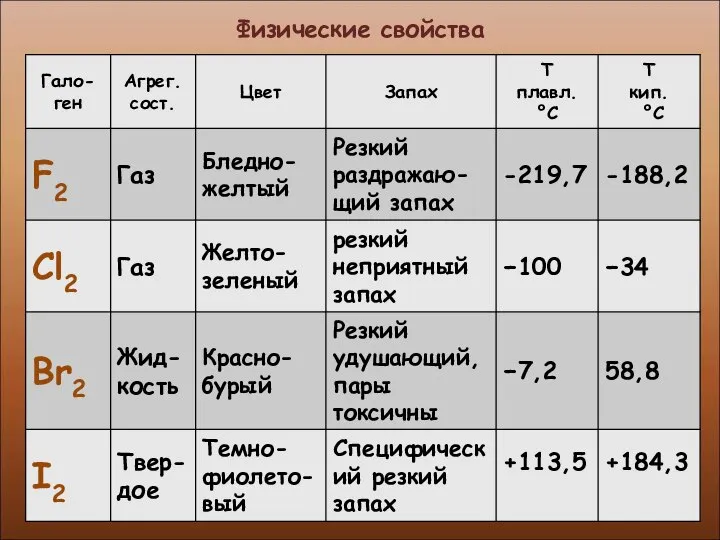
- 7. Физические свойства
- 8. Физические свойства
- 9. Физические свойства
- 10. Физические свойства
- 11. Физические свойства
- 12. Физические свойства
- 13. Физические свойства Этот элемент был вторым (после технеция) синтезированным искусственно элементом. Все изотопы астата короткоживущие, очень
- 14. Нахождение в природе CaF2 Флюорит (плавиковый шпат)
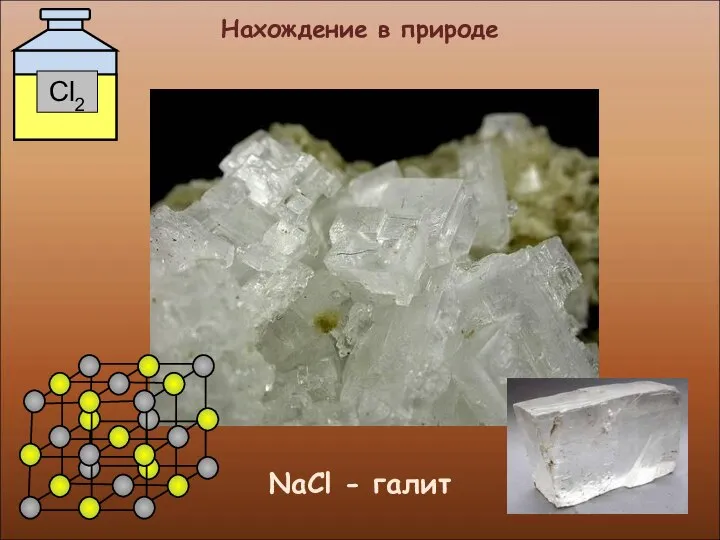
- 15. Нахождение в природе NaCl - галит
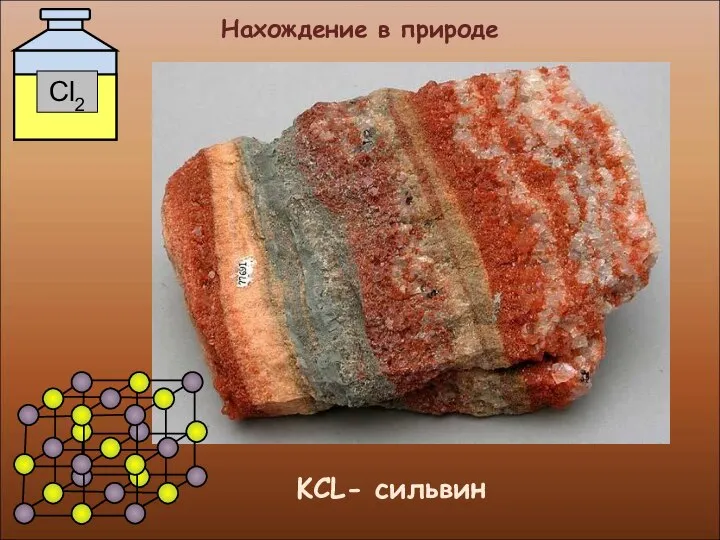
- 16. Нахождение в природе KCL- сильвин
- 17. Нахождение в природе Бром и иод добывают из природных вод. Источник иода – морские водоросли –
- 18. Химические свойства
- 19. Химические свойства. При взаимодействии галогенов с металлами образуются соли – галогениды. Zn + F2 = ZnF2
- 20. Химические свойства При взаимодействии галогенов с водородом образуются галогеноводороды (при растворении в воде галогеноводороды образуют кислоты)
- 21. Химические свойства Cl2, Br2, I2 взаимодействуют по схеме: Гal2 + H2O = HГalО + НГal Cl2
- 22. Химические свойства Более активный галоген вытесняет менее активный из растворов солей. F2 > Cl2 > Br2
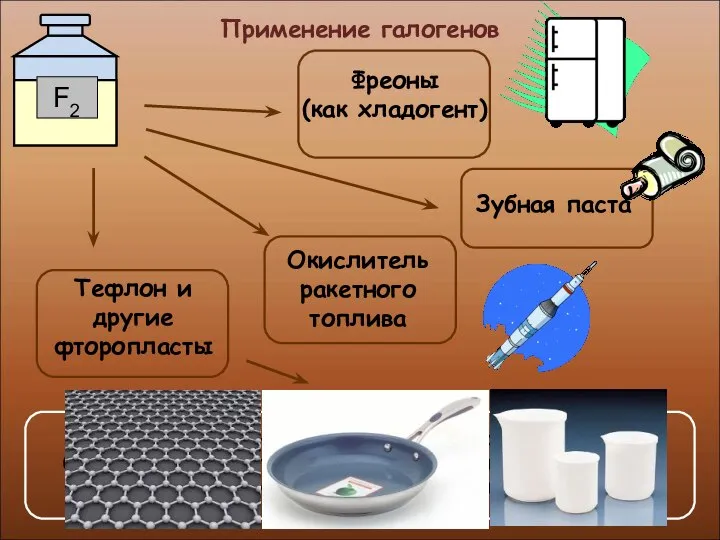
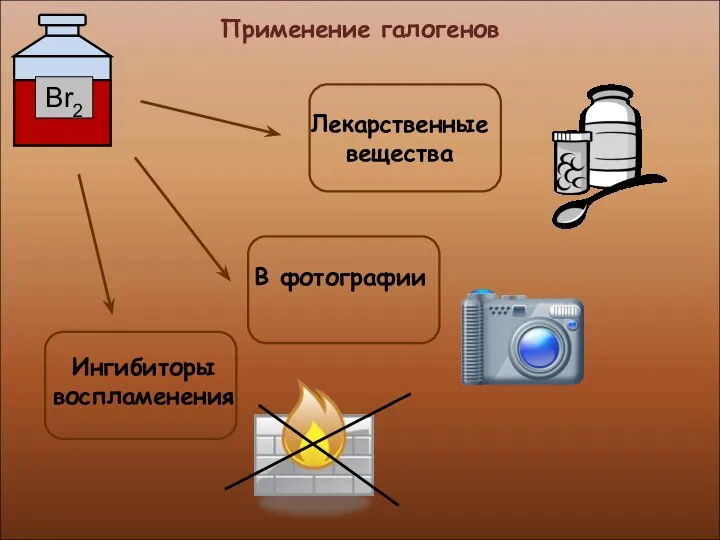
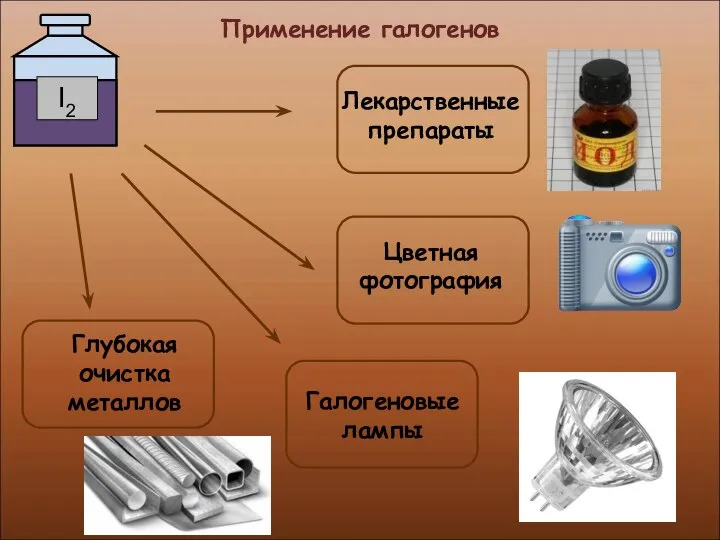
- 23. Применение галогенов
- 24. Применение галогенов Производство медикаментов, красок и пластмасс Производство соляной кислоты и хлоридов
- 25. Применение галогенов
- 26. Применение галогенов
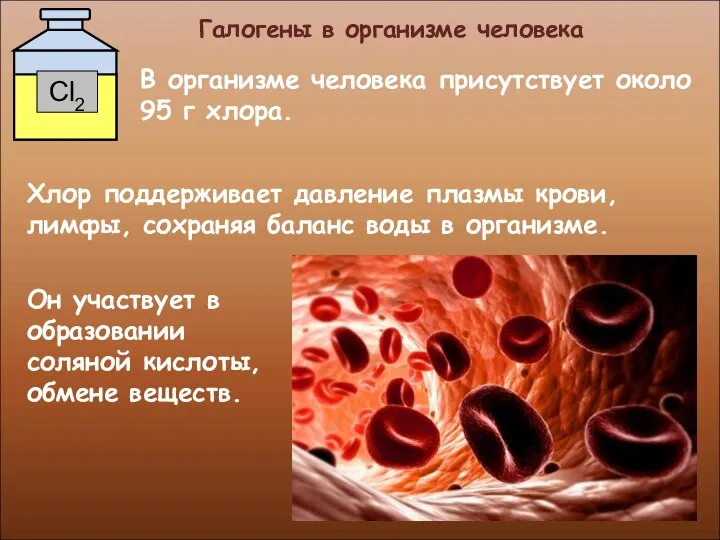
- 27. Галогены в организме человека Фтор находится в организме во всех органах и тканях. Но наибольшее его
- 28. Галогены в организме человека Он участвует в образовании соляной кислоты, обмене веществ. В организме человека присутствует
- 29. Галогены в организме человека Содержание брома в организме человека (масса тела 70 кг) составляет 260 мг.
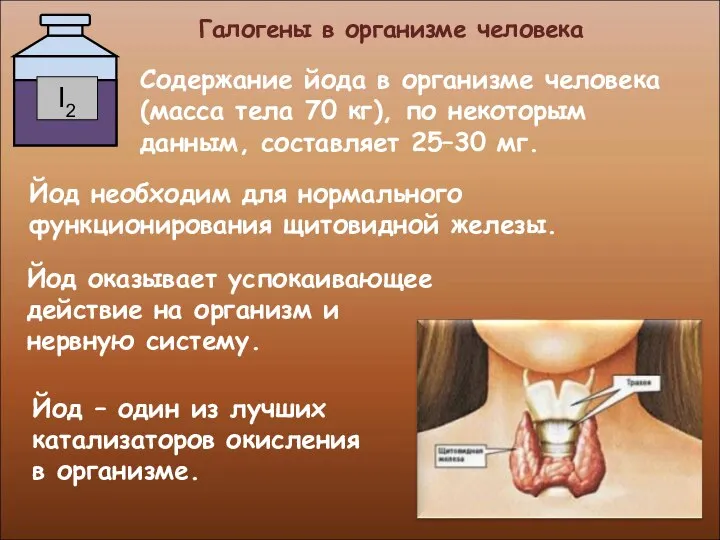
- 30. Галогены в организме человека Содержание йода в организме человека (масса тела 70 кг), по некоторым данным,
- 32. Скачать презентацию

















 Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Предельные углеводороды (циклоалканы)
Предельные углеводороды (циклоалканы) Nanofibers of aluminum oxide
Nanofibers of aluminum oxide Галогены
Галогены Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Исследование молока
Исследование молока Органическая химия
Органическая химия Химические реакции. Классификация
Химические реакции. Классификация Число химических связей, способных образовать данный атом
Число химических связей, способных образовать данный атом Металлы общая характеристика
Металлы общая характеристика Как определять минералы
Как определять минералы Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Термодинамика. Лекция №2
Термодинамика. Лекция №2 Контрольная работа
Контрольная работа Простые эфиры и перекиси
Простые эфиры и перекиси Характеристика кислорода и серы
Характеристика кислорода и серы Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Расчётно-графическая работа по теме Мыловарение
Расчётно-графическая работа по теме Мыловарение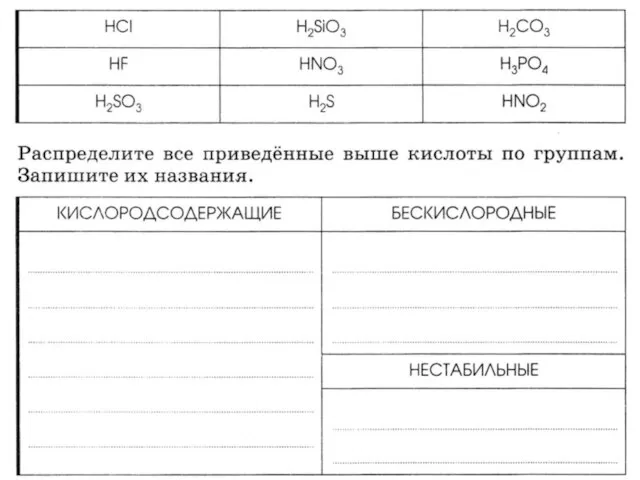 Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Основы трибологии и триботехники. Смазка и смазочные материалы
Основы трибологии и триботехники. Смазка и смазочные материалы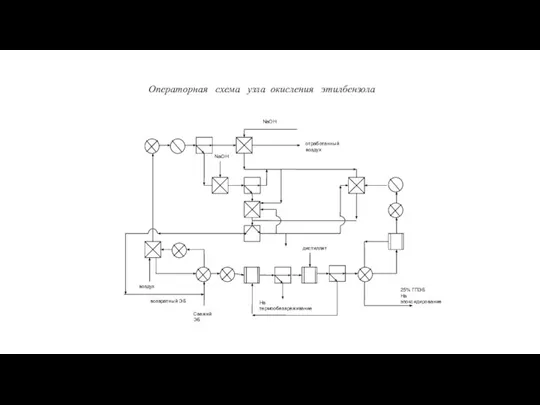 Эпоксидирование олефинов (халкон-процесс)
Эпоксидирование олефинов (халкон-процесс) Нуклеирующие добавки
Нуклеирующие добавки Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды)
Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды) Рубидий (Rb). Цезий (Cs). Франций (Fr)
Рубидий (Rb). Цезий (Cs). Франций (Fr) Молекулярная химия
Молекулярная химия Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов
Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов