Содержание
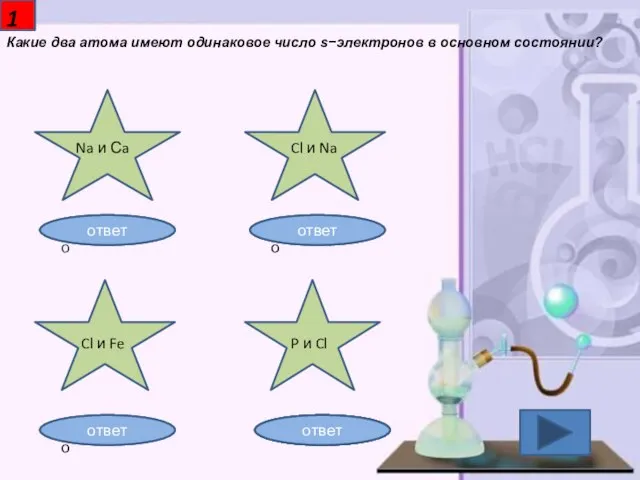
- 2. Какие два атома имеют одинаковое число s−электронов в основном состоянии? 1 Na и Сa Cl и
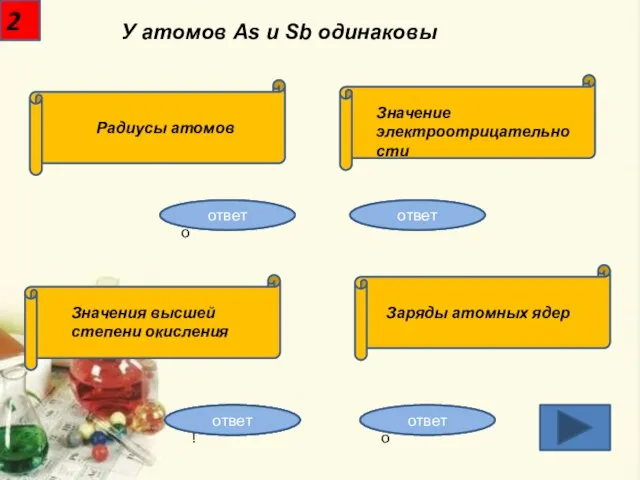
- 3. 2 У атомов As и Sb одинаковы Неправильно Неправильно Неправильно Правильно! Радиусы атомов Значение электроотрицательности Значения
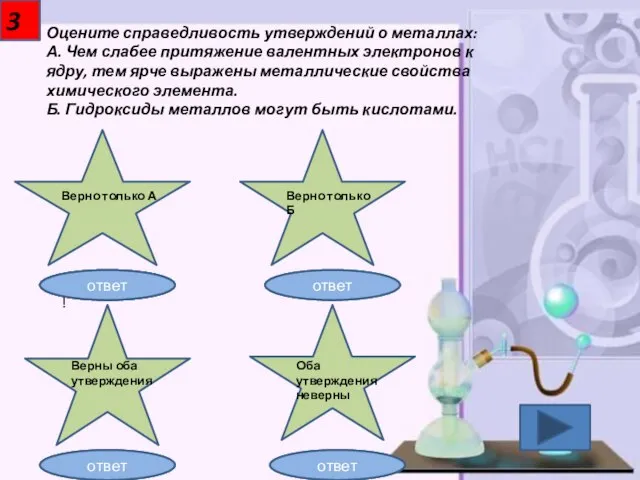
- 4. 3 Оцените справедливость утверждений о металлах: А. Чем слабее притяжение валентных электронов к ядру, тем ярче
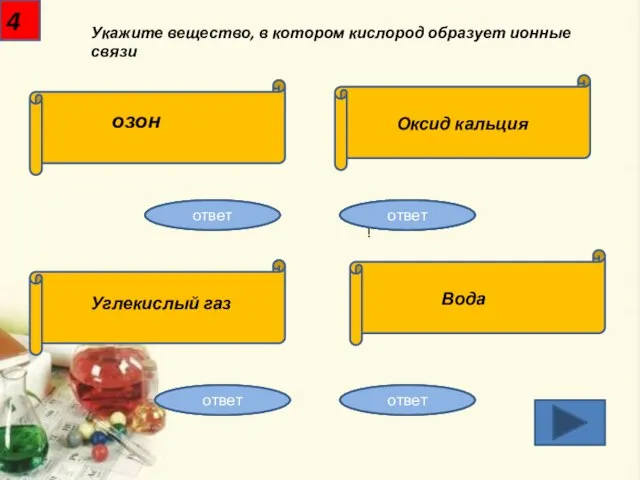
- 5. Укажите вещество, в котором кислород образует ионные связи 4 озон Оксид кальция Углекислый газ Вода Неправильно
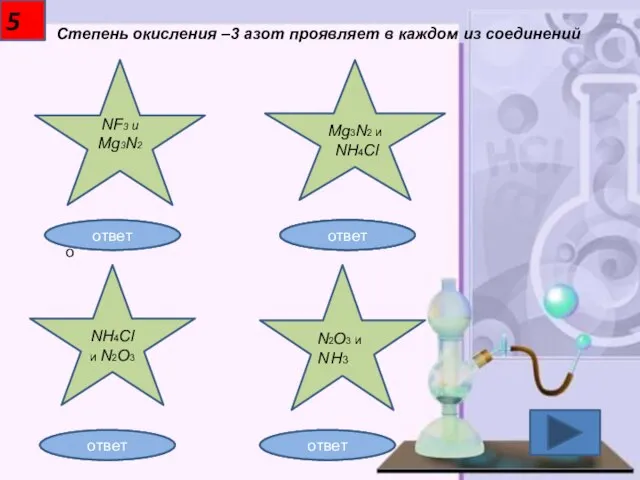
- 6. 5 Степень окисления –3 азот проявляет в каждом из соединений NF3 и Mg3N2 Mg3N2 и NH4Cl
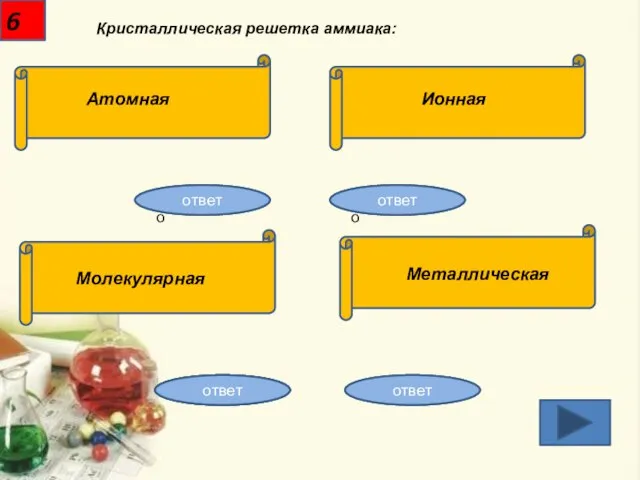
- 7. 6 Кристаллическая решетка аммиака: Атомная Ионная Молекулярная Металлическая Неправильно Неправильно Неправильно Правильно! ответ ответ ответ ответ
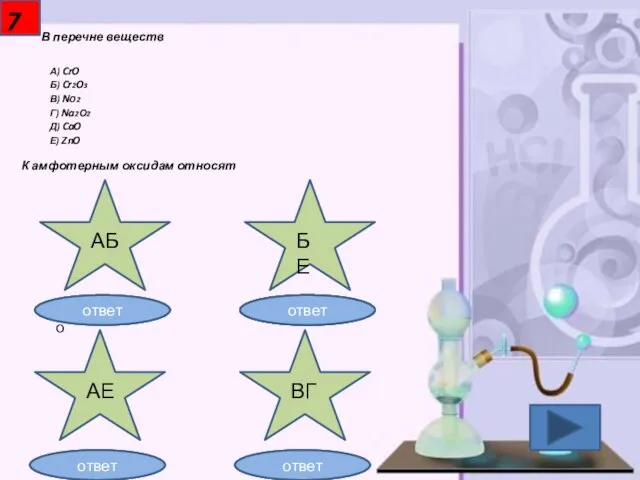
- 8. 7 В перечне веществ А) CrO Б) Cr2O3 В) NO2 Г) Na2О2 Д) CaO Е) ZnO
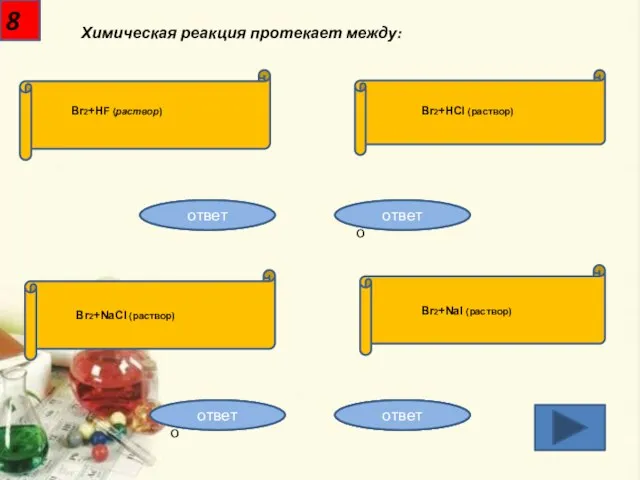
- 9. 8 Химическая реакция протекает между: Br2+HF (раствор) Br2+HCl (раствор) Br2+NaCl (раствор) Br2+NaI (раствор) Неправильно Неправильно Неправильно
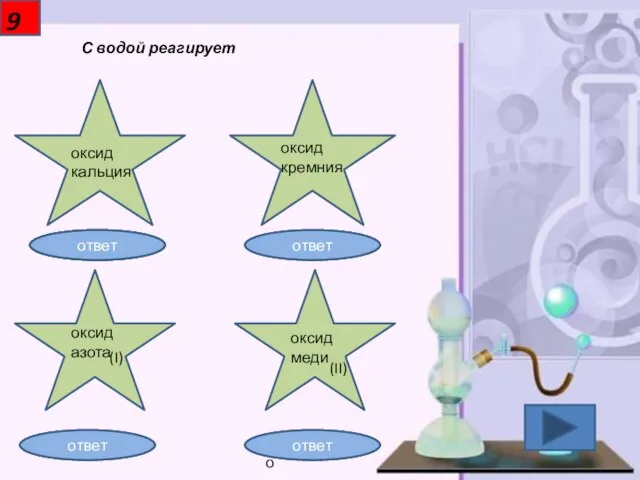
- 10. 9 С водой реагирует оксид кальция оксид кремния оксид азота (I) оксид меди (II) Правильно! Неправильно
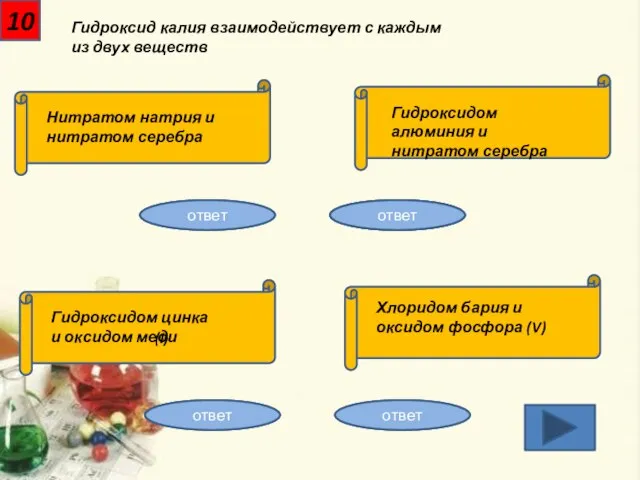
- 11. 10 Гидроксид калия взаимодействует с каждым из двух веществ Нитратом натрия и нитратом серебра Гидроксидом алюминия
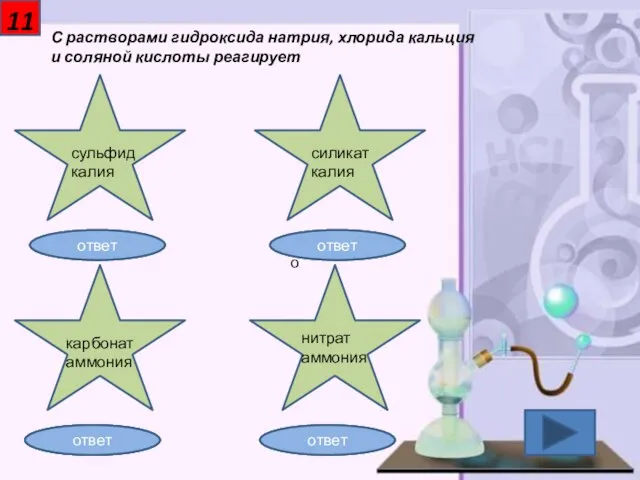
- 12. 11 С растворами гидроксида натрия, хлорида кальция и соляной кислоты реагирует сульфид калия силикат калия карбонат
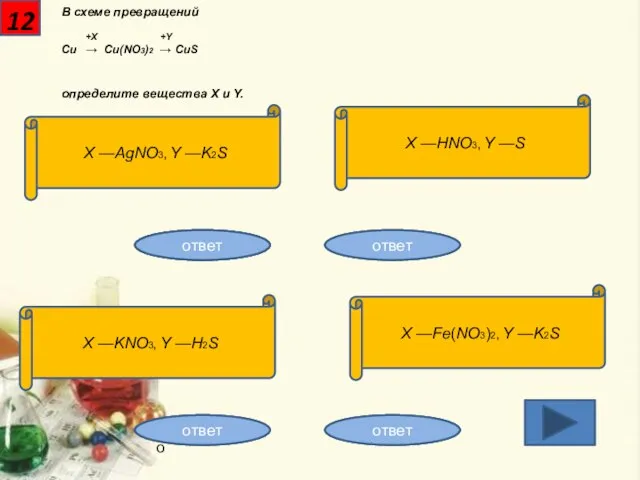
- 13. 12 В схеме превращений +X +Y Cu → Cu(NO3)2 → CuS определите вещества X и Y.
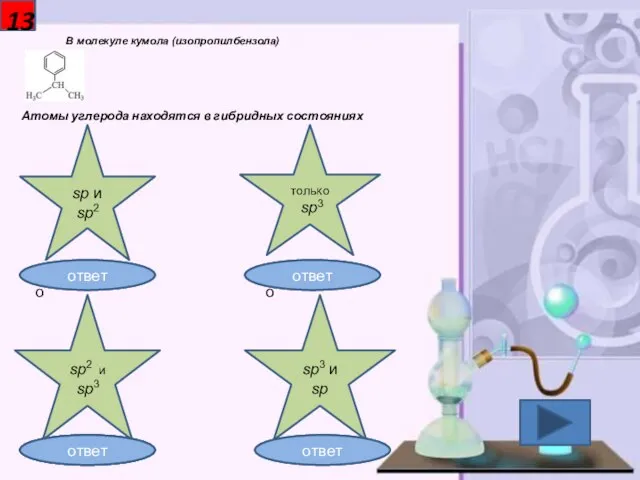
- 14. 13 В молекуле кумола (изопропилбензола) Атомы углерода находятся в гибридных состояниях sp и sp2 sp3 и
- 15. 14 В отличие от бензола, толуол не обесцвечивает бромную воду обесцвечивает подкисленный раствор перманганата калия вступает
- 16. 15 Интенсивно-синий раствор образуется, если к свежеосаждённому гидроксиду меди(II) добавить фенол метанол этиленгликоль ацетальдегид Неправильно Неправильно
- 17. 16 В отличие от кетонов, альдегиды подвергаются гидролизу восстанавливаются водородом в спирты негорючи вступают в реакцию
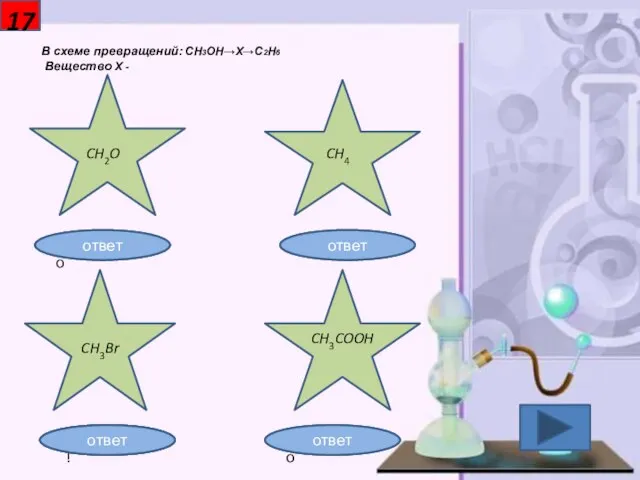
- 18. 17 В схеме превращений: CH3OH→X→C2H6 Вещество X - CH2O CH4 CH3Br CH3COOH Неправильно Неправильно Правильно! Неправильно
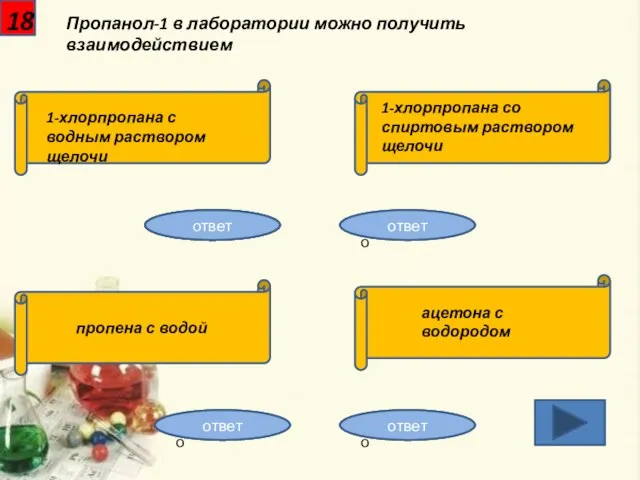
- 19. 18 Пропанол-1 в лаборатории можно получить взаимодействием 1-хлорпропана с водным раствором щелочи 1-хлорпропана со спиртовым раствором
- 20. 19 Взаимодействие бензола с хлором на свету — это реакция замещения присоединения отщепления обмена Неправильно Правильно!
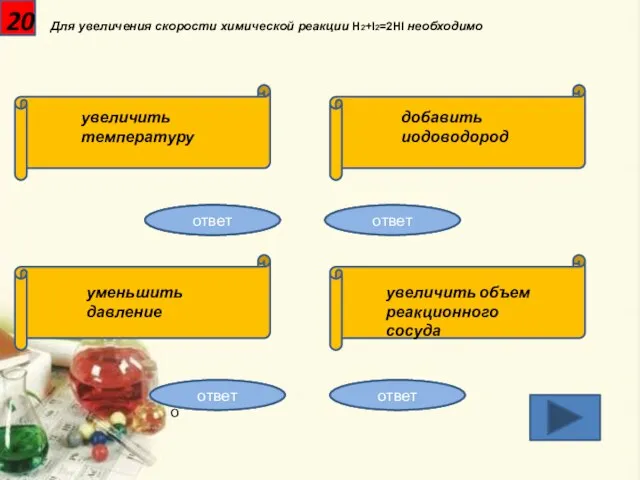
- 21. 20 Для увеличения скорости химической реакции H2+I2=2HI необходимо увеличить температуру добавить иодоводород уменьшить давление увеличить объем
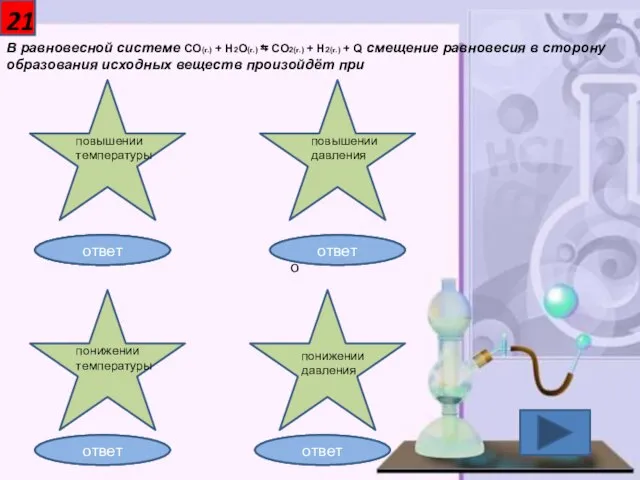
- 22. 21 В равновесной системе CO(г.) + H2O(г.) ⇆ CO2(г.) + H2(г.) + Q смещение равновесия в
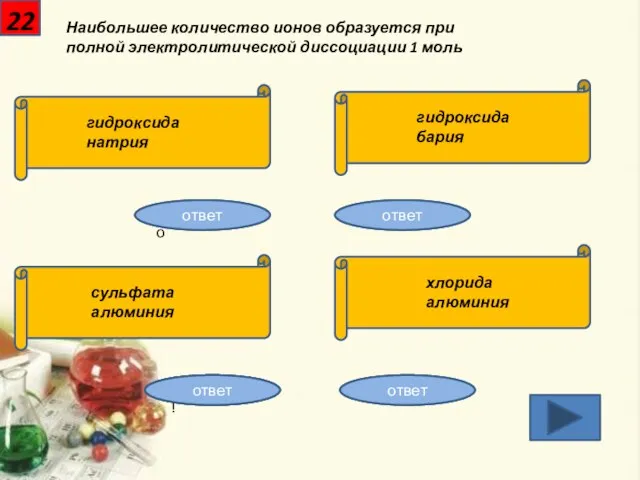
- 23. 22 Наибольшее количество ионов образуется при полной электролитической диссоциации 1 моль гидроксида натрия гидроксида бария сульфата
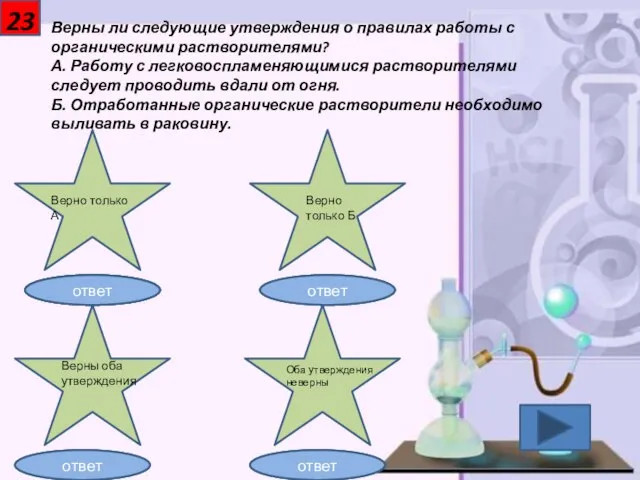
- 24. 23 Верны ли следующие утверждения о правилах работы с органическими растворителями? А. Работу с легковоспламеняющимися растворителями
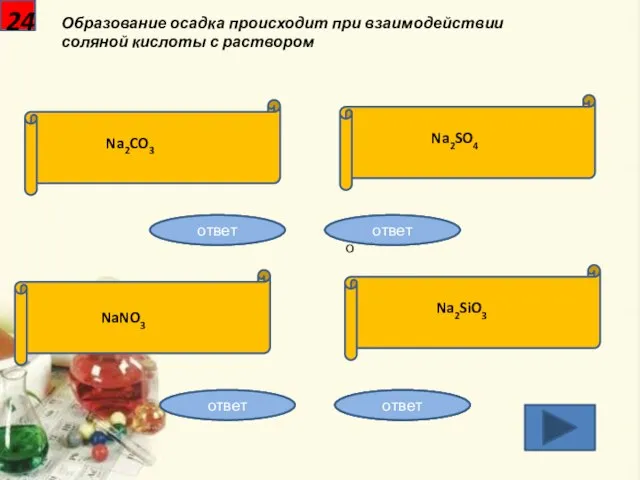
- 25. 24 Образование осадка происходит при взаимодействии соляной кислоты с раствором Na2CO3 Na2SO4 NaNO3 Na2SiO3 Неправильно Неправильно
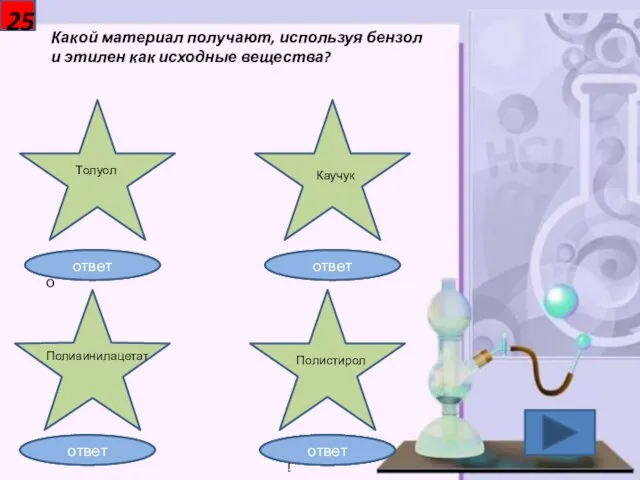
- 26. 25 Какой материал получают, используя бензол и этилен как исходные вещества? Толуол Каучук Поливинилацетат Полистирол Неправильно
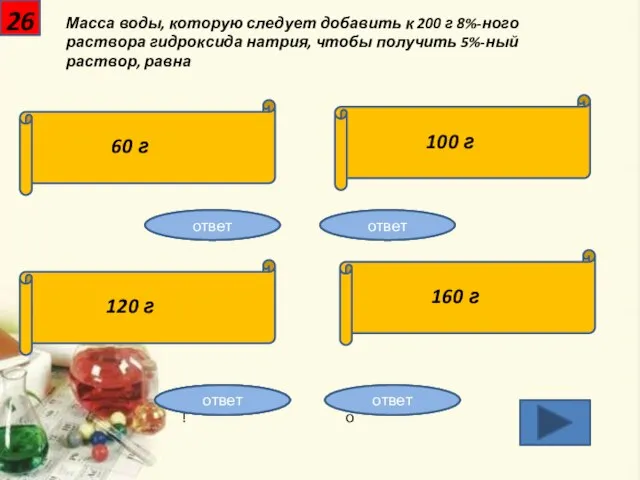
- 27. 26 Масса воды, которую следует добавить к 200 г 8%-ного раствора гидроксида натрия, чтобы получить 5%-ный
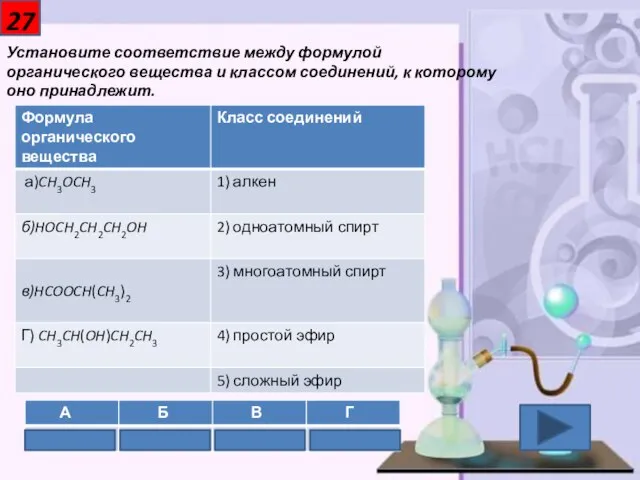
- 28. 27 Установите соответствие между формулой органического вещества и классом соединений, к которому оно принадлежит.
- 29. 28 Установите соответствие между схемой реакции и изменением степени окисления вещества, играющего в этой реакции роль
- 30. 29 Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного
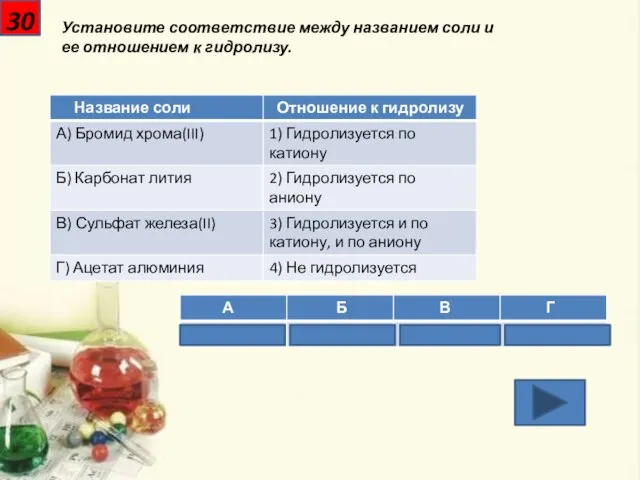
- 31. 30 Установите соответствие между названием соли и ее отношением к гидролизу.
- 32. 31 Установите соответствие между названием вещества и формулами реагентов, с каждым из которых оно может вступать
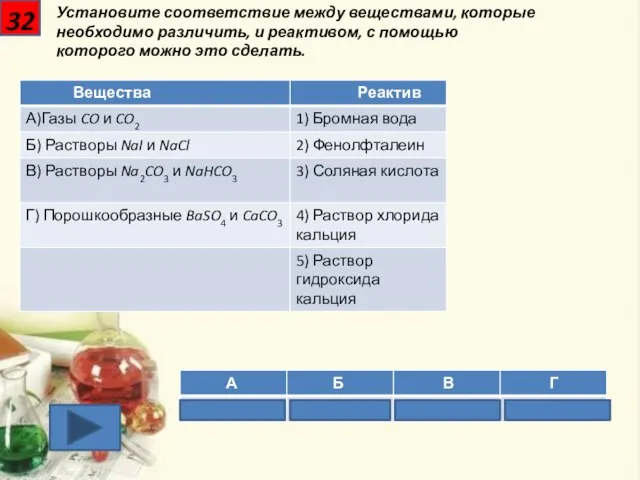
- 33. 32 Установите соответствие между веществами, которые необходимо различить, и реактивом, с помощью которого можно это сделать.
- 34. 33 Взаимодействие н-бутана с хлором протекает 1 с разрывом связей C−C в молекуле бутана 2 через
- 35. 34 Стеариновая кислота вступает в реакции 1 этерификации 2 гидролиза 3 «серебряного зеркала» 4 горения в
- 36. 35 В отличие от глюкозы, сахароза 1 2 3 4 5 6 реагирует с бромной водой
- 37. 36 Используя метод электронного баланса, составьте уравнения реакций, укажите окислитель и восстановитель P + HClO3 +
- 38. 37 "Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия.
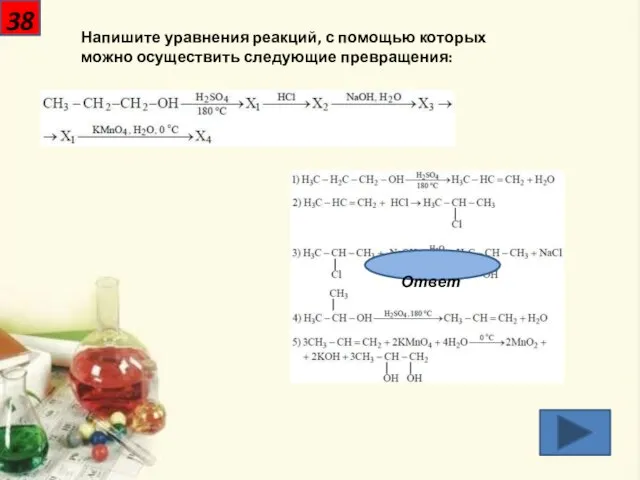
- 39. 38 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ответ
- 40. 39 К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для
- 41. 40 При взаимодействии 25,5 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6
- 43. Скачать презентацию











 Введение в информационную безопасность
Введение в информационную безопасность InvestСryptGroup. Заработок на криптовалюте
InvestСryptGroup. Заработок на криптовалюте Oracle Solaris
Oracle Solaris Занятие: бизнес-старт
Занятие: бизнес-старт Понятие операционной системы
Понятие операционной системы Представление звука в памяти компьютера. Технические средства мультимедиа. 7 класс
Представление звука в памяти компьютера. Технические средства мультимедиа. 7 класс Представление данных. Принципы кодирования информации. Раздел 2
Представление данных. Принципы кодирования информации. Раздел 2 Подключение смс уведомлений
Подключение смс уведомлений Цифровой квест Знатоки интернет пространства
Цифровой квест Знатоки интернет пространства Объектно-ориентированное программирование
Объектно-ориентированное программирование Devops. Lesson 10
Devops. Lesson 10 27 задача ЕГЭ. Информатика
27 задача ЕГЭ. Информатика Возможности искусственного интеллекта для жителей умного города
Возможности искусственного интеллекта для жителей умного города Создание таблиц в СУБД Microsoft Access
Создание таблиц в СУБД Microsoft Access Работа в системе Дело. Делопроизводитель
Работа в системе Дело. Делопроизводитель Устройство компьютера
Устройство компьютера «Проблемы мотивации учебной деятельности на уроках информатики. Уровневая дифференциация" Учитель информатики МОУ «Основная
«Проблемы мотивации учебной деятельности на уроках информатики. Уровневая дифференциация" Учитель информатики МОУ «Основная  Язык программирования Pascal Работа с символьными данными А. Жидков
Язык программирования Pascal Работа с символьными данными А. Жидков Организация локальных сетей
Организация локальных сетей Газета Рыбак рыбака
Газета Рыбак рыбака Обработка числовых последовательностей
Обработка числовых последовательностей Причины социального детокса
Причины социального детокса Программная среда Microsoft Excel Формулы, функции, диаграммы и графики
Программная среда Microsoft Excel Формулы, функции, диаграммы и графики Моделирование. Раздел 1
Моделирование. Раздел 1 Virus-M. Игра
Virus-M. Игра Введение в компьютерные науки
Введение в компьютерные науки Википедия (Wikipedia)
Википедия (Wikipedia) Программирование в Minecraft: Big Data
Программирование в Minecraft: Big Data