Содержание
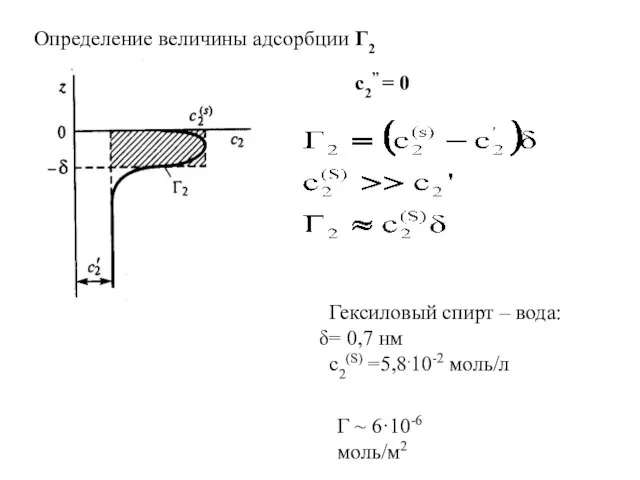
- 2. Удельная адсорбция (Г) – избыточное количество вещества на единицу площади поверхности раздела фаз n – общее
- 3. Гексиловый спирт – вода: = 0,7 нм с2(S) =5,8.10-2 моль/л Γ ~ 6·10-6 моль/м2 c2” =
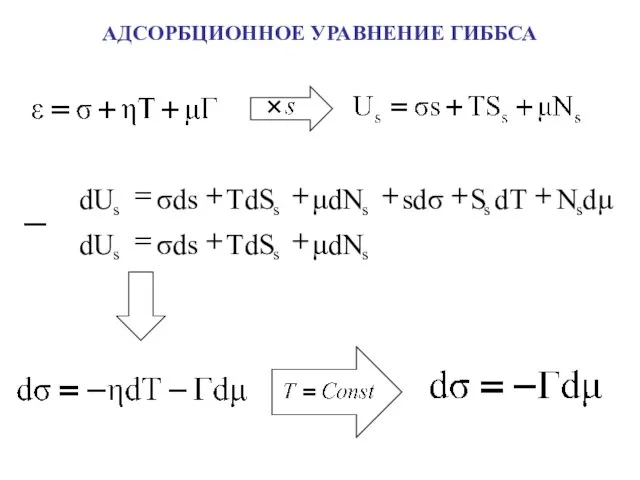
- 4. АДСОРБЦИОННОЕ УРАВНЕНИЕ ГИББСА
- 5. АДСОРБЦИОННОЕ УРАВНЕНИЕ ГИББСА при α = 1
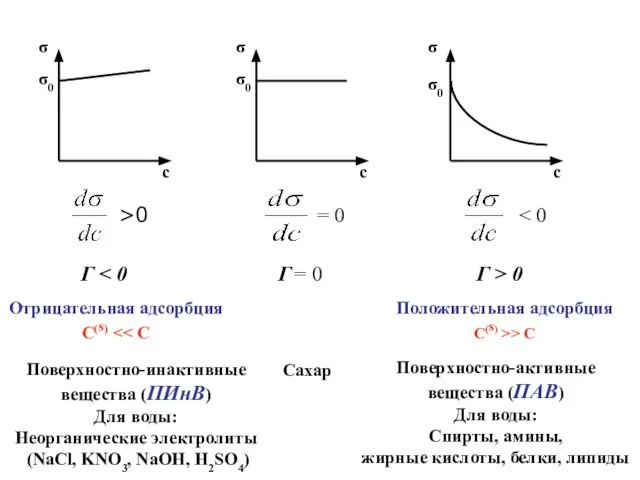
- 6. σ c σ0 σ c σ0 σ c σ0 >0 = 0 Г > 0 Г
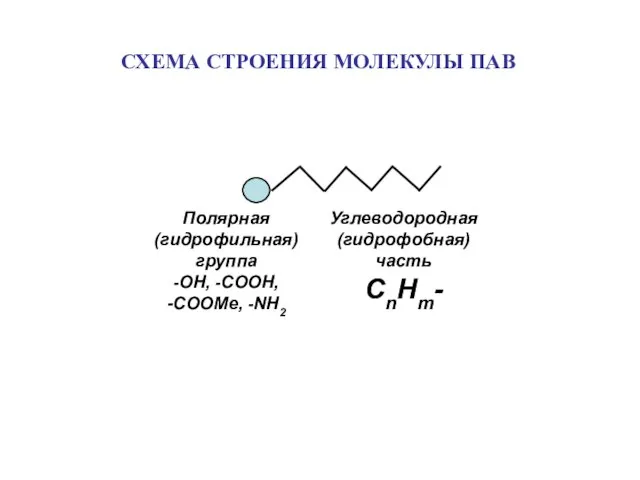
- 7. СХЕМА СТРОЕНИЯ МОЛЕКУЛЫ ПАВ
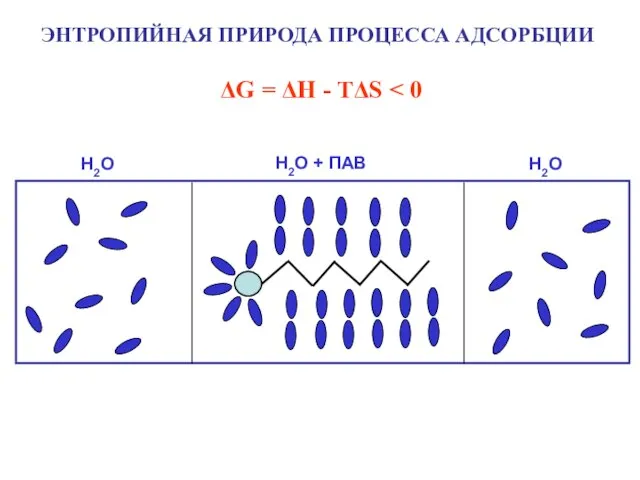
- 8. ЭНТРОПИЙНАЯ ПРИРОДА ПРОЦЕССА АДСОРБЦИИ ΔG = ΔH - TΔS
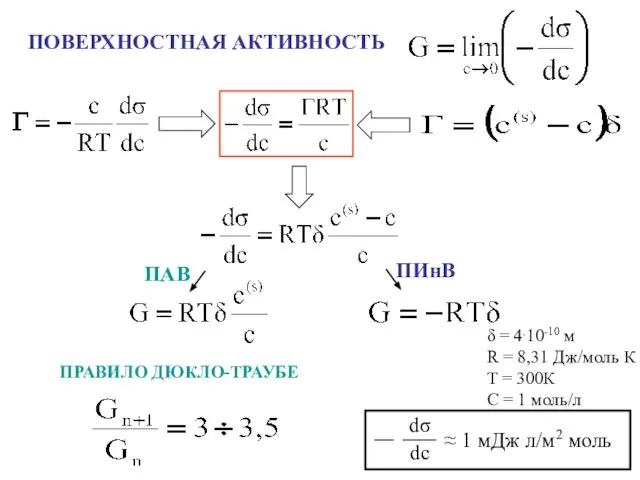
- 9. ПОВЕРХНОСТНАЯ АКТИВНОСТЬ ПРАВИЛО ДЮКЛО-ТРАУБЕ ПАВ ПИнВ δ = 4.10-10 м R = 8,31 Дж/моль К Т
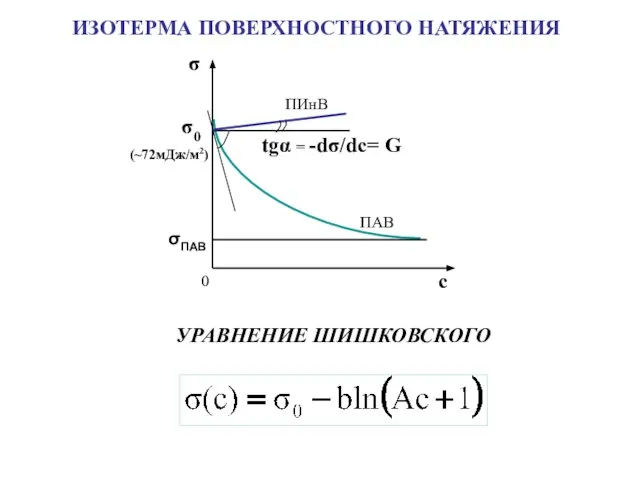
- 10. УРАВНЕНИЕ ШИШКОВСКОГО ИЗОТЕРМА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
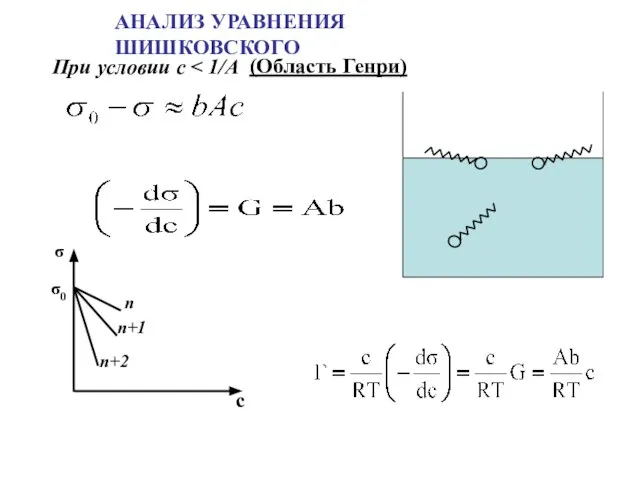
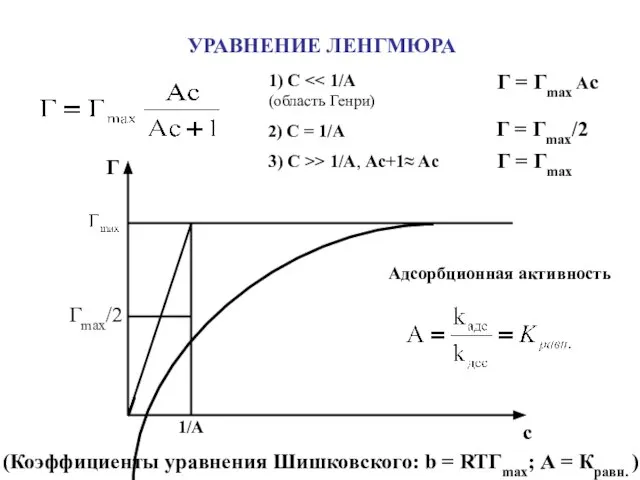
- 11. АНАЛИЗ УРАВНЕНИЯ ШИШКОВСКОГО (Область Генри)
- 13. При условии c > 1/A АНАЛИЗ УРАВНЕНИЯ ШИШКОВСКОГО , т.е. Г=Гmax На границе с воздухом σmin~
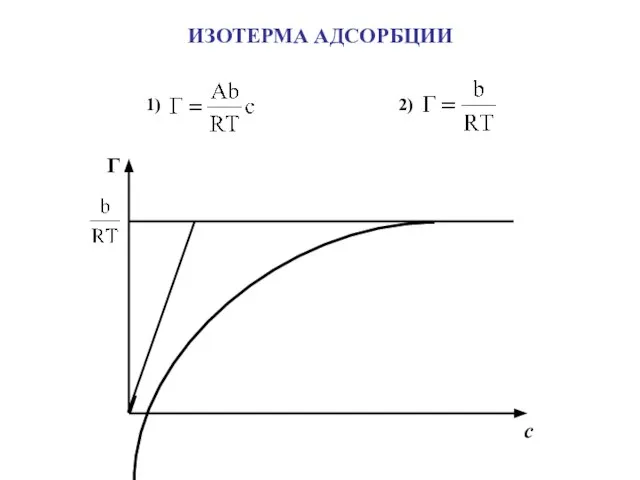
- 14. ИЗОТЕРМА АДСОРБЦИИ Г с
- 15. УРАВНЕНИЕ ЛЕНГМЮРА Г с Гmax/2 1/A Адсорбционная активность (Коэффициенты уравнения Шишковского: b = RTГmax; А =
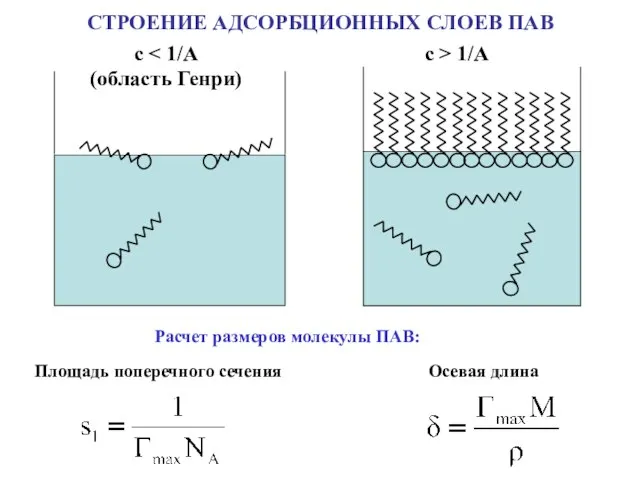
- 16. СТРОЕНИЕ АДСОРБЦИОННЫХ СЛОЕВ ПАВ с (область Генри) с > 1/A Расчет размеров молекулы ПАВ: Площадь поперечного
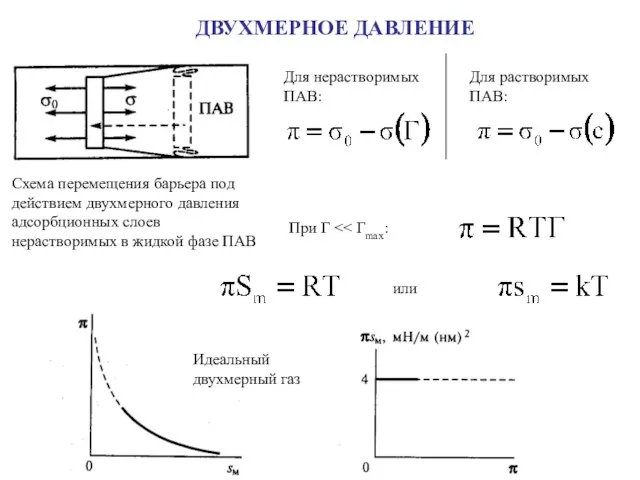
- 17. ДВУХМЕРНОЕ ДАВЛЕНИЕ Схема перемещения барьера под действием двухмерного давления адсорбционных слоев нерастворимых в жидкой фазе ПАВ
- 18. ВАННА ЛЕНГМЮРА Схема прибора Ленгмюра для измерения π адсорбционных слоев нерастворимых ПАВ Учет площади молекул дает:
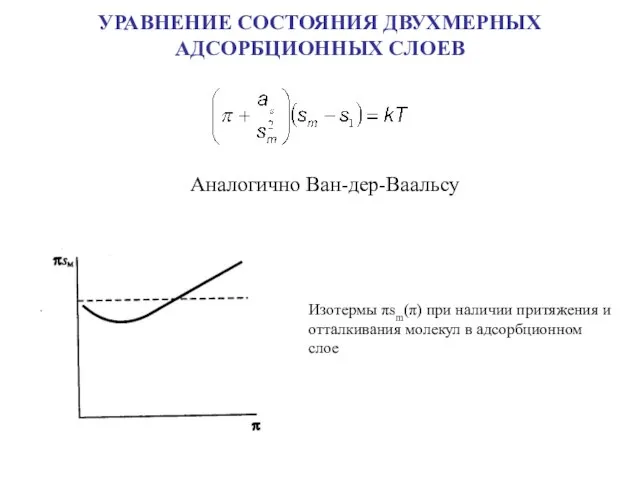
- 19. УРАВНЕНИЕ СОСТОЯНИЯ ДВУХМЕРНЫХ АДСОРБЦИОННЫХ СЛОЕВ Аналогично Ван-дер-Ваальсу Изотермы πsm(π) при наличии притяжения и отталкивания молекул в
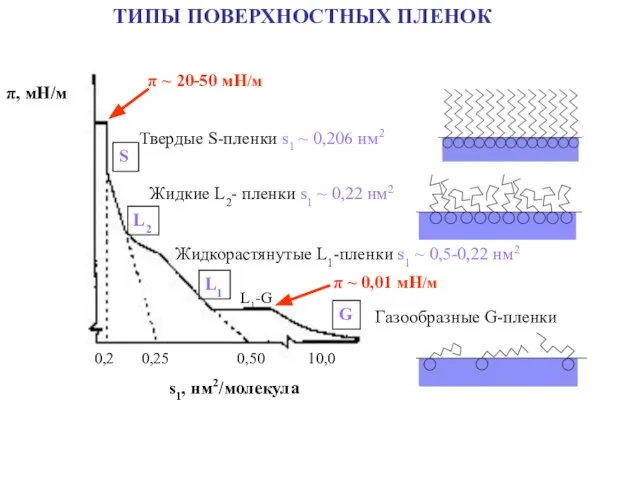
- 20. ТИПЫ ПОВЕРХНОСТНЫХ ПЛЕНОК π, мН/м 0,2 0,25 0,50 10,0 s1, нм2/молекула S L2 L1 L1-G G
- 21. СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2-[[[(2,2-dipentadecyl-1,3-dioxolan-4-yl)methoxy]hydroxyphosphinyl]oxy]-N,N,N-trimethyl-, inner salt
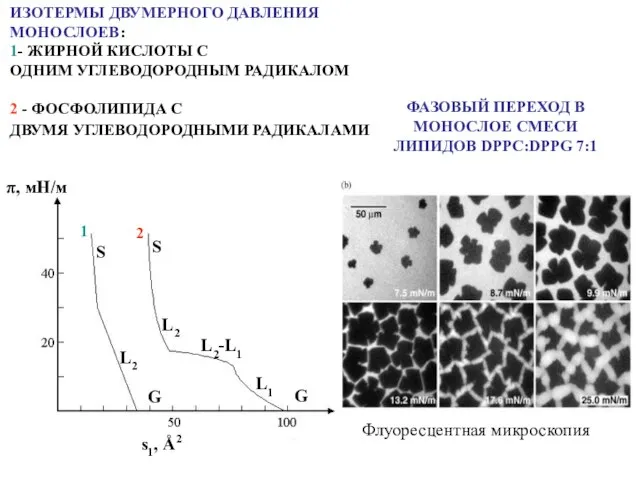
- 22. ИЗОТЕРМЫ ДВУМЕРНОГО ДАВЛЕНИЯ МОНОСЛОЕВ: 1- ЖИРНОЙ КИСЛОТЫ С ОДНИМ УГЛЕВОДОРОДНЫМ РАДИКАЛОМ 2 - ФОСФОЛИПИДА С ДВУМЯ
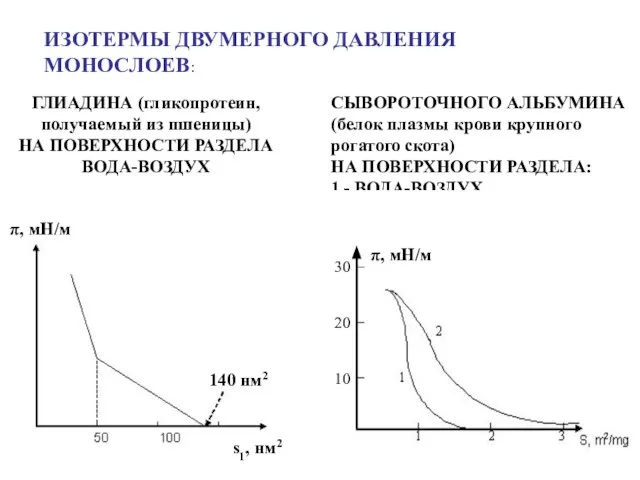
- 23. 140 нм2 s1, нм2 π, мН/м ИЗОТЕРМЫ ДВУМЕРНОГО ДАВЛЕНИЯ МОНОСЛОЕВ: ГЛИАДИНА (гликопротеин, получаемый из пшеницы) НА
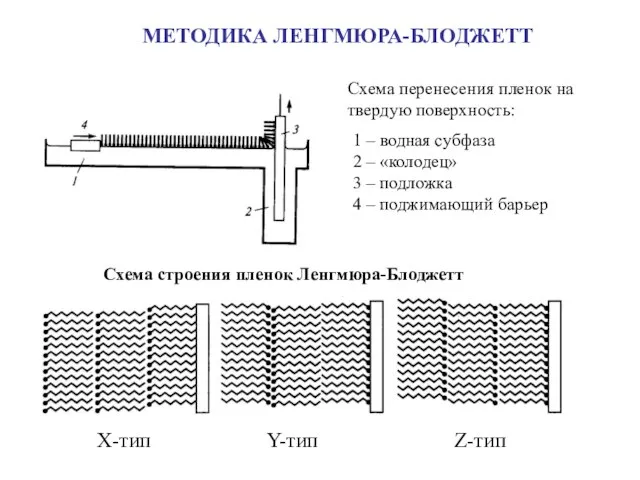
- 24. МЕТОДИКА ЛЕНГМЮРА-БЛОДЖЕТТ Схема перенесения пленок на твердую поверхность: 1 – водная субфаза 2 – «колодец» 3
- 25. АДСОРБЦИЯ НА ГРАНИЦЕ ДВУХ КОНДЕНСИРОВАННЫХ ФАЗ Правило уравнивания полярностей Ребиндера: Для границы 2-х конденсированных фаз поверхностно-активным
- 26. АДСОРБЦИЯ ИЗ РАСТВОРОВ НА ТВЕРДОЙ ПОВЕРХНОСТИ С0 – исходная концентрация ПАВ; С равн – равновесная концентрация
- 28. Скачать презентацию





![СТРУКТУРНАЯ ФОРМУЛА ФОСФОХОЛИНА: Ethanaminium, 2-[[[(2,2-dipentadecyl-1,3-dioxolan-4-yl)methoxy]hydroxyphosphinyl]oxy]-N,N,N-trimethyl-, inner salt](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376496/slide-20.jpg)


 Стандарт cXML в корпоративных приложениях электронной коммерции
Стандарт cXML в корпоративных приложениях электронной коммерции Целл-у-лосс - новинка от Herbalife. Деликатное выведение лишней жидкости из организма
Целл-у-лосс - новинка от Herbalife. Деликатное выведение лишней жидкости из организма Улица Горьковская д. 63. Планируемые мероприятия
Улица Горьковская д. 63. Планируемые мероприятия Организация аварийно-спасательных работ
Организация аварийно-спасательных работ Знаток правил дорожного движения Знаток правил дорожного движения Юсупова Ирина Равиловна МОУ «СОШ 60», г. Набережные Челны.
Знаток правил дорожного движения Знаток правил дорожного движения Юсупова Ирина Равиловна МОУ «СОШ 60», г. Набережные Челны. Контроль якості металів і зварних з'єднань
Контроль якості металів і зварних з'єднань C новым учебным годом!!! 2012/13
C новым учебным годом!!! 2012/13 Презентация на тему Физика твердого тела Кристаллофизика
Презентация на тему Физика твердого тела Кристаллофизика
 посвящение в читатели
посвящение в читатели Строим домик из спичек
Строим домик из спичек Дню Защитника Отечества посвящается
Дню Защитника Отечества посвящается Изобразительность в музыке
Изобразительность в музыке SWOT-анализ
SWOT-анализ Народное прикладное искусство
Народное прикладное искусство Творчы праэкт Humanities Blues
Творчы праэкт Humanities Blues Рудольф Арнхейм
Рудольф Арнхейм Пэчворк
Пэчворк Особенности психологического сопровождения детей с ограниченными возможностями здоровья в условиях ДОУ
Особенности психологического сопровождения детей с ограниченными возможностями здоровья в условиях ДОУ Золотое сечение на Новгородчине
Золотое сечение на Новгородчине 家人
家人 Внешняя политика СССР в 1985-1991 гг
Внешняя политика СССР в 1985-1991 гг Жилищное право
Жилищное право Презентация на тему Социальная сфера презентация
Презентация на тему Социальная сфера презентация Экслибрис. Задание по прикладной композиции
Экслибрис. Задание по прикладной композиции Итоги интернет-урока«LEARNING MORE ABOUT LONDON / УЗНАЕМ БОЛЬШЕ О ЛОНДОНЕ»
Итоги интернет-урока«LEARNING MORE ABOUT LONDON / УЗНАЕМ БОЛЬШЕ О ЛОНДОНЕ» Хить Александр АнатольевичГенеральный директор ООО "Ассистанская компания"Украинская служба помощи" тел. 8 067 630 70 88 e-mail:
Хить Александр АнатольевичГенеральный директор ООО "Ассистанская компания"Украинская служба помощи" тел. 8 067 630 70 88 e-mail:  Олимпийское движение в России
Олимпийское движение в России Мышление. Тест Какой у вас тип мышления
Мышление. Тест Какой у вас тип мышления