Содержание
- 2. Лекция №8 Строение алкенов 2. Номенклатура алкенов 3. Изомерия 4. Способы получения 4.1. Дегалогенирование 4.2. Дегидратация
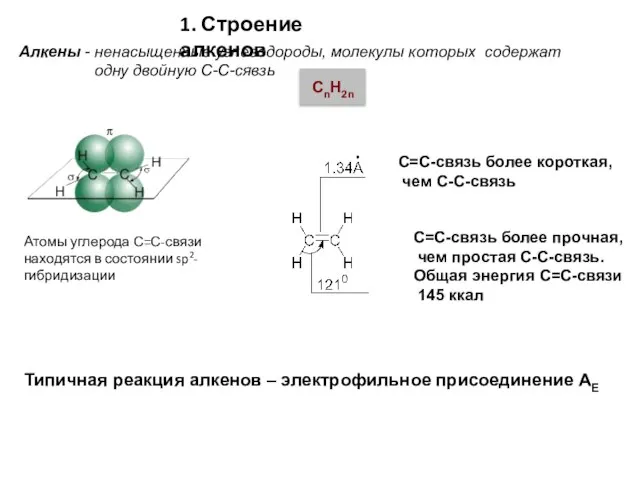
- 3. Атомы углерода С=С-связи находятся в состоянии sp2-гибридизации С=С-связь более короткая, чем С-С-связь С=С-связь более прочная, чем
- 4. 2. Номенклатура алкенов Неразветвленную цепь нумеруют с того конца, ближе к которому находится двойная связь. Суффикс
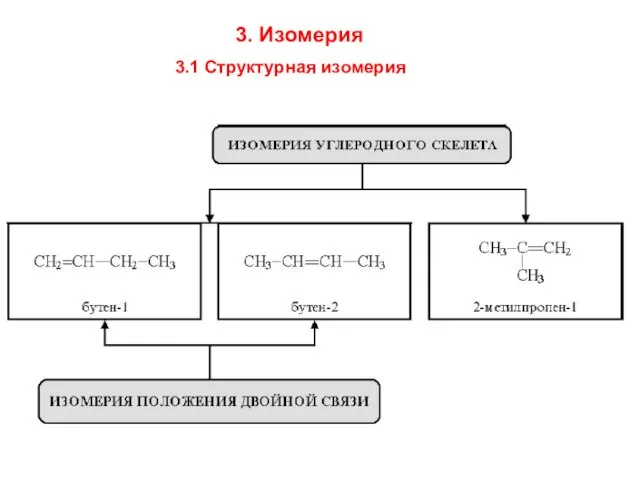
- 5. 3. Изомерия 3.1 Структурная изомерия
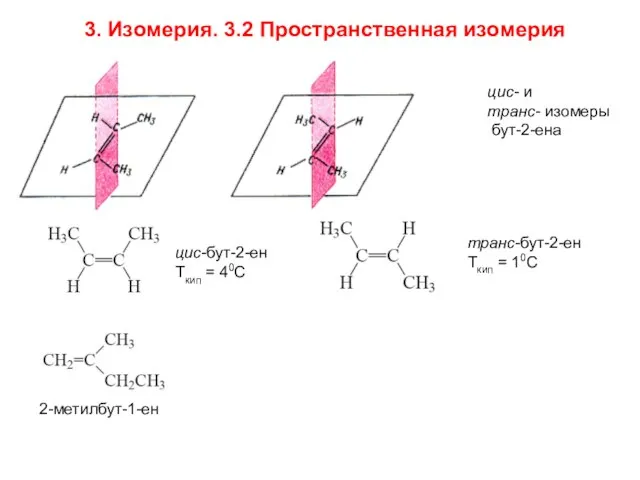
- 6. цис- и транс- изомеры бут-2-ена цис-бут-2-ен Ткип = 40С транс-бут-2-ен Ткип = 10С 2-метилбут-1-ен 3. Изомерия.
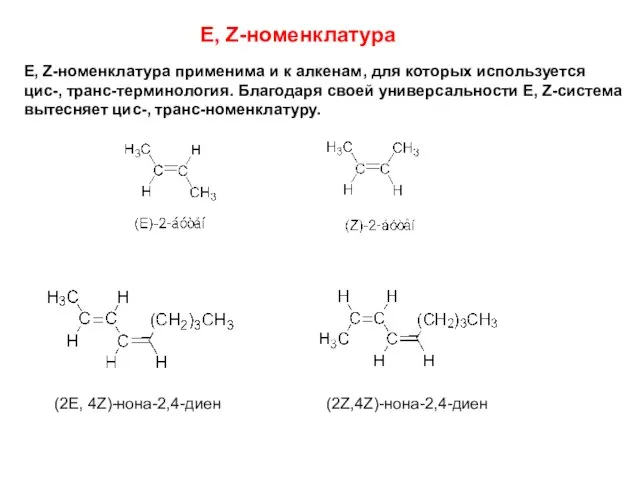
- 7. 3.2 Пространственная изомерия E, Z-номенклатура Используя систему Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и
- 8. E, Z-номенклатура E, Z-номенклатура применима и к алкенам, для которых используется цис-, транс-терминология. Благодаря своей универсальности
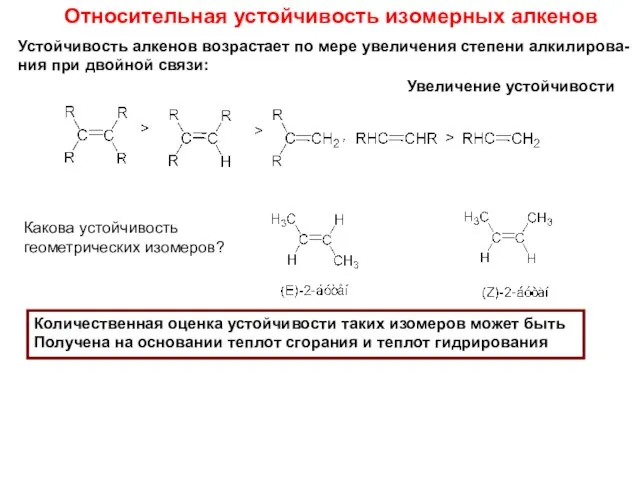
- 9. Относительная устойчивость изомерных алкенов Устойчивость алкенов возрастает по мере увеличения степени алкилирова- ния при двойной связи:
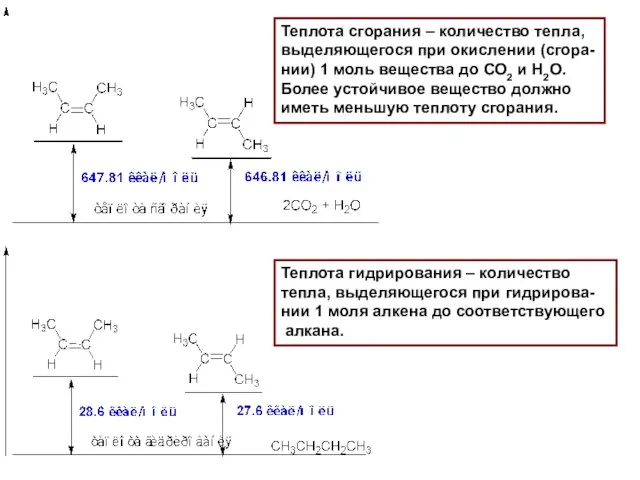
- 10. Теплота сгорания – количество тепла, выделяющегося при окислении (сгора- нии) 1 моль вещества до СО2 и
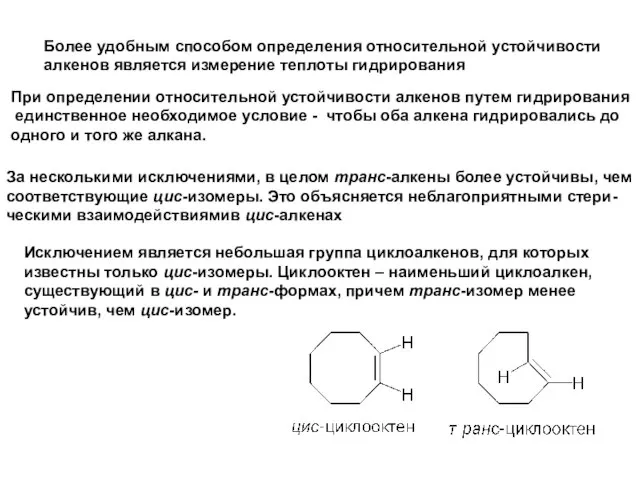
- 11. Более удобным способом определения относительной устойчивости алкенов является измерение теплоты гидрирования При определении относительной устойчивости алкенов
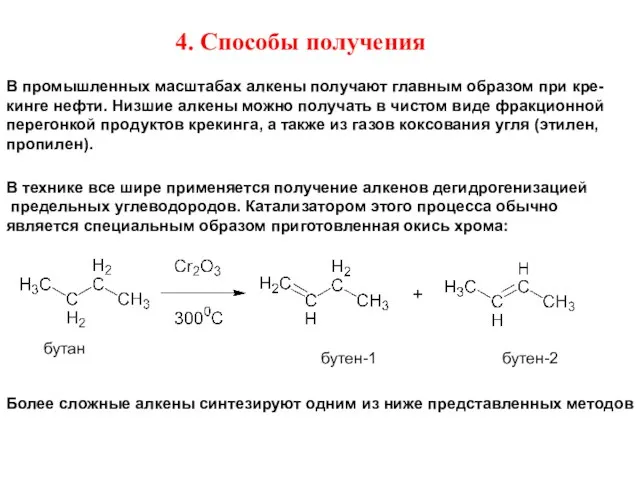
- 12. 4. Способы получения В промышленных масштабах алкены получают главным образом при кре- кинге нефти. Низшие алкены
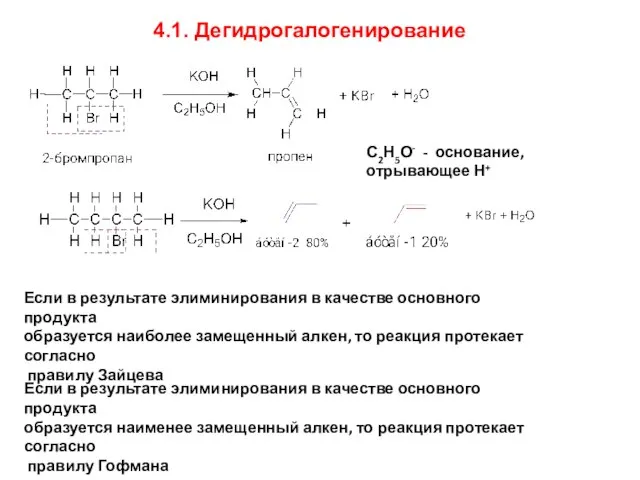
- 13. 4.1. Дегидрогалогенирование С2Н5О- - основание, отрывающее Н+ Если в результате элиминирования в качестве основного продукта образуется
- 14. Зайцев или Гофман? Направление элиминирования Y = Hal, N+R’3, S+R’2 Элиминирование из четвертичных аммонийных солей или
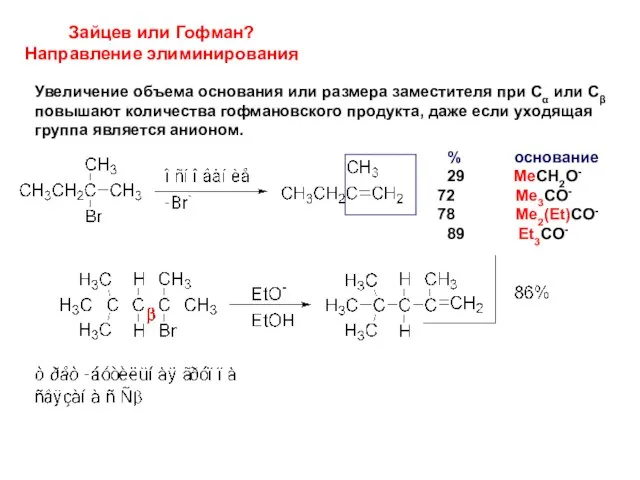
- 15. Зайцев или Гофман? Направление элиминирования Увеличение объема основания или размера заместителя при Сα или Сβ повышают
- 16. 4.2. Дегидратация спиртов В качестве кислоты используют H2SO4 или H3PO4. Реакцию ведут при t= около 2000С,
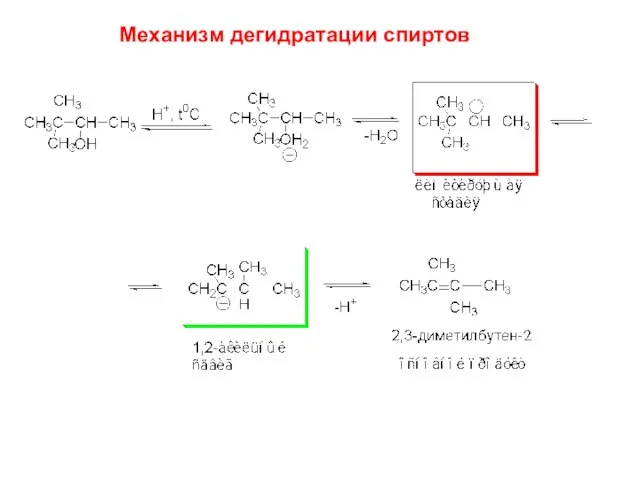
- 17. Механизм дегидратации спиртов
- 18. 4.3. Дегалогенирование вицинальных дигалогенидов Реакция идет так же в присутствие LiALH4 или тиосульфата натрия в ДМСО
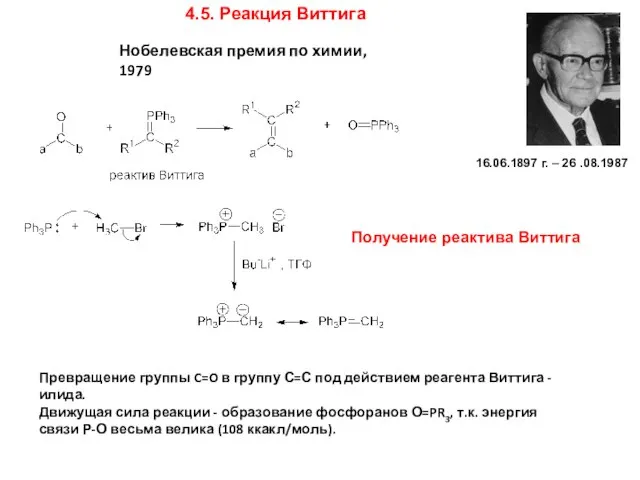
- 19. 4.5. Реакция Виттига Превращение группы C=O в группу С=С под действием реагента Виттига - илида. Движущая
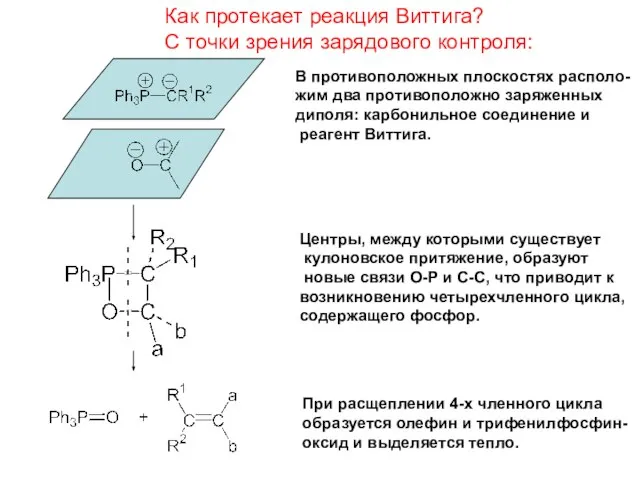
- 20. Как протекает реакция Виттига? С точки зрения зарядового контроля: В противоположных плоскостях располо- жим два противоположно
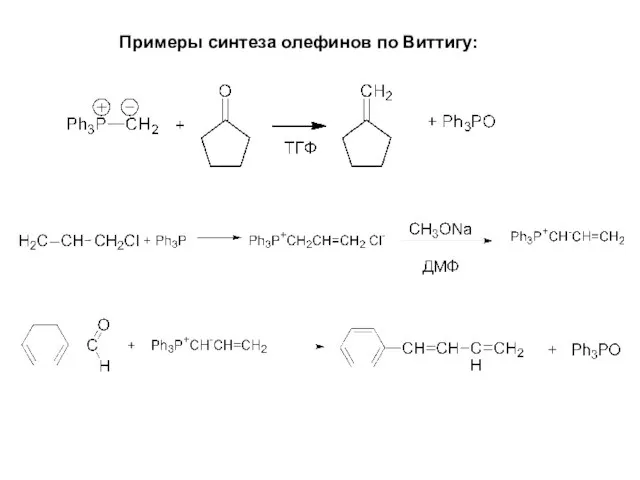
- 21. Примеры синтеза олефинов по Виттигу:
- 23. Скачать презентацию






 День работников пищевой промышленностиИтоги
День работников пищевой промышленностиИтоги Права и свободы человека и гражданина. Обязанности граждан РФ
Права и свободы человека и гражданина. Обязанности граждан РФ Сергей Есенин
Сергей Есенин Как медитировать, где угодно, когда угодно. Пошаговая программа знакомства с медитацией для начинающих
Как медитировать, где угодно, когда угодно. Пошаговая программа знакомства с медитацией для начинающих Индустриализация
Индустриализация Экологические факторы и их виды
Экологические факторы и их виды Русские народные костюмы
Русские народные костюмы Музыкальный шаблон для презентации
Музыкальный шаблон для презентации Панов Александр Васильевич, д.б.н. Научный Сотрудник Лаборатории Маркеров Мозга, WellStar College of Health & Human Services, Kennesaw State University, Kennesaw, Georgia 3
Панов Александр Васильевич, д.б.н. Научный Сотрудник Лаборатории Маркеров Мозга, WellStar College of Health & Human Services, Kennesaw State University, Kennesaw, Georgia 3 Презентация на тему Представление числовой информации в компьютере
Презентация на тему Представление числовой информации в компьютере  Художники-иллюстраторы
Художники-иллюстраторы Софья Ковалевская
Софья Ковалевская Зарождение геометрии
Зарождение геометрии Презентація
Презентація Рыжий муравей
Рыжий муравей Водные артерии России
Водные артерии России Firmensortiment
Firmensortiment «Сократ: Как ты скажешь, Гиппий,вред или польза для государства закон?Гиппий: Устанавливается закон, я думаю,ради пользы: иногда ж
«Сократ: Как ты скажешь, Гиппий,вред или польза для государства закон?Гиппий: Устанавливается закон, я думаю,ради пользы: иногда ж Our future
Our future Контроллеры для систем вентиляции и кондиционирования
Контроллеры для систем вентиляции и кондиционирования Веков связующая нить: приобщение к традиционной культуре в музее
Веков связующая нить: приобщение к традиционной культуре в музее Баскетбол
Баскетбол О подвигах, о доблести и славе…
О подвигах, о доблести и славе… Обеспечение личной безопасности в экстремальных и опасных ситуациях
Обеспечение личной безопасности в экстремальных и опасных ситуациях Зачем взламывают веб-сайты? Доступно о ботнет сетях и монетизации интернет-преступности
Зачем взламывают веб-сайты? Доступно о ботнет сетях и монетизации интернет-преступности Класс 1-1 3주 후 시험문제 읽기 Чтение
Класс 1-1 3주 후 시험문제 읽기 Чтение МАРКЕТИНГ В ЭПОХУ РЕЦЕССИИ: ЧЕМ ПРИМАНИТЬ ПОТРЕБИТЕЛЯ?
МАРКЕТИНГ В ЭПОХУ РЕЦЕССИИ: ЧЕМ ПРИМАНИТЬ ПОТРЕБИТЕЛЯ? РЕЗЮМЕБИЗНЕС – ПЛАНАКОМПЛЕКСНОГО ТЕХНОЛОГИЧЕСКОГО ПЕРЕВООРУЖЕНИЯ ЗАО «ЗАВОД МИКРОЭЛЕКТРОНИКИ «РЕЛА»
РЕЗЮМЕБИЗНЕС – ПЛАНАКОМПЛЕКСНОГО ТЕХНОЛОГИЧЕСКОГО ПЕРЕВООРУЖЕНИЯ ЗАО «ЗАВОД МИКРОЭЛЕКТРОНИКИ «РЕЛА»