Содержание
- 2. АЛЮМИНИЙ. нахождение в природе Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O
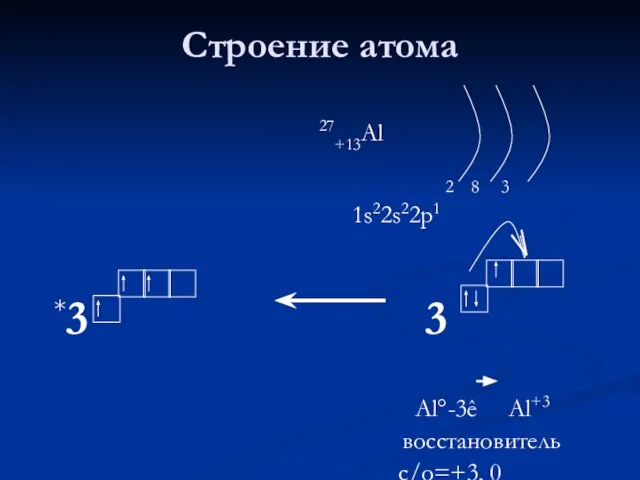
- 3. Строение атома 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê Al+3 восстановитель с/о=+3, 0
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА Al-серебристо-белый металл Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы), легкий (плотность
- 5. ХИМИЧЕСКИЕ СВОЙСТВА Al – активный металл. На воздухе всегда покрыт пленкой Al2O3. Поэтому при обычных условиях
- 6. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ При нагревании Взаимодействие с углеродом: 4Al+3C=Al4C3 (1500-1700°C) Взаимодействие с серой: 2Al+3S= Al2S3
- 7. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) Al +H2O=Al(OH)3 +H2 Подберите коэффициенты
- 8. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует
- 9. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует
- 10. Взаимодействие со сложными веществами Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует
- 11. Алюминий при обычных условиях не взаимодействует с концентрированными H2SO4 и HNO3
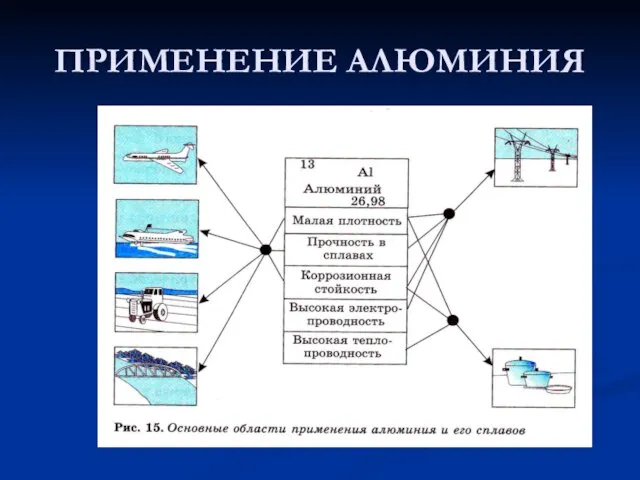
- 12. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 13. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 14. Домашнее задание § 13 (до соединений алюминия) Работа с текстом конспекта Подберите коэффициенты методом электронного баланса:
- 16. Скачать презентацию











 Проблема домашнего насилия
Проблема домашнего насилия Труд людей весной
Труд людей весной Краткая инструкция
Краткая инструкция Психология
Психология Результаты исследования промо индустрии
Результаты исследования промо индустрии Культурно-информационный центр развития социальной активности населения
Культурно-информационный центр развития социальной активности населения произведения крупной формы
произведения крупной формы Что такое мужество…
Что такое мужество… Методика расследования пищевых отравлений в воинских частях
Методика расследования пищевых отравлений в воинских частях Дагестан. Основные достопримечательности
Дагестан. Основные достопримечательности Итальянцы в России. Конец XIX века
Итальянцы в России. Конец XIX века Қарағанды Мемлекеттік Медицина Университеті №2 Хирургиялық аурулар кафедрасы СӨЖ Тақырыбы: Хирургиялық тігістердің түрлері, т
Қарағанды Мемлекеттік Медицина Университеті №2 Хирургиялық аурулар кафедрасы СӨЖ Тақырыбы: Хирургиялық тігістердің түрлері, т Деление окружности, сопряжения
Деление окружности, сопряжения Образец оформления презентации для выступления
Образец оформления презентации для выступления Типы обществ
Типы обществ Презентация на тему Организация профессиональной педагогической поддержки
Презентация на тему Организация профессиональной педагогической поддержки pr. interm 27.09
pr. interm 27.09 Мы поздравляем наших мам!
Мы поздравляем наших мам! Денотатный граф
Денотатный граф Макарова И.В.
Макарова И.В. Презентация на тему "Механизмы реализации ФГОС на основе системно- деятельностного подхода Л.Г. Петерсон с позиции непрерывност
Презентация на тему "Механизмы реализации ФГОС на основе системно- деятельностного подхода Л.Г. Петерсон с позиции непрерывност «Звёздное небо»
«Звёздное небо» Презентация на тему ПОНЯТИЕ О ПРИЧАСТНОМ ОБОРОТЕ
Презентация на тему ПОНЯТИЕ О ПРИЧАСТНОМ ОБОРОТЕ  Менеджмент
Менеджмент  Живописная композиция в интерьере с небольшим количеством персонажей
Живописная композиция в интерьере с небольшим количеством персонажей Әлифба. Жж-Шш
Әлифба. Жж-Шш Презентация на тему Безопасность на транспорте
Презентация на тему Безопасность на транспорте Интегрированные решения компаний TRADOS и ПРОМТ - залог успешного бизнеса
Интегрированные решения компаний TRADOS и ПРОМТ - залог успешного бизнеса