Содержание
- 2. Аминокислоты и пептиды Белки – природные высокомолекулярные полимеры, состоящие из остатков α-аминокарбоновых кислот, связанных амидной (пептидной)
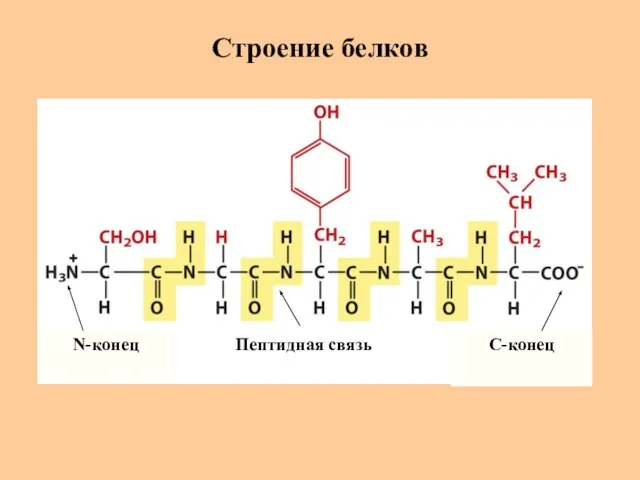
- 3. Строение белков N-конец C-конец Пептидная связь
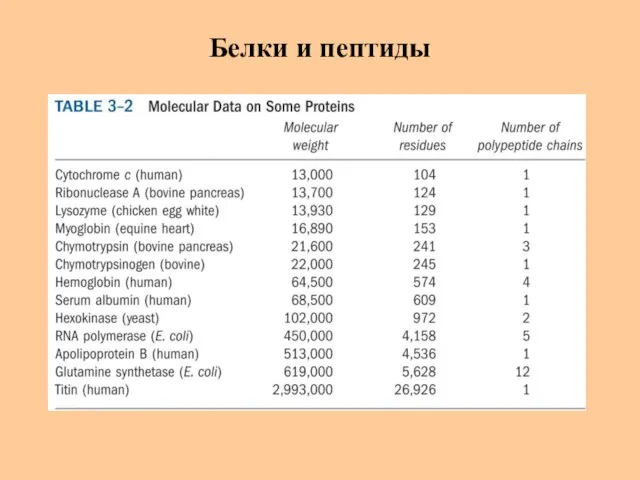
- 4. Белки и пептиды
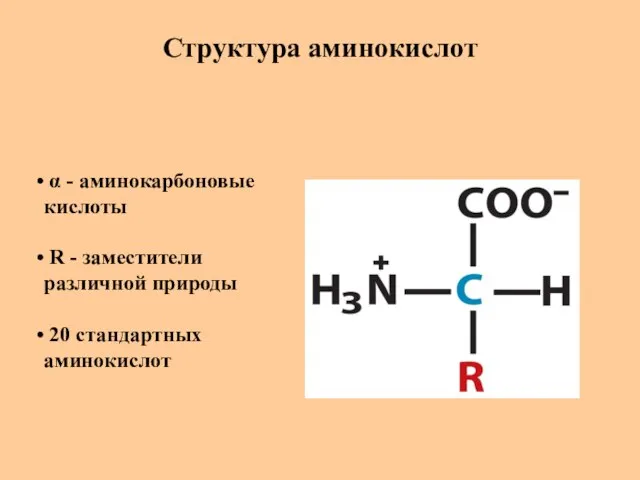
- 5. Структура аминокислот α - аминокарбоновые кислоты R - заместители различной природы 20 стандартных аминокислот
- 6. Структура аминокислот
- 7. Стандартные аминокислоты (20 а.к.) Глицин (Gly) Аланин (Ala) Пролин (Pro) Валин (Val) Метионин (Met) Изолейцин (Ile)
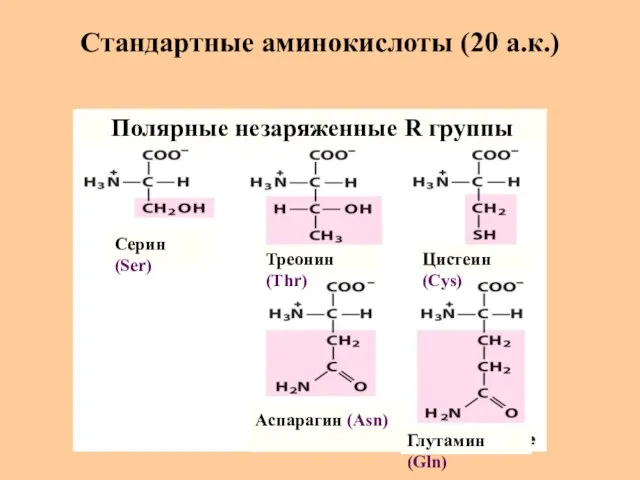
- 8. Стандартные аминокислоты (20 а.к.) Серин (Ser) Треонин (Thr) Цистеин (Cys) Глутамин (Gln) Аспарагин (Asn) Полярные незаряженные
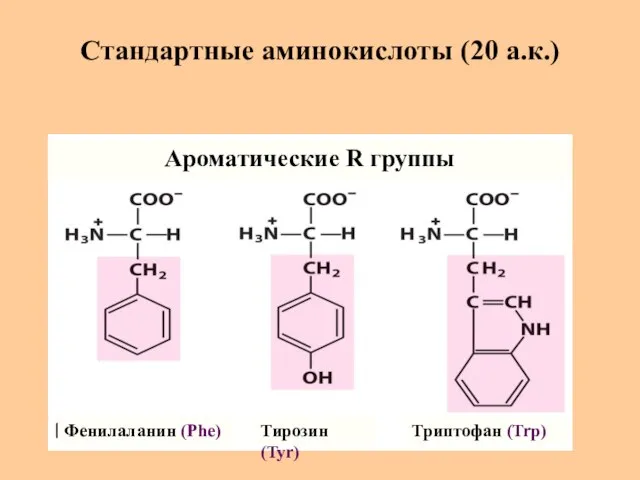
- 9. Стандартные аминокислоты (20 а.к.) Фенилаланин (Phe) Тирозин (Tyr) Триптофан (Trp) Ароматические R группы
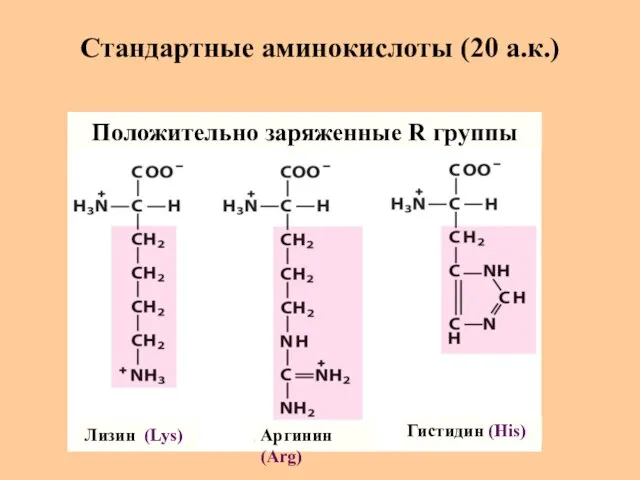
- 10. Стандартные аминокислоты (20 а.к.) Лизин (Lys) Аргинин (Arg) Гистидин (His) Положительно заряженные R группы
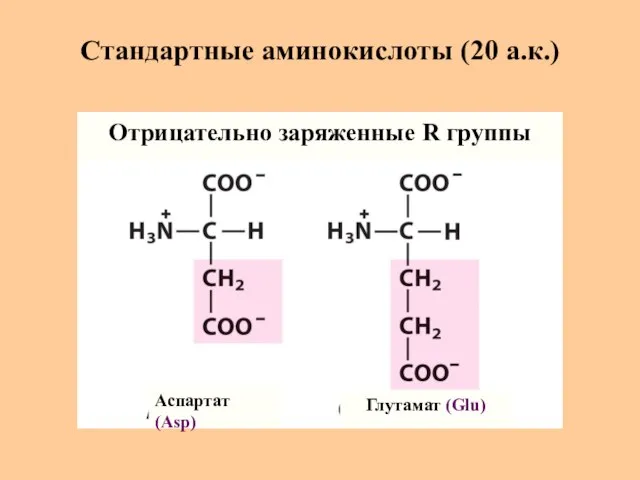
- 11. Стандартные аминокислоты (20 а.к.) Аспартат (Asp) Глутамат (Glu) Отрицательно заряженные R группы
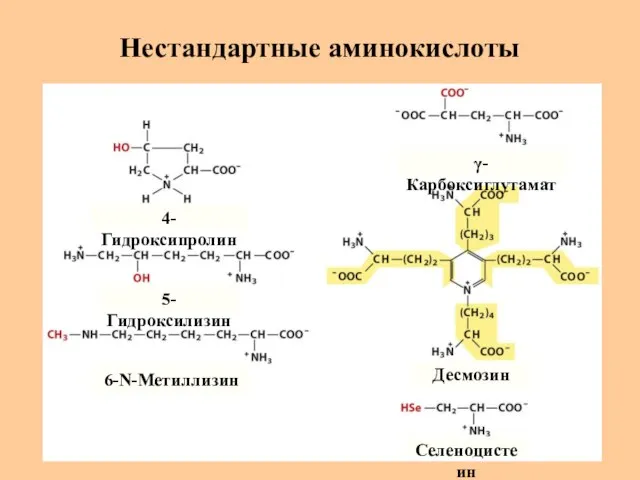
- 12. Нестандартные аминокислоты 4-Гидроксипролин 5-Гидроксилизин 6-N-Метиллизин γ-Карбоксиглутамат Десмозин Селеноцистеин
- 13. Открытие аминокислот в составе белков Аминокислота Год Источник Кто впервые выделил Глицин 1820 Желатина А. Браконно
- 14. Классификация аминокислот По химической структуре По отношению к воде (гидрофильные и гидрофобные) По кислотно-основным свойствам: Кислые
- 15. Физические свойства аминокислот Белые кристаллические вещества Имеют высокие и нехарактерные Тпл., разлагаются при Т > 200°С
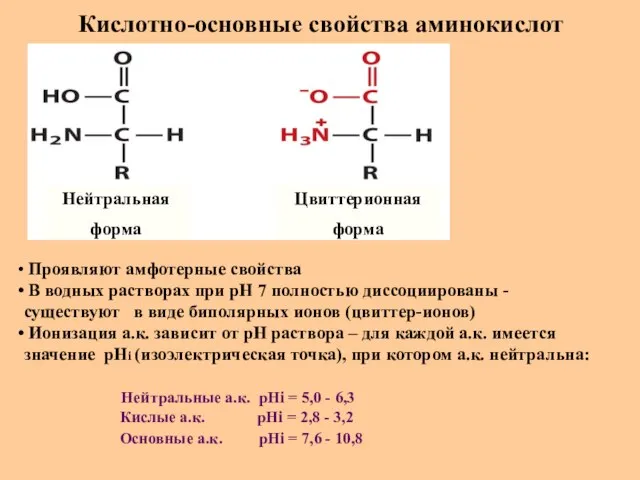
- 16. Кислотно-основные свойства аминокислот Нейтральная форма Цвиттерионная форма Проявляют амфотерные свойства В водных растворах при рН 7
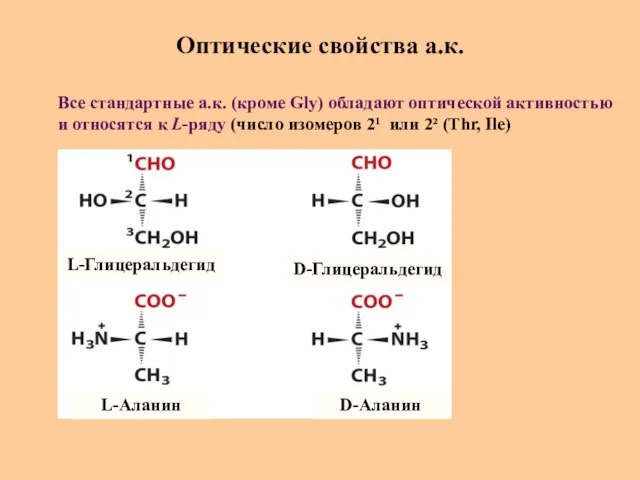
- 17. Оптические свойства а.к. L-Глицеральдегид L-Аланин D-Глицеральдегид D-Аланин Все стандартные а.к. (кроме Gly) обладают оптической активностью и
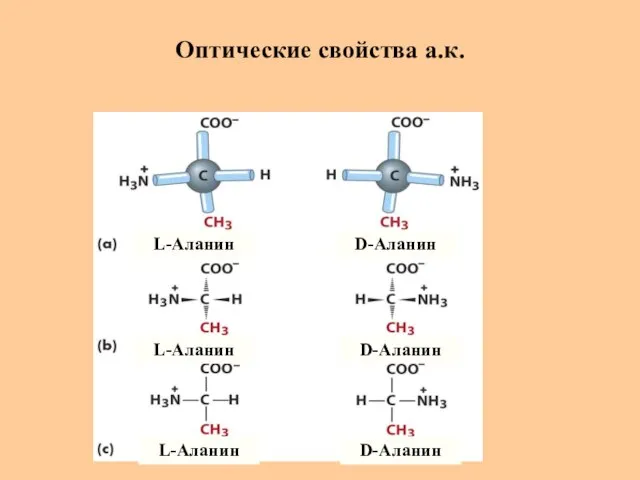
- 18. Оптические свойства а.к. L-Аланин L-Аланин L-Аланин D-Аланин D-Аланин D-Аланин
- 19. Особенности Cys Цистеин Цистеин Цистин В составе белка остатки Cys подвергаются самопроизвольному окислению с образованием дисульфидных
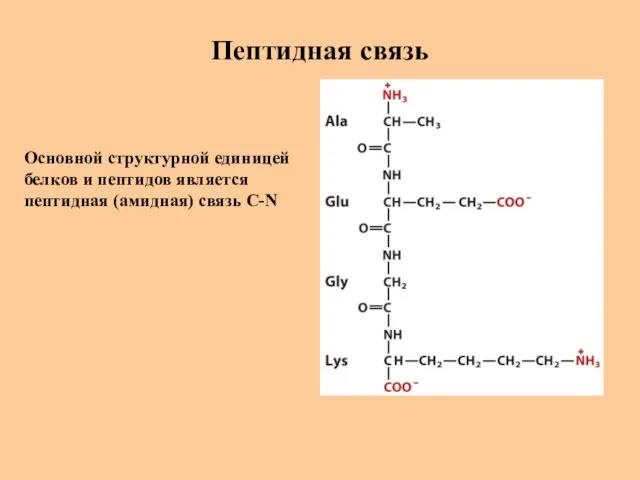
- 20. Пептидная связь Основной структурной единицей белков и пептидов является пептидная (амидная) связь C-N
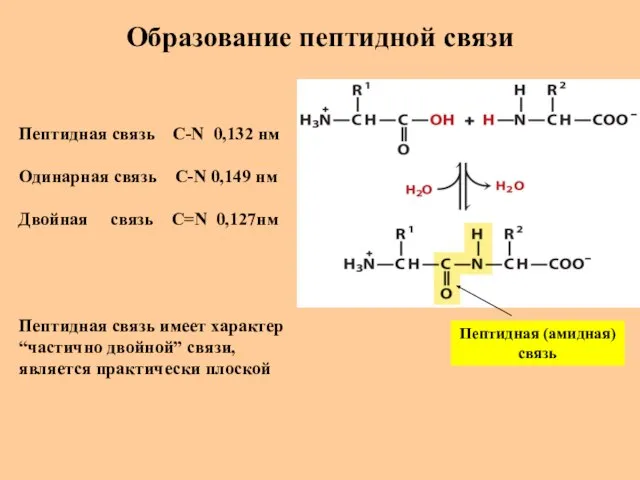
- 21. Образование пептидной связи Пептидная (амидная) связь Пептидная связь C-N 0,132 нм Одинарная связь C-N 0,149 нм
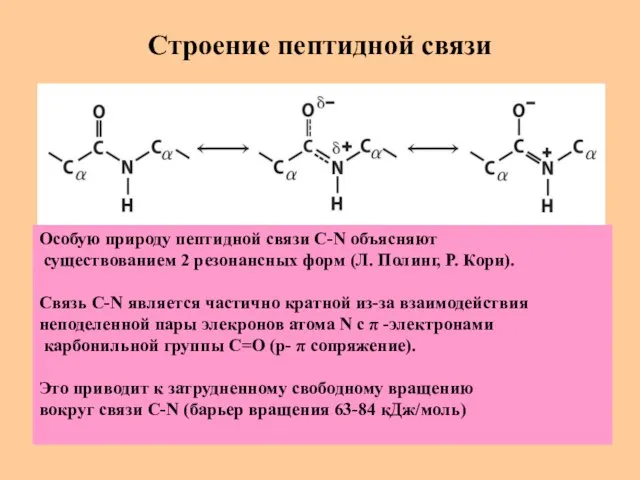
- 22. Строение пептидной связи Особую природу пептидной связи C-N объясняют существованием 2 резонансных форм (Л. Полинг, Р.
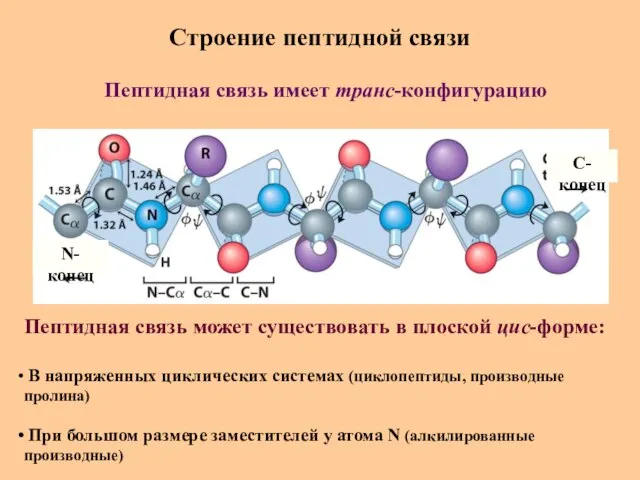
- 23. Строение пептидной связи N-конец C-конец Пептидная связь имеет транс-конфигурацию Пептидная связь может существовать в плоской цис-форме:
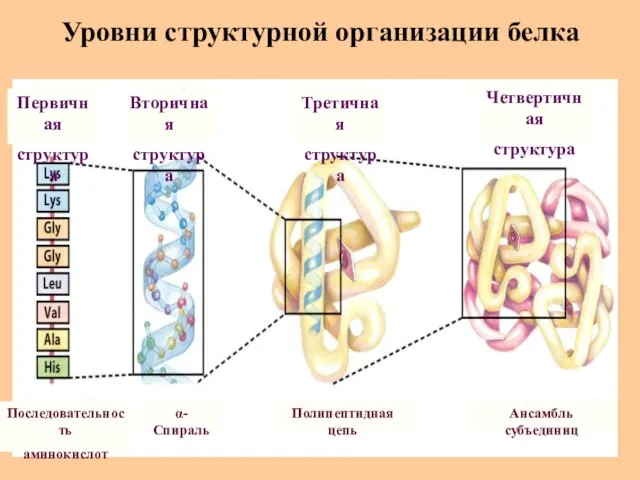
- 24. Уровни структурной организации белка Первичная структура Последовательность аминокислот α-Спираль Полипептидная цепь Ансамбль субъединиц Вторичная структура Третичная
- 25. Первичная структура белка Первичная структура белка – это аминокислотная последовательность белка, т.е. состав и расположение а.к.
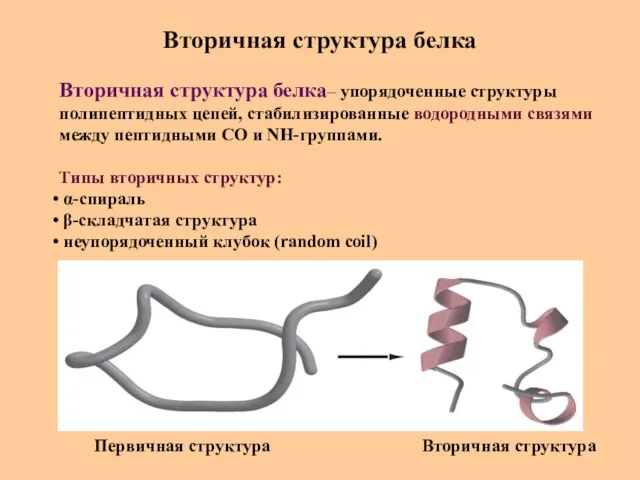
- 26. Вторичная структура белка Вторичная структура белка– упорядоченные структуры полипептидных цепей, стабилизированные водородными связями между пептидными СО
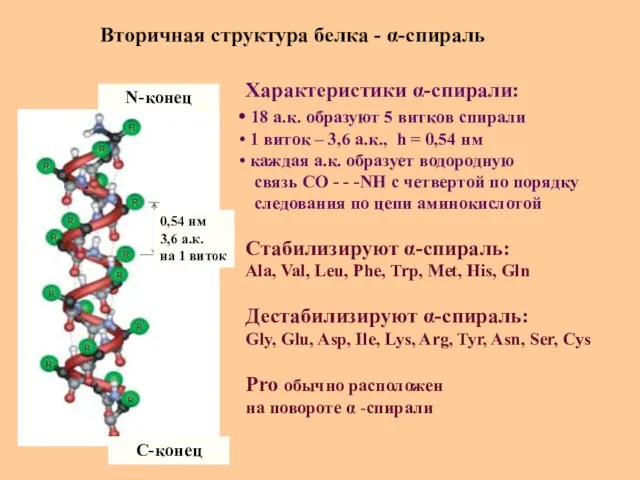
- 27. Вторичная структура белка - α-спираль N-конец C-конец 0,54 нм 3,6 а.к. на 1 виток Характеристики α-спирали:
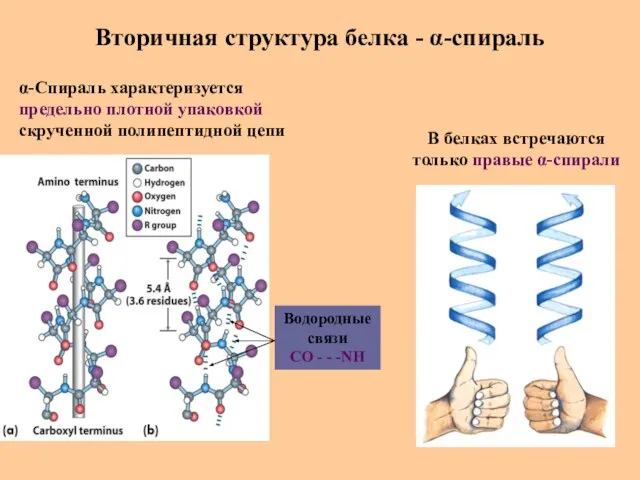
- 28. Вторичная структура белка - α-спираль В белках встречаются только правые α-спирали α-Спираль характеризуется предельно плотной упаковкой
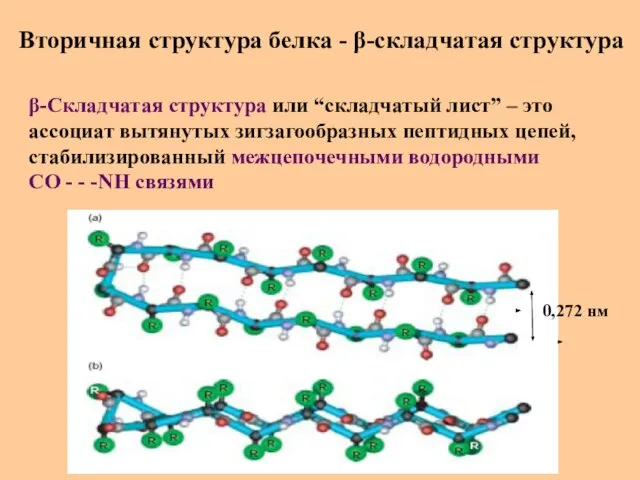
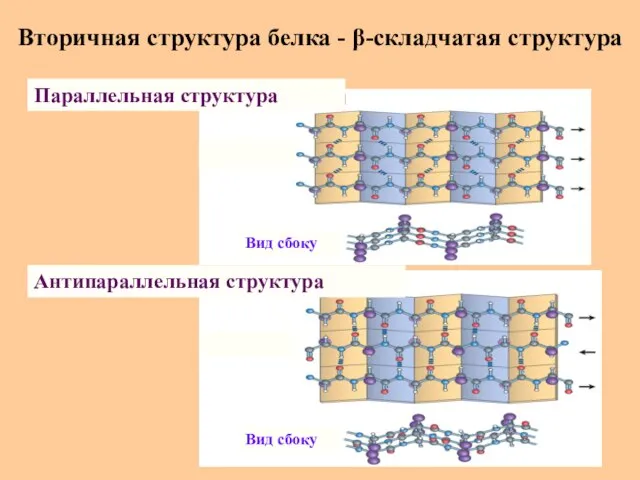
- 29. Вторичная структура белка - β-складчатая структура β-Складчатая структура или “складчатый лист” – это ассоциат вытянутых зигзагообразных
- 30. Вторичная структура белка - β-складчатая структура Параллельная структура Антипараллельная структура Вид сбоку Вид сбоку
- 31. Сверхвторичная структура белка Сверхвторичная структура – наличие ансамблей взаимодействующих между собой вторичных структур. Пример – агрегация
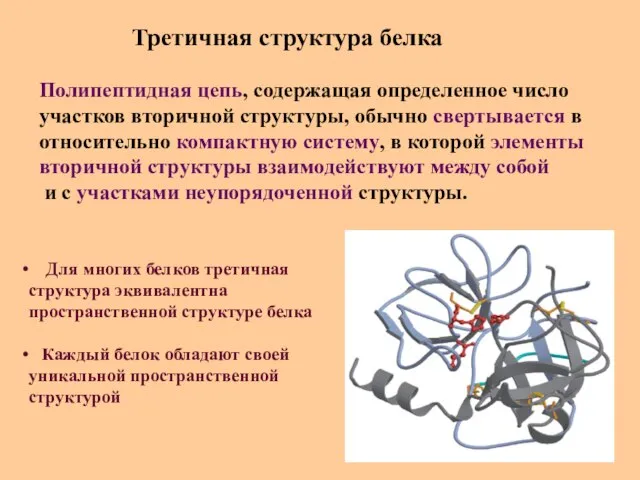
- 32. Третичная структура белка Полипептидная цепь, содержащая определенное число участков вторичной структуры, обычно свертывается в относительно компактную
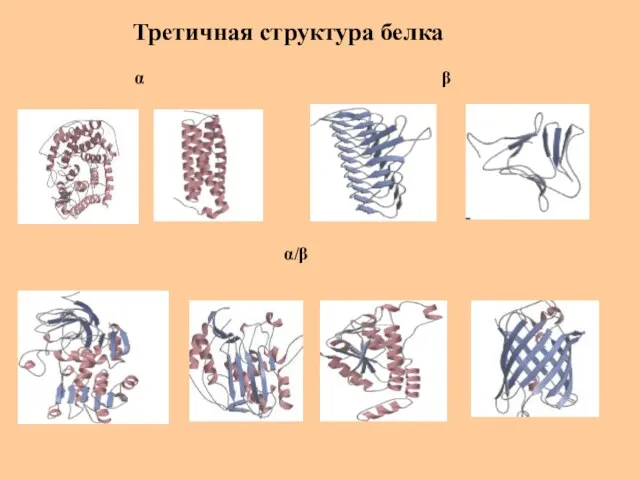
- 33. Третичная структура белка α β α/β
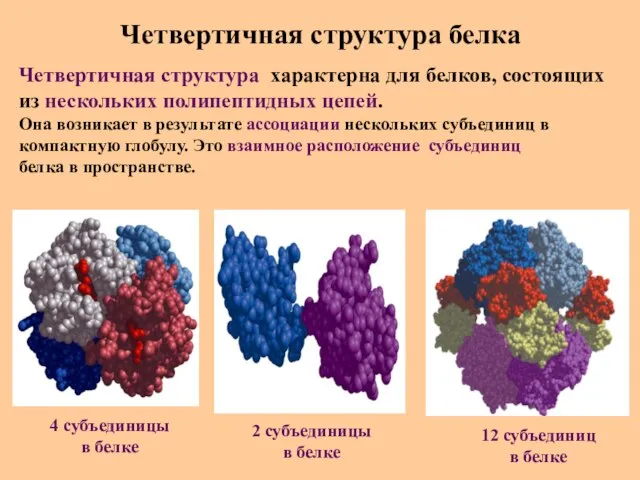
- 34. Четвертичная структура белка Четвертичная структура характерна для белков, состоящих из нескольких полипептидных цепей. Она возникает в
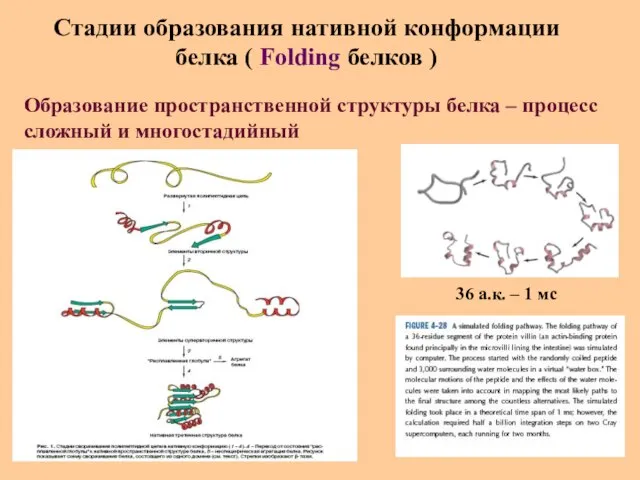
- 35. Стадии образования нативной конформации белка ( Folding белков ) Образование пространственной структуры белка – процесс сложный
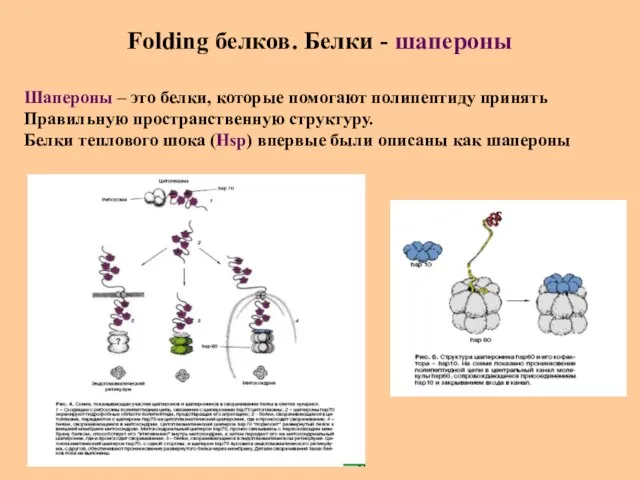
- 36. Folding белков. Белки - шапероны Шапероны – это белки, которые помогают полипептиду принять Правильную пространственную структуру.
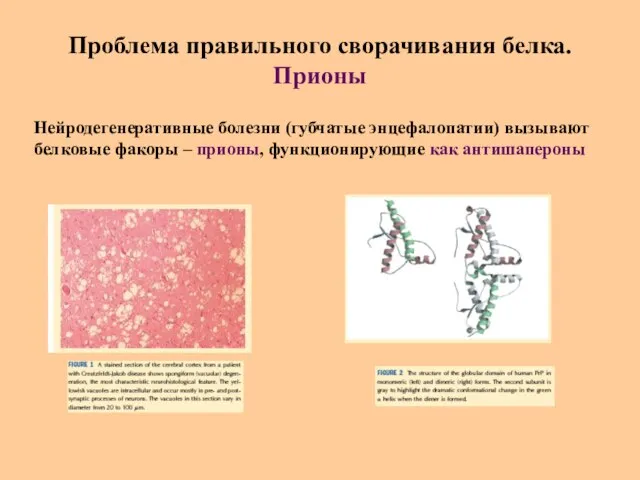
- 37. Проблема правильного сворачивания белка. Прионы Нейродегенеративные болезни (губчатые энцефалопатии) вызывают белковые факоры – прионы, функционирующие как
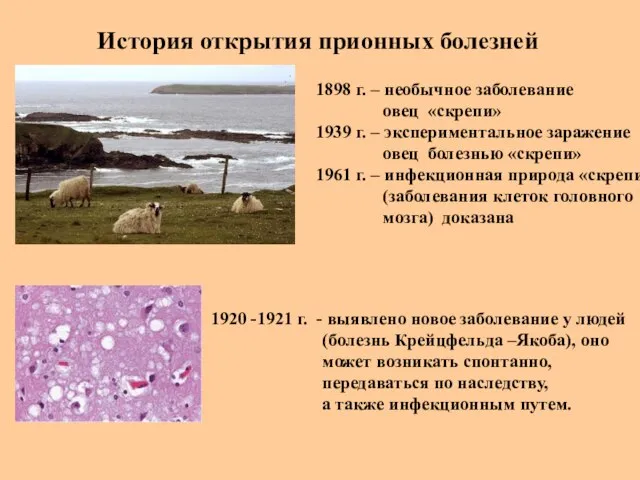
- 38. История открытия прионных болезней 1898 г. – необычное заболевание овец «скрепи» 1939 г. – экспериментальное заражение
- 39. История открытия прионных болезней 1955 -1957 гг. , Папуа-Новая Гвинея - «куру» («смеющаяся смерть»), новое эндемичное
- 40. Открытие прионов 1998 г., С.Б. Прузинер - Нобелевская премия за открытие прионов Прионы - это особые
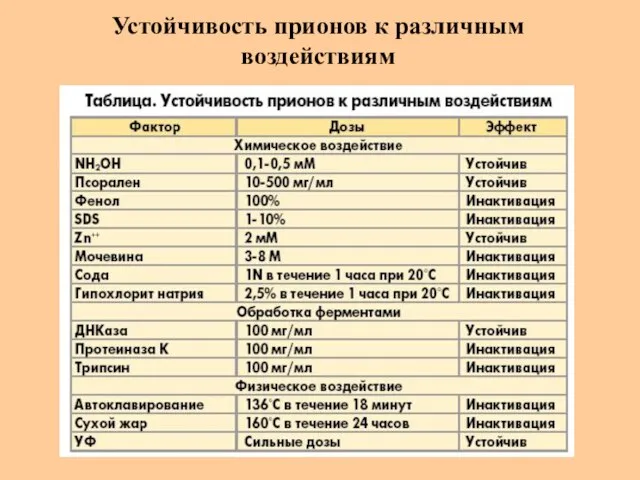
- 41. Устойчивость прионов к различным воздействиям
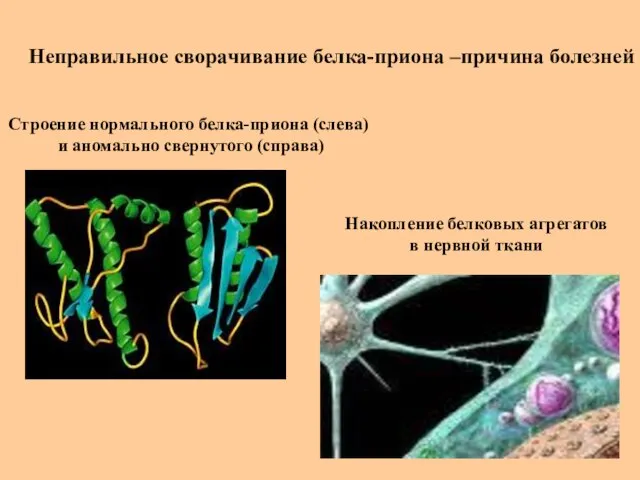
- 42. Неправильное сворачивание белка-приона –причина болезней Накопление белковых агрегатов в нервной ткани Строение нормального белка-приона (слева) и
- 43. Прионные болезни человека и животных
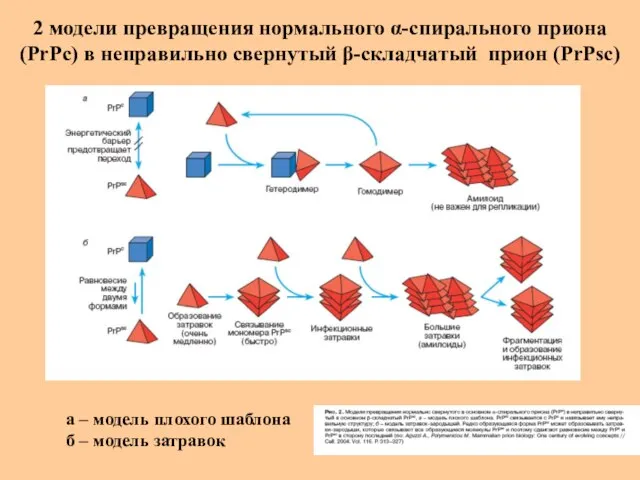
- 44. 2 модели превращения нормального α-спирального приона (РrРс) в неправильно свернутый β-складчатый прион (РrPsc) а – модель
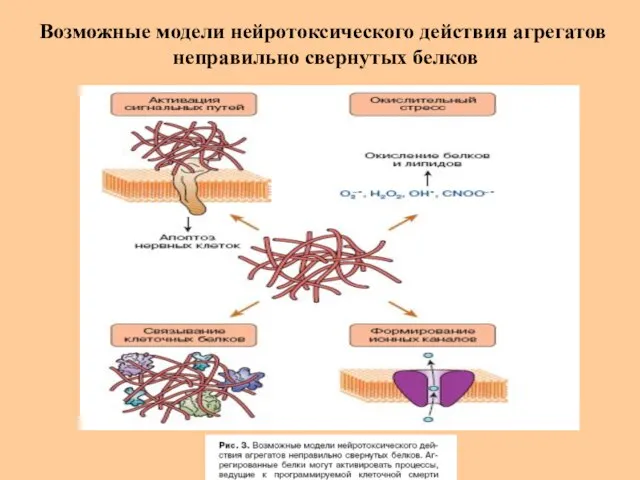
- 45. Возможные модели нейротоксического действия агрегатов неправильно свернутых белков
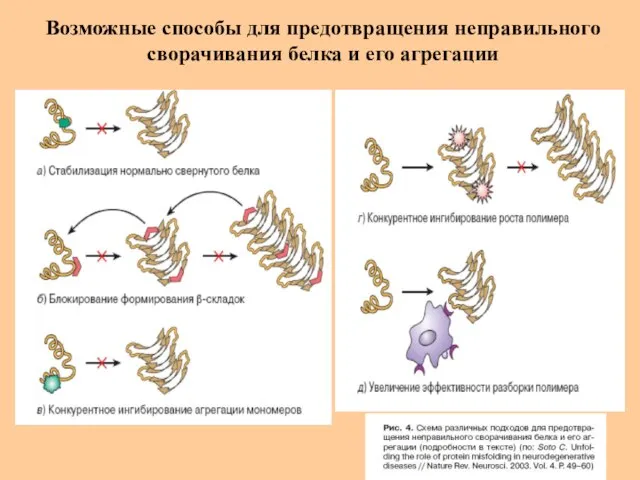
- 46. Возможные способы для предотвращения неправильного сворачивания белка и его агрегации
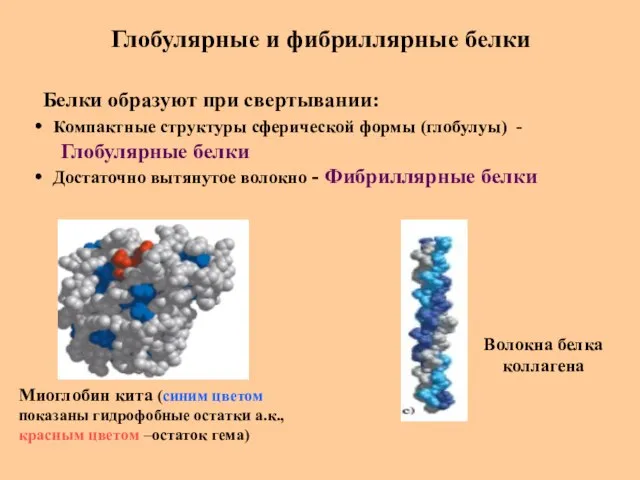
- 47. Глобулярные и фибриллярные белки Белки образуют при свертывании: Компактные структуры сферической формы (глобулуы) - Глобулярные белки
- 48. Глобулярные и фибриллярные белки Глобулярные белки: более сложные по конформации, чем фибриллярные белки способны выполнять самые
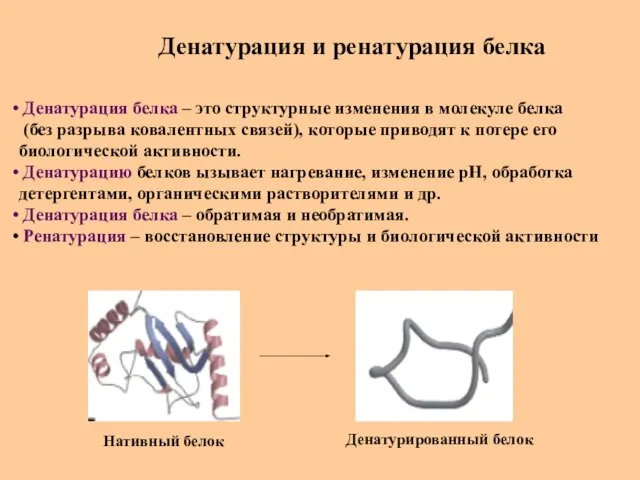
- 49. Денатурация и ренатурация белка Денатурация белка – это структурные изменения в молекуле белка (без разрыва ковалентных
- 50. Как определить структуру белка РСА (третичная и четвертичная структура) Методы КД и ДОВ (вторичная структура) ИК-
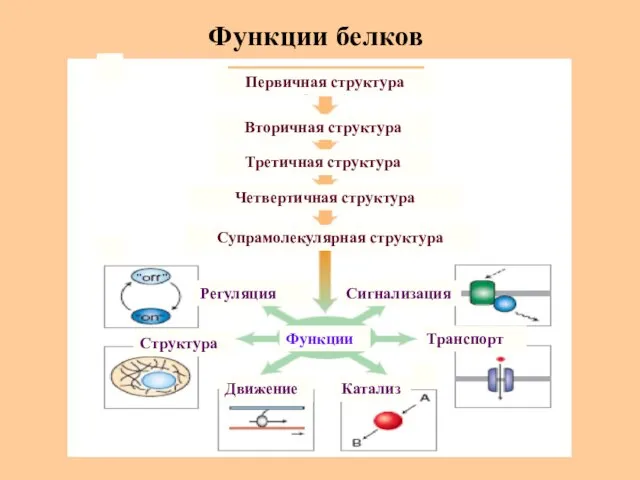
- 51. Функции белков Регуляция Движение Структура Катализ Транспорт Сигнализация Третичная структура Вторичная структура Первичная структура Четвертичная структура
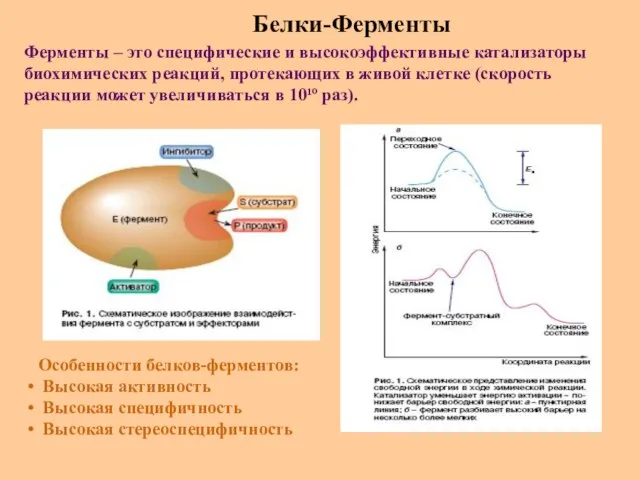
- 52. Белки-Ферменты Ферменты – это специфические и высокоэффективные катализаторы биохимических реакций, протекающих в живой клетке (скорость реакции
- 53. Белки-Ферменты растительного происхождения Фермент бромелин из ананаса Фермент папаин из плодов папайи
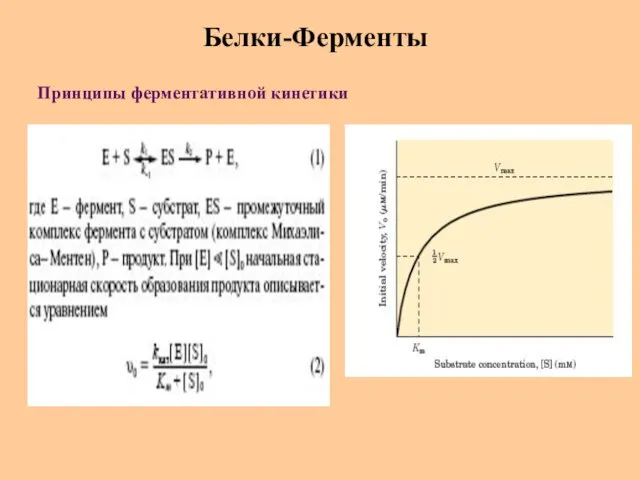
- 54. Белки-Ферменты Принципы ферментативной кинетики
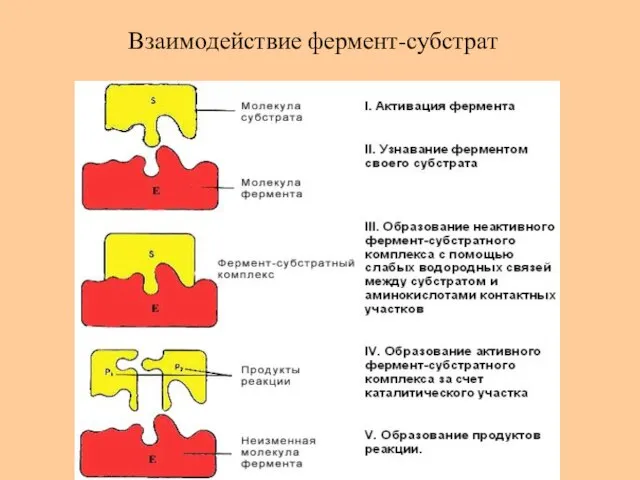
- 55. Взаимодействие фермент-субстрат
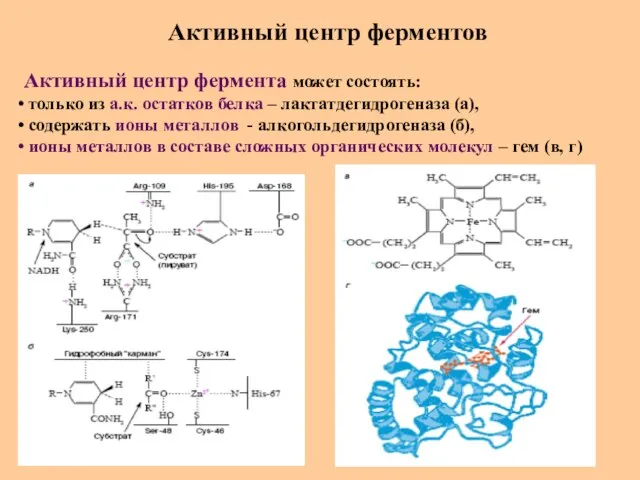
- 56. Активный центр ферментов Активный центр фермента может состоять: только из а.к. остатков белка – лактатдегидрогеназа (а),
- 57. Транспортные белки Транспортные белки участвуют в переносе различных веществ и ионов. Примеры: Гемоглобин ( переносит О2
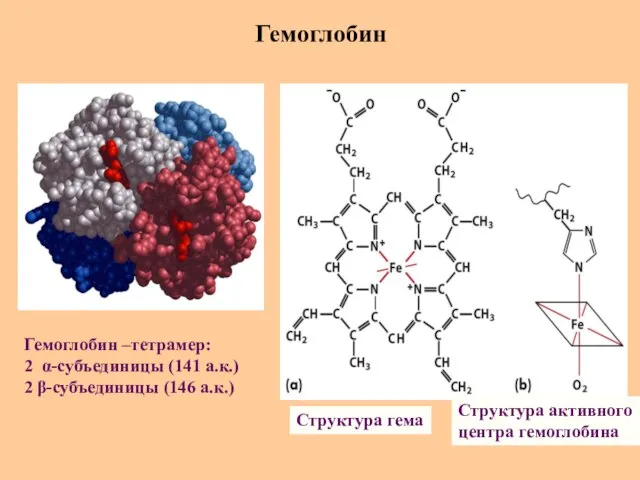
- 58. Гемоглобин Структура гема Структура активного центра гемоглобина Гемоглобин –тетрамер: 2 α-субъединицы (141 а.к.) 2 β-субъединицы (146
- 59. Гемоглобин и миоглобин Структура миоглобина Кривые оксигенации миоглобина (а) и гемоглобина (б)
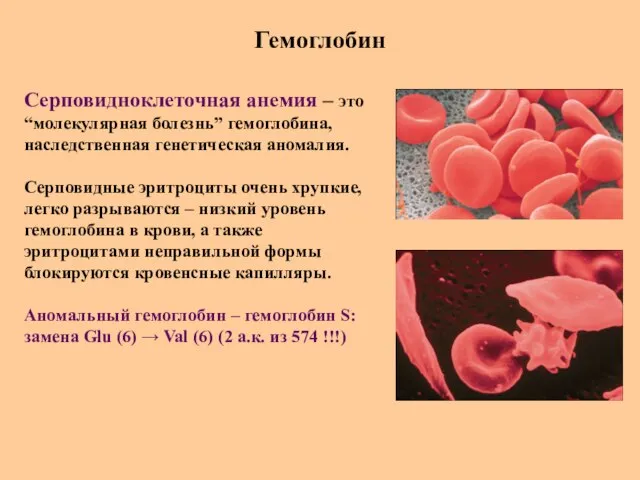
- 60. Гемоглобин Серповидноклеточная анемия – это “молекулярная болезнь” гемоглобина, наследственная генетическая аномалия. Серповидные эритроциты очень хрупкие, легко
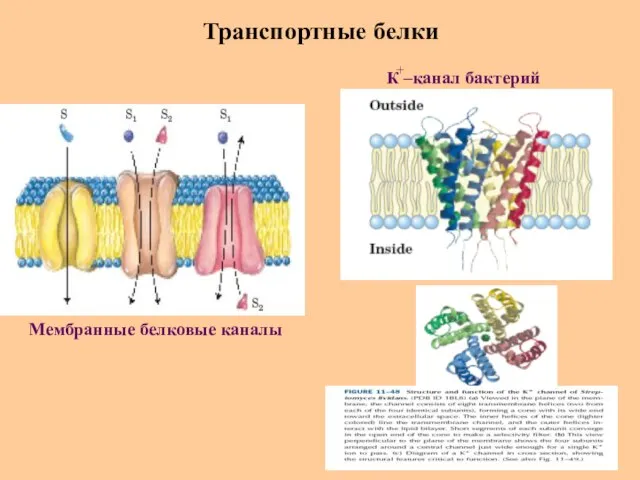
- 61. Транспортные белки Мембранные белковые каналы К –канал бактерий +
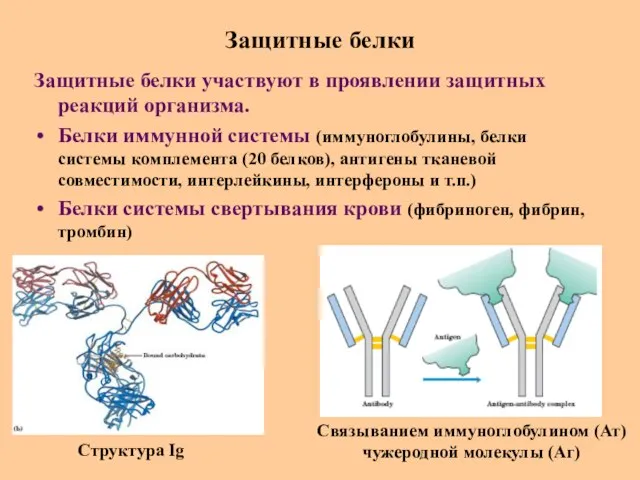
- 62. Защитные белки Защитные белки участвуют в проявлении защитных реакций организма. Белки иммунной системы (иммуноглобулины, белки системы
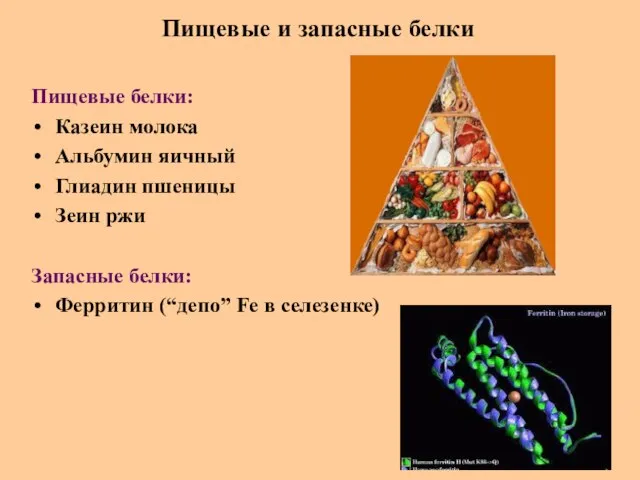
- 63. Пищевые и запасные белки Пищевые белки: Казеин молока Альбумин яичный Глиадин пшеницы Зеин ржи Запасные белки:
- 64. Белки-гормоны Гормоны – биологически активные регуляторы, вырабатываются в эндокринных железах и разносятся по кровяному руслу к
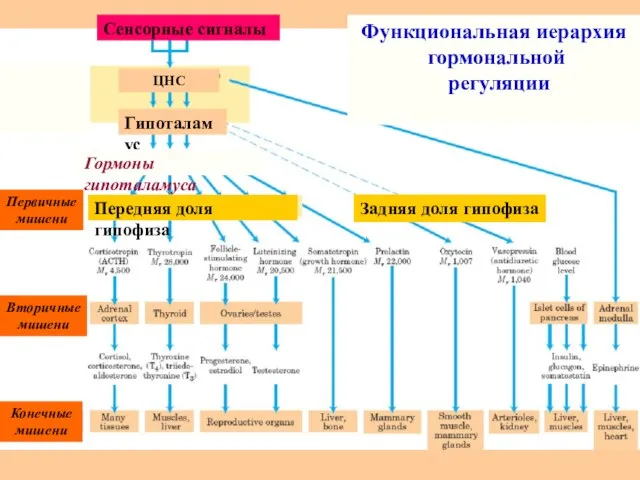
- 65. ЦНС Гипоталамус Гормоны гипоталамуса Передняя доля гипофиза Задняя доля гипофиза Первичные мишени Вторичные мишени Конечные мишени
- 66. Рецепторные белки Рецепторные белки: Родопсин зрительного аппарата животных (восприятие и преобразование световых сигналов) Бактериородопсин галофильных бактерий
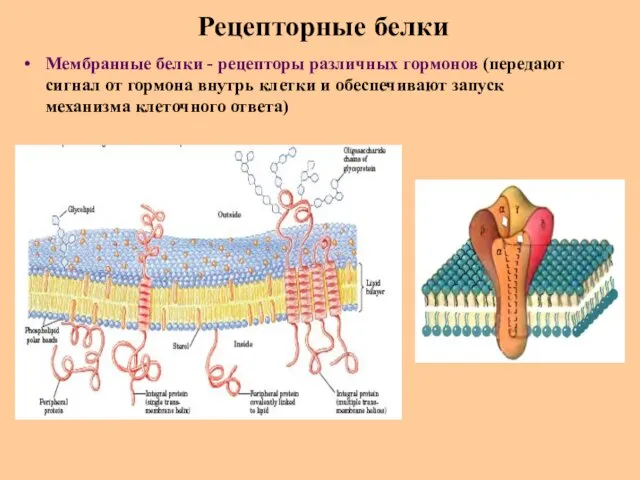
- 67. Рецепторные белки Мембранные белки - рецепторы различных гормонов (передают сигнал от гормона внутрь клетки и обеспечивают
- 68. Регуляторные белки и пептиды Регуляторные белки необходимы для функционирования различных звеньев клеточного метаболизма: Гистоны, репрессоры, рибосомальные
- 69. Структурные белки Структурные белки составляют остов многих тканей и органов. Являются фибриллярными белками Это белки соединительной
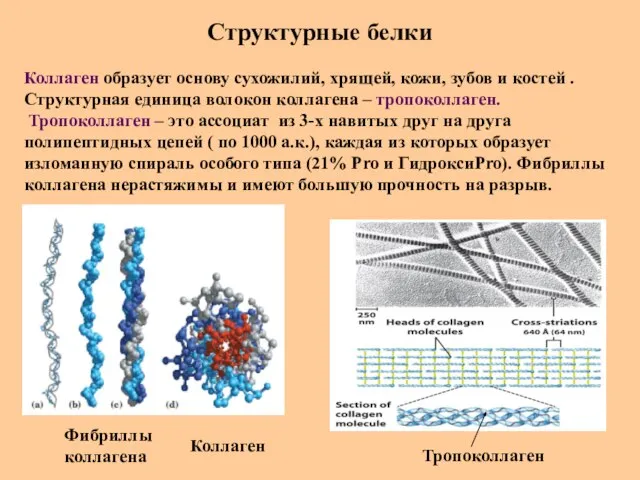
- 70. Структурные белки Коллаген образует основу сухожилий, хрящей, кожи, зубов и костей . Структурная единица волокон коллагена
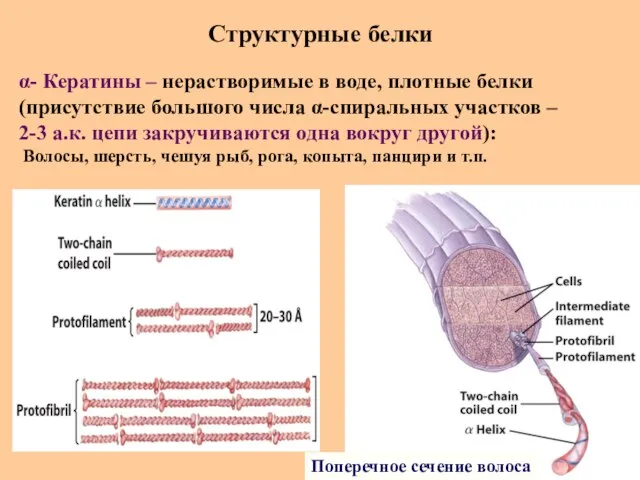
- 71. Структурные белки Поперечное сечение волоса α- Кератины – нерастворимые в воде, плотные белки (присутствие большого числа
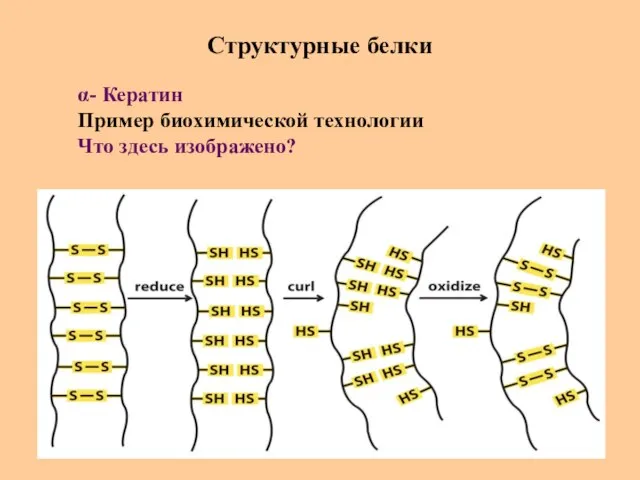
- 72. Структурные белки α- Кератин Пример биохимической технологии Что здесь изображено?
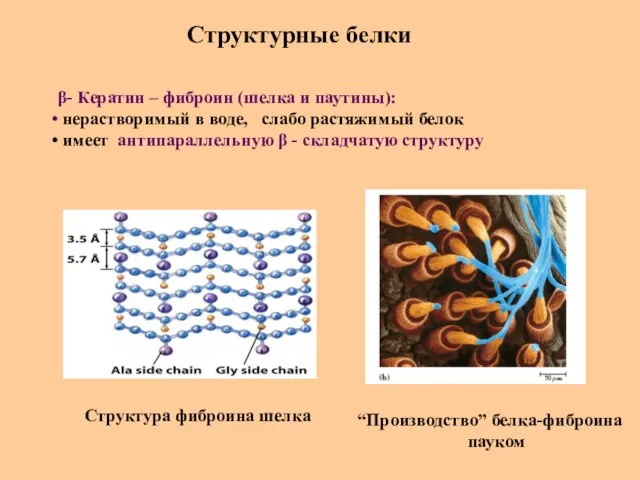
- 73. Структурные белки β- Кератин – фиброин (шелка и паутины): нерастворимый в воде, слабо растяжимый белок имеет
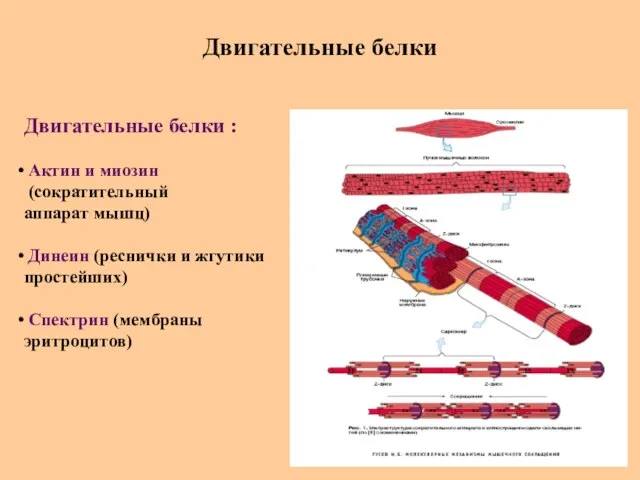
- 74. Двигательные белки Двигательные белки : Актин и миозин (сократительный аппарат мышц) Динеин (реснички и жгутики простейших)
- 75. Антибиотики белково-пептидной природы Антибиотики – химические агенты, продуцируемые микроорганизмами, обладают прямым и избирательным ингибирующим действием на
- 76. Токсины пептидно-белковой природы Белками являются самые мощные из известных токсинов микробного происхождения: Ботулинический токсин Столбнячный токсин
- 78. Скачать презентацию























 Урок 01 Фізика як навчальний предмет
Урок 01 Фізика як навчальний предмет Что растёт на подоконнике
Что растёт на подоконнике Интерьер бального зала
Интерьер бального зала Отражение изменений «зарплатного» законодательства 2011 года в прикладных решениях фирмы «1С»
Отражение изменений «зарплатного» законодательства 2011 года в прикладных решениях фирмы «1С»  Компетенции сотрудников в краткосрочном проекте
Компетенции сотрудников в краткосрочном проекте Презентация на тему Функциональная схема компьютера
Презентация на тему Функциональная схема компьютера  Артеева
Артеева Мотивация деятельности в менеджменте
Мотивация деятельности в менеджменте Здоровое питание
Здоровое питание Оборона батальона (роты)
Оборона батальона (роты) Австралийская биржа
Австралийская биржа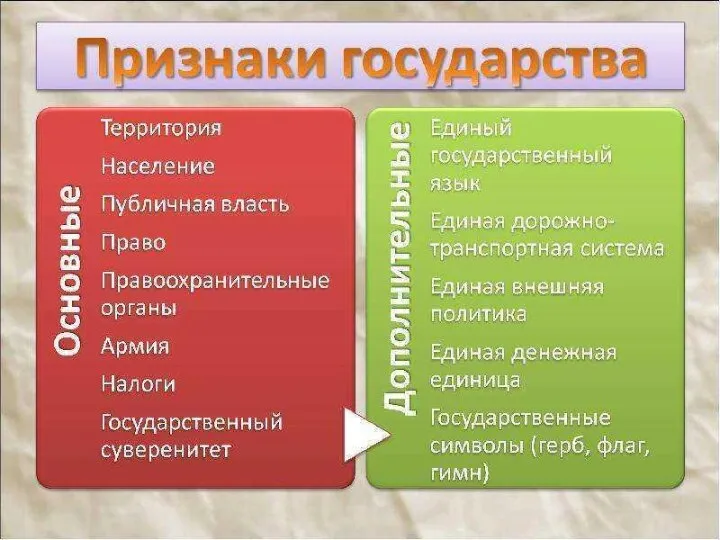 Признаки государства
Признаки государства Звуки [ к ] [ к ] - [ г ]
Звуки [ к ] [ к ] - [ г ] Аутсорсинг поддержки информационных систем
Аутсорсинг поддержки информационных систем Национализм. История возникновения национализма
Национализм. История возникновения национализма Самба – флиртуют все!
Самба – флиртуют все! Передача давления жидкостями и газами. Закон Паскаля.
Передача давления жидкостями и газами. Закон Паскаля. Слепченко Г.Б.,д.х.н., науч.рук. НИЛ №506 каф. ФАХ г. Томск
Слепченко Г.Б.,д.х.н., науч.рук. НИЛ №506 каф. ФАХ г. Томск Который час?
Который час? Виды скоростных способностей и методы их развития
Виды скоростных способностей и методы их развития Ляхова Ольга Владимировна
Ляхова Ольга Владимировна Источники электрического тока
Источники электрического тока ЭЛЕКТРОННЫЕ ТОРГИ
ЭЛЕКТРОННЫЕ ТОРГИ Квест Дивергент
Квест Дивергент Подготовка к ЕГЭ по математике Решение заданий В5
Подготовка к ЕГЭ по математике Решение заданий В5 Спортивная Россия
Спортивная Россия Отчет по производственной практике. Дизайн-проект мебели (оборудования) для жилых (общественных) интерьеров
Отчет по производственной практике. Дизайн-проект мебели (оборудования) для жилых (общественных) интерьеров Союз мультфильм говорит
Союз мультфильм говорит