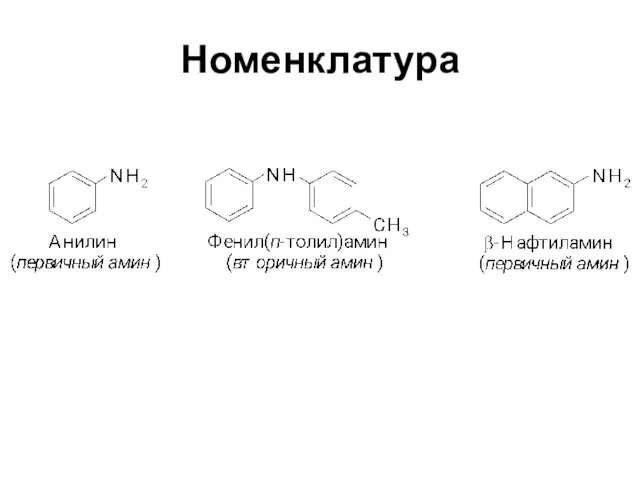
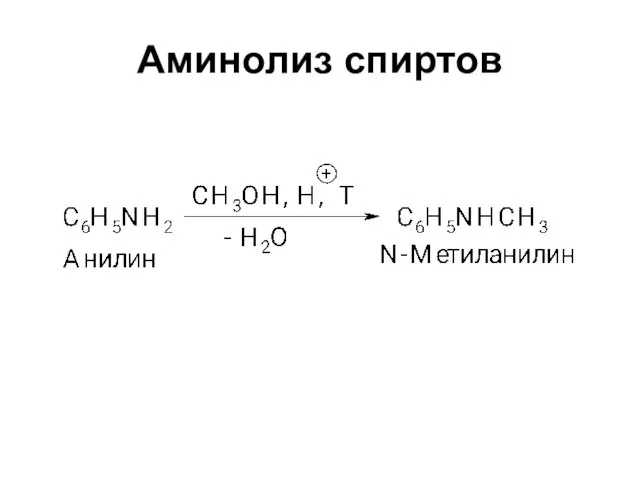
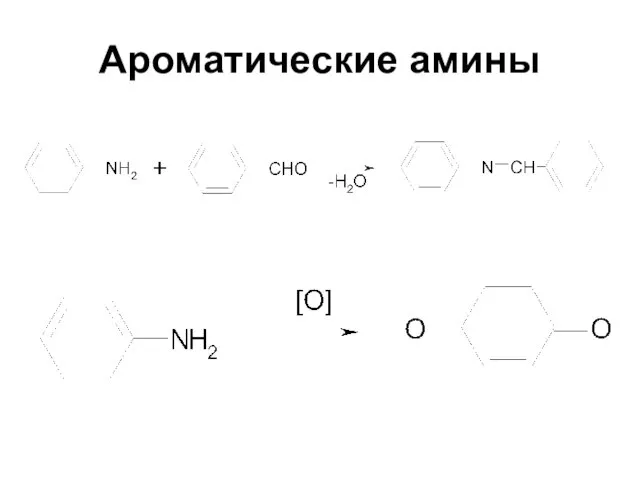
Слайд 2Амины
(органические производные аммиака)

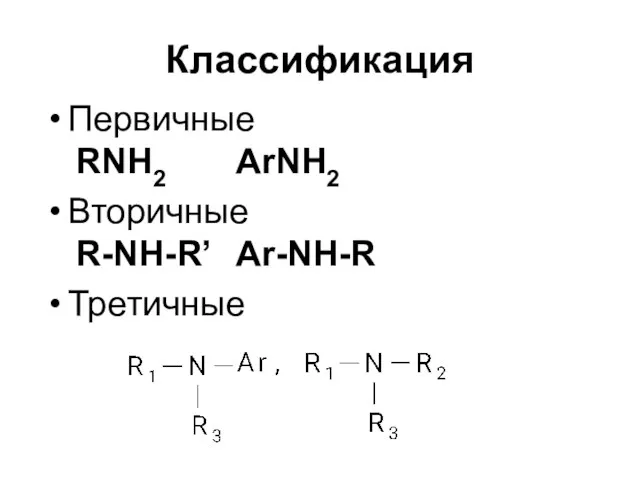
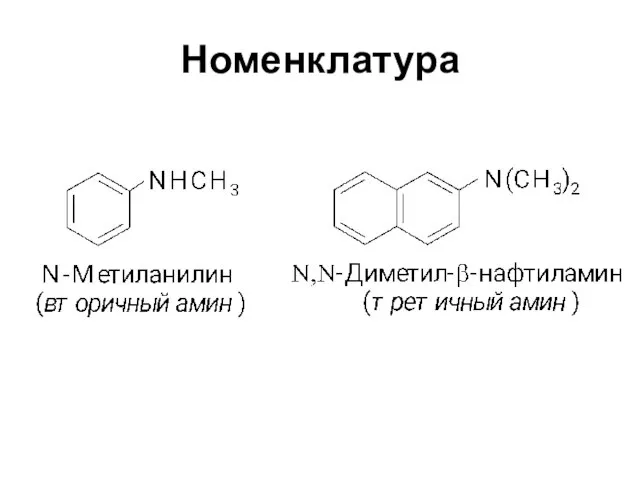
Слайд 3Классификация
Первичные
RNH2 ArNH2
Вторичные
R-NH-R’ Ar-NH-R
Третичные
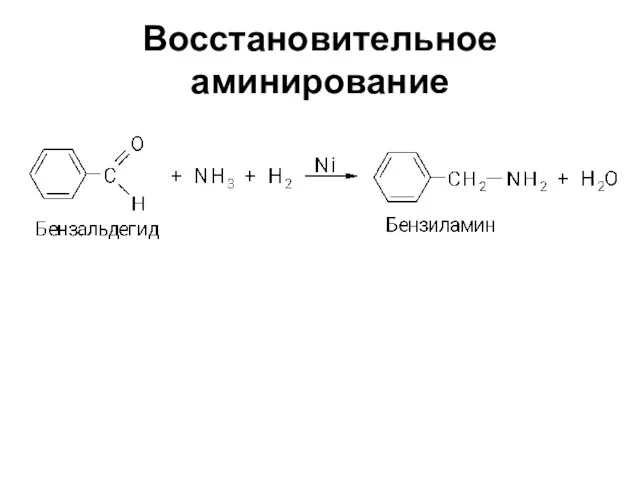
Слайд 9Восстановительное аминирование
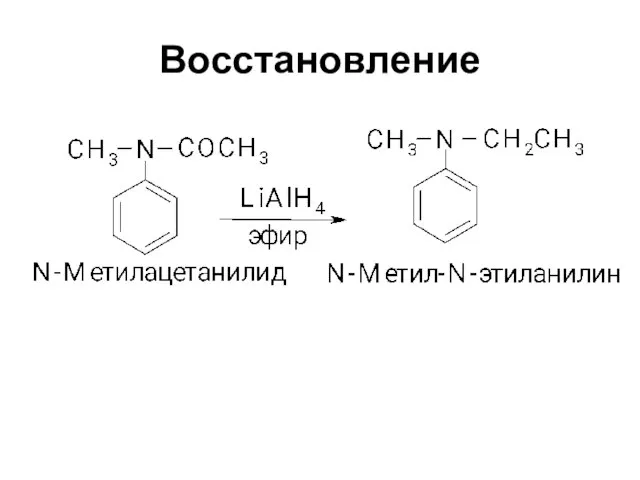
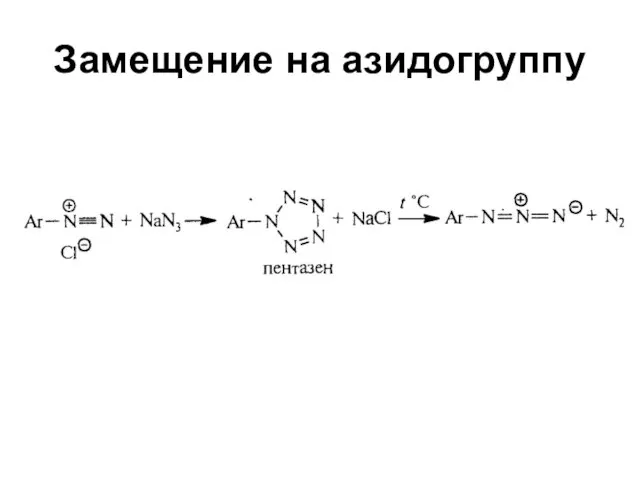
Слайд 11Расщепление амидов по Гофману (укорачивание цепи)
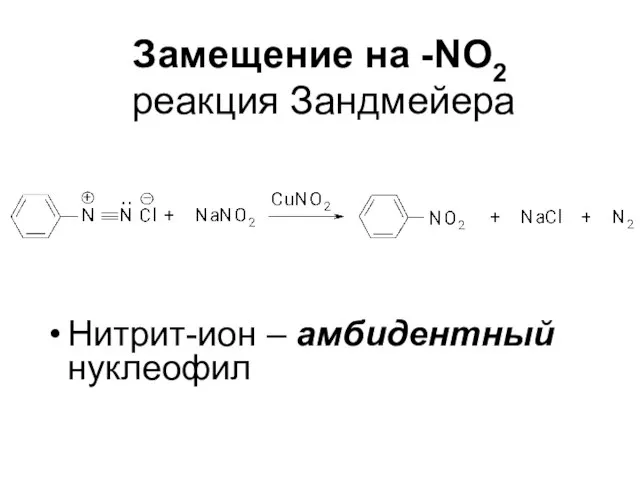
ArСОNH2 + NaOCl →
ArNH2 + Na2CO3
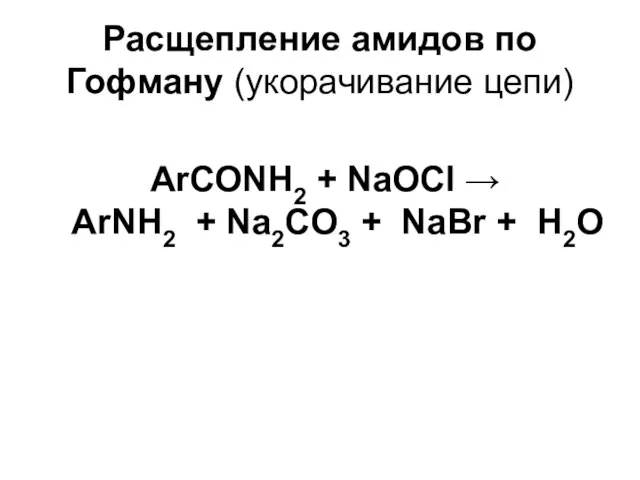
+ NaBr + Н2О
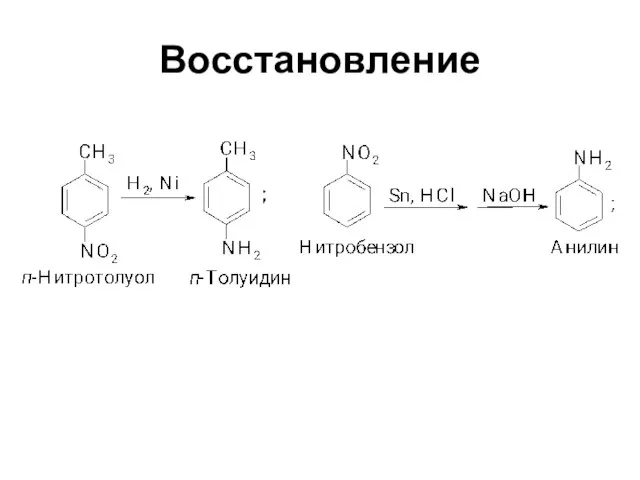
Слайд 12Физические свойства
Ароматические амины – жидкости или твердые тела с характерным неприятным запахом,

сильно токсичны
В воде растворяются мало, накопление аминогрупп ведет к увеличению растворимости
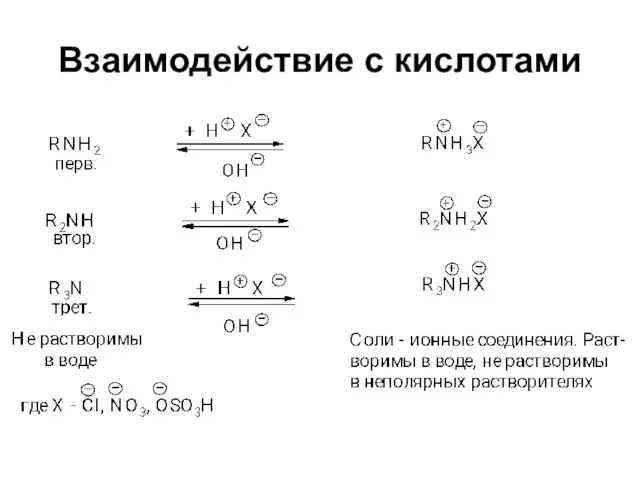
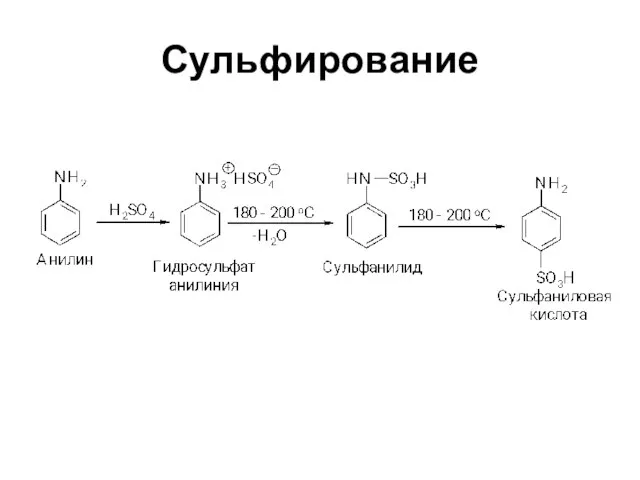
Слайд 13Химические свойства
Амины являются основаниями
Амины способны выступать в качестве нуклеофильных реагентов

Слайд 14Основность аминов
ArNH2 + H2O → ArNH3+ + OH-
раствор лакмуса окрашивают в

синий цвет, фенолфталеина - в малиновый
Слайд 15Основность
В + Н2О → НВ+ + НО-
[OH-][HB+]
Kb= ⎯⎯⎯⎯⎯⎯
![Основность В + Н2О → НВ+ + НО- [OH-][HB+] Kb= ⎯⎯⎯⎯⎯⎯ [B]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362129/slide-14.jpg)
[B]
Слайд 16Основность аминов
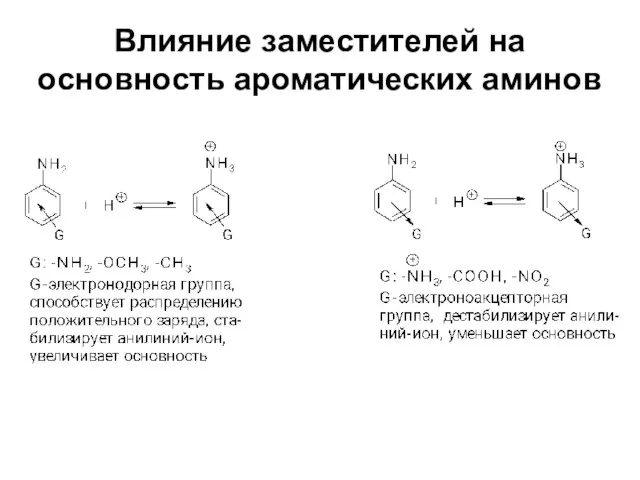
Ароматические амины менее основны чем алифатические

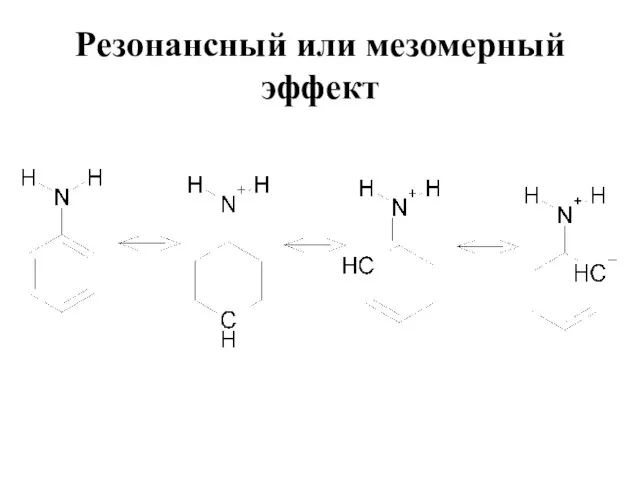
Слайд 17Резонансный или мезомерный эффект
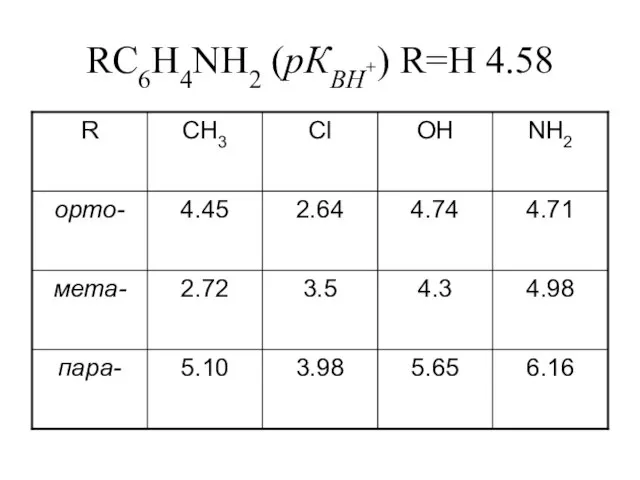
Слайд 18Основность (pKBH+)
NH3 9.21
CH3NH2 10.62 C2H5NH2 10.63
(CH3)2NH 10.71 (C2H5)2NH 10.98
(CH3)3N 9.76 (C2H5)3N 10.65
PhNH2 4.58
PhNHCH3 4.85
PhN(CH3)2 5.06

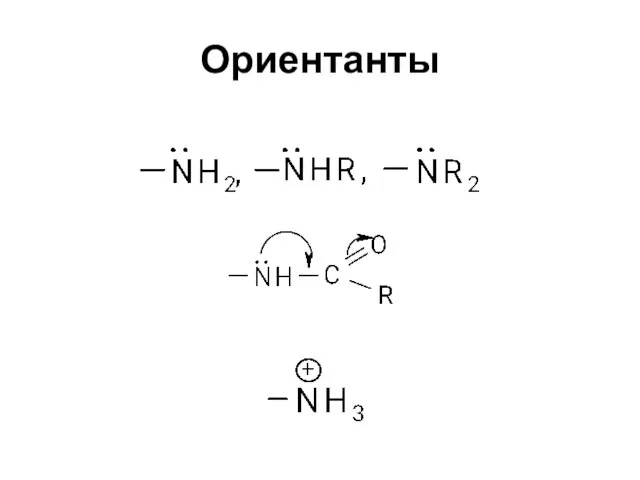
Слайд 19Влияние заместителей на основность ароматических аминов
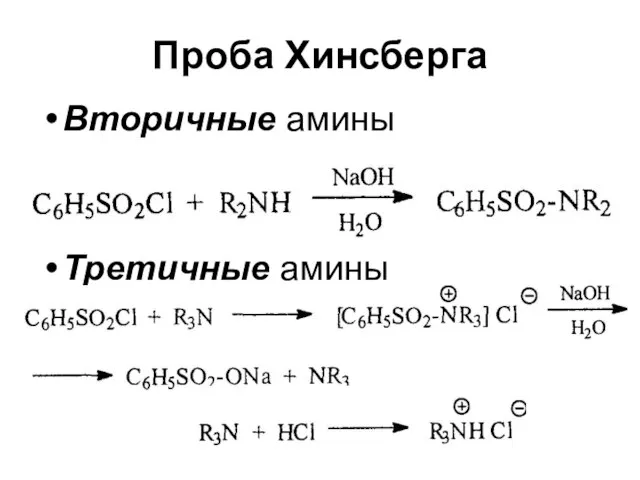
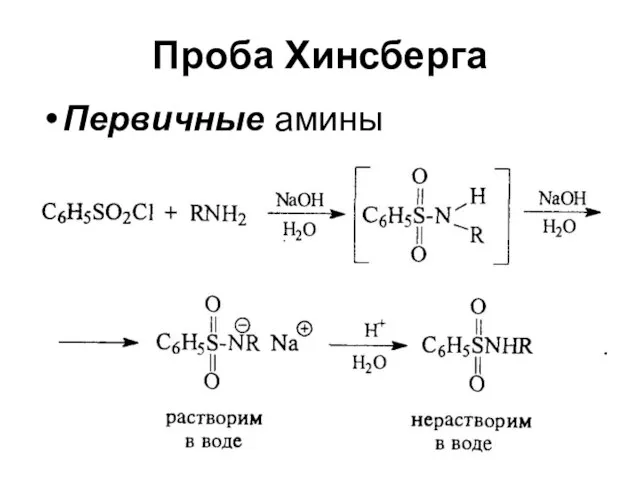
Слайд 23Проба Хинсберга
Вторичные амины
Третичные амины
Слайд 24Ароматические амины
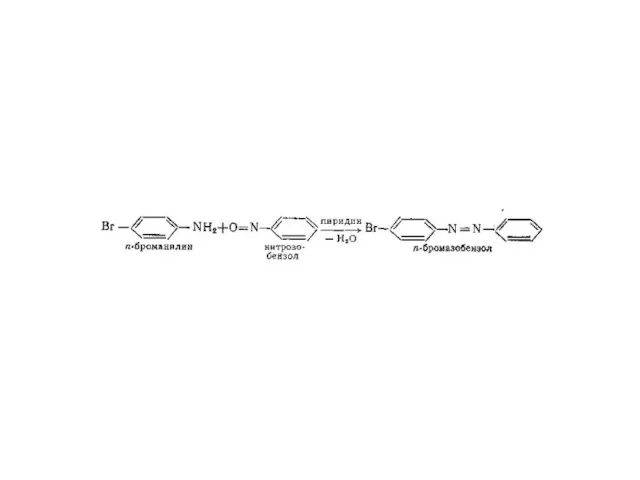
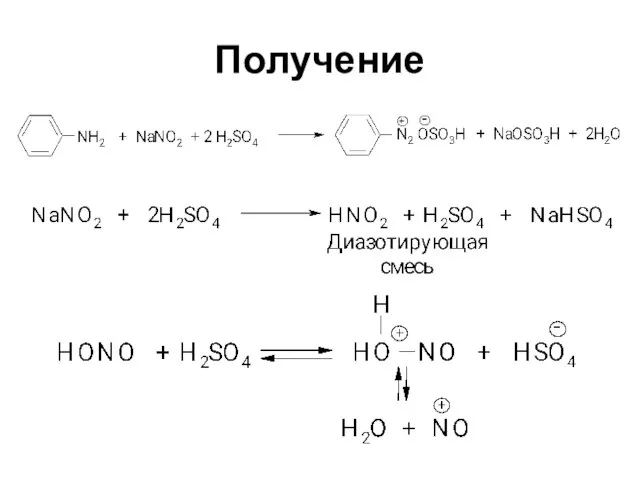
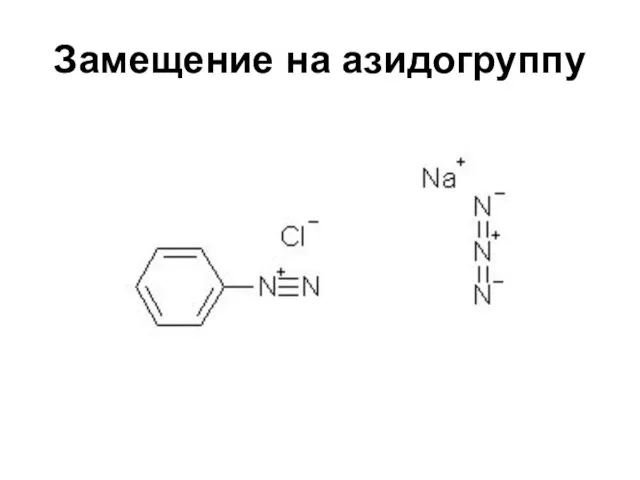
Первичные при взаимодействии с азотистой кислотой дают соли диазония:
PhNH2∙HCl +

НОNO →
[Ph-N≡N]Cl + 2 Н2О
Слайд 25Ароматические амины
Вторичные при взаимодействии с азотистой кислотой образуют N-нитрозосоединения
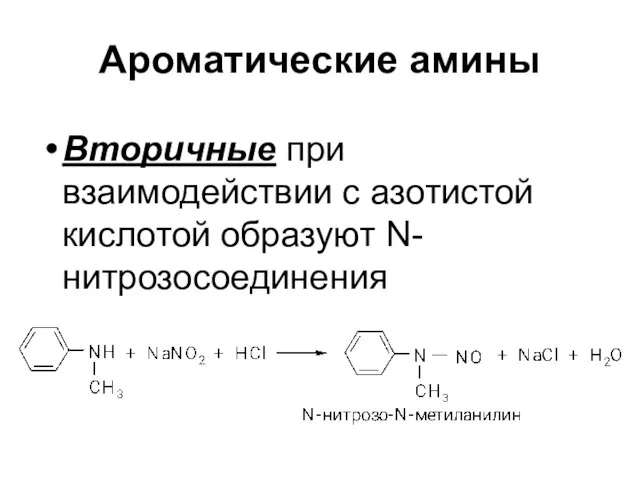
Слайд 26Ароматические амины
Третичные при взаимодействии с азотистой кислотой образуют ароматические нитрозосоединения
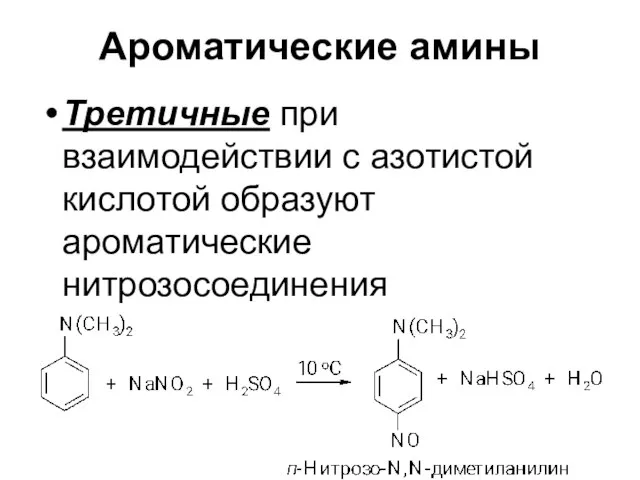
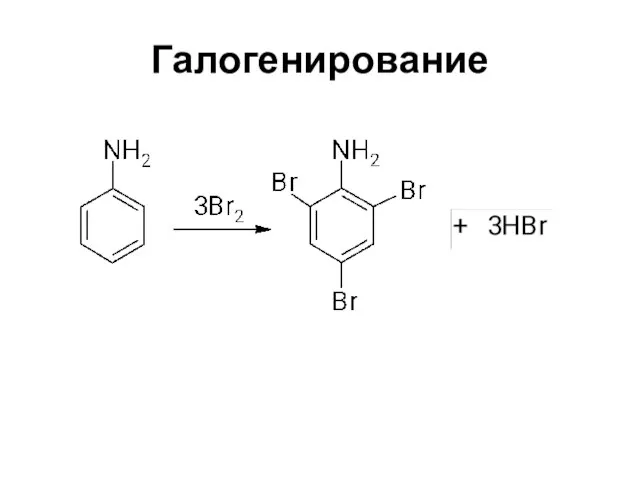
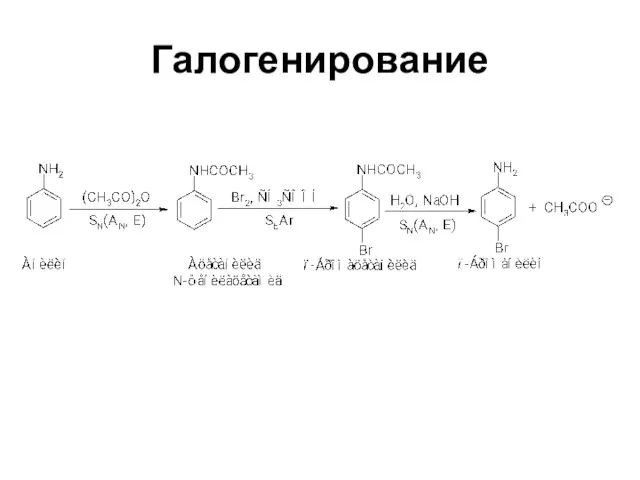
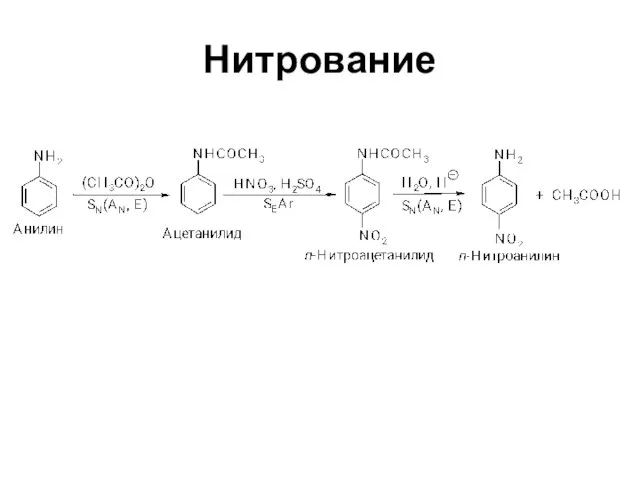
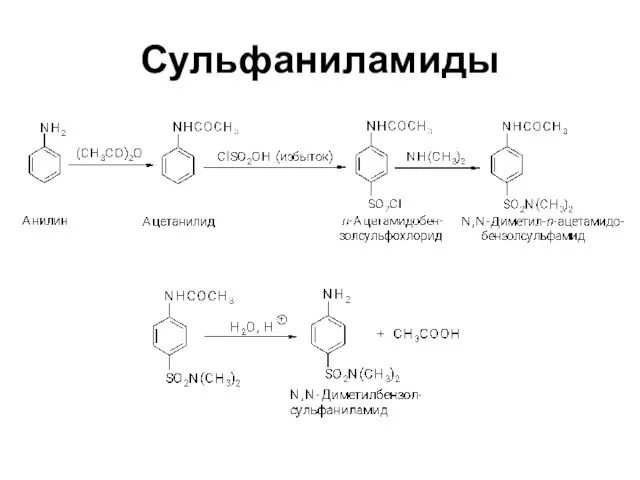
Слайд 29Замещение в кольце ароматических аминов

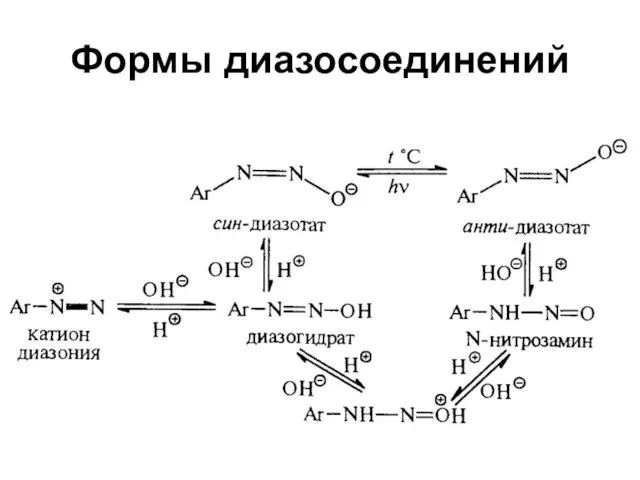
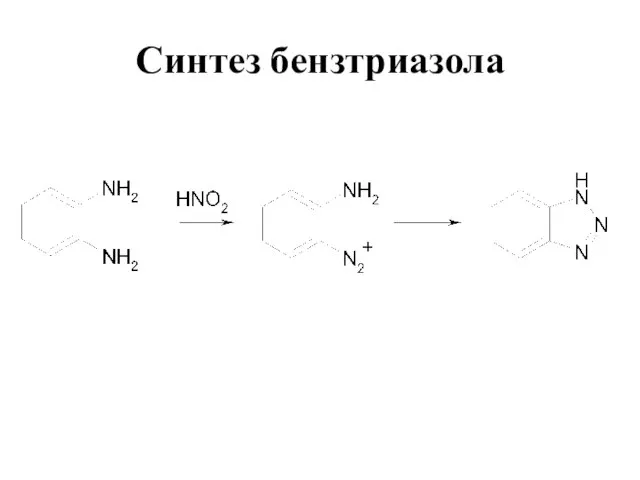
Слайд 37Диазосоединения
В которых группа –N2– связана с углеводородным радикалом и неуглеводородным радикалом Х

Ar–N2X, где X = Br, Cl, NO3, HSO4 - cоли диазония
Ar–N2OH - диазогидрат
Слайд 39Нитрозирующие агенты
NO+ >>
H2NO2+ > NOBr > NOCl > N2O3 >>
HNO2
В
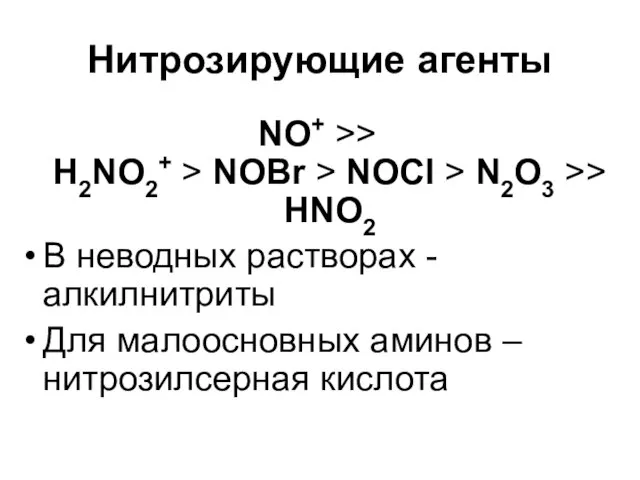
неводных растворах - алкилнитриты
Для малоосновных аминов – нитрозилсерная кислота
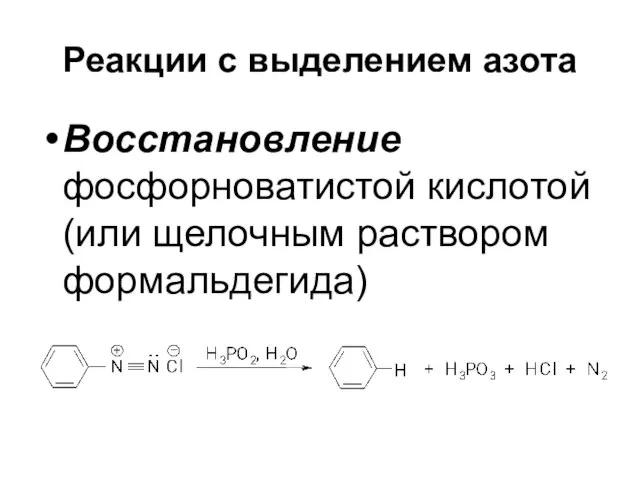
Слайд 44Реакции с выделением азота
Восстановление фосфорноватистой кислотой (или щелочным раствором формальдегида)
Слайд 45Реакции с выделением азота
ArN+2Cl- + Н2О →
ArOH + HCl +
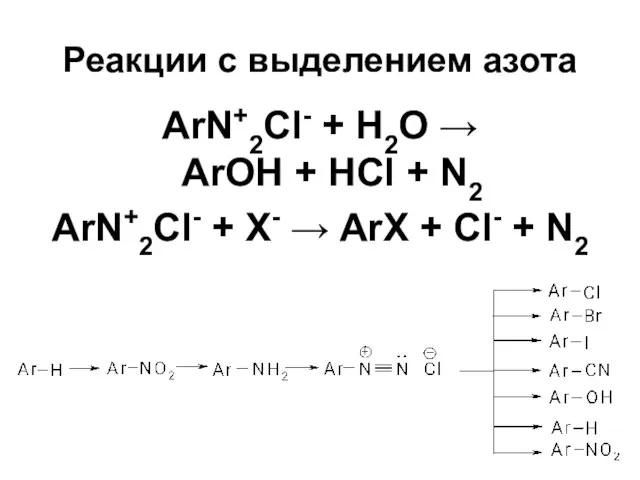
N2
ArN+2Cl- + X- → ArX + Cl- + N2
Слайд 46SN1Ar
ArN2+ → N2 + Ar+ (медленно)
Ar+ + Nu- → Ar-Nu
Ph+ +
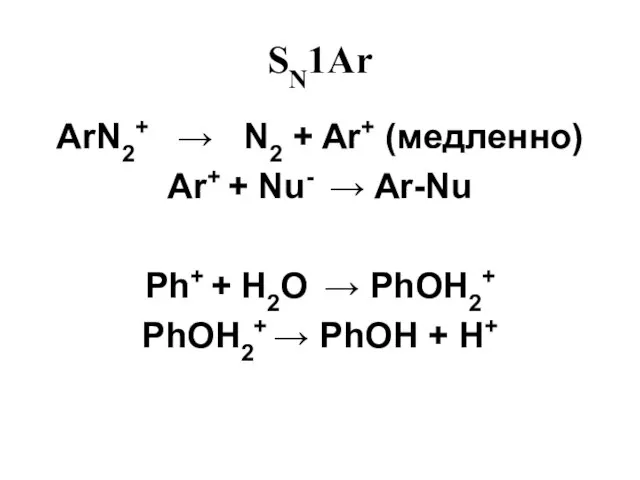
H2O → PhOH2+
PhOH2+ → PhOH + H+
Слайд 47SN1Ar
Ar+ + CH3OH → Ar-OCH3 + H+
Ar+ + I- → ArI
Ar+
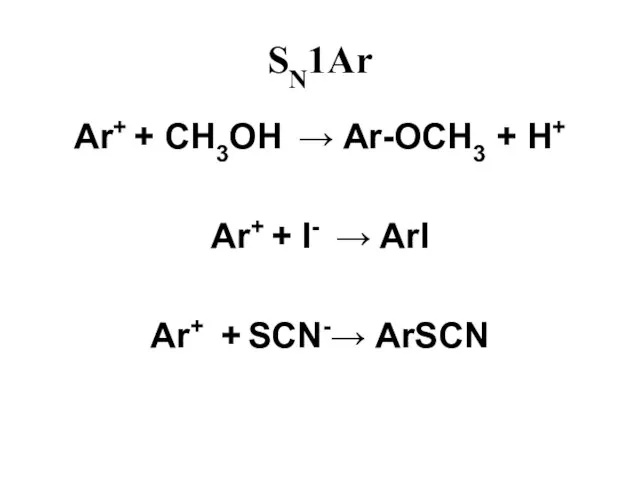
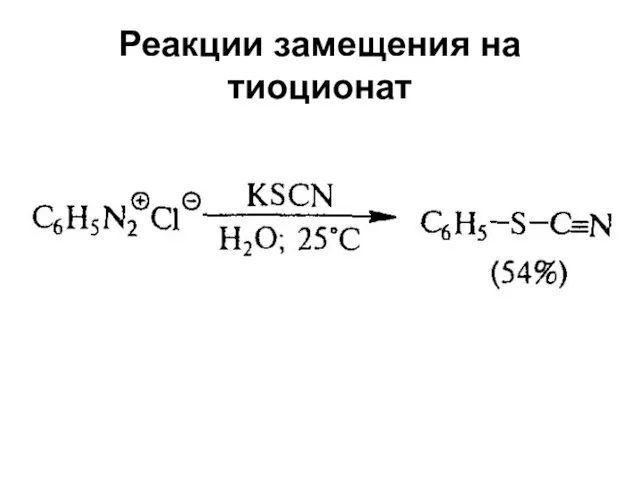
+ SCN-→ ArSCN
Слайд 50SN1Ar
1) Скорость не зависит от [Nu]
2) Влияние заместителей в ароматическом кольце
3) Ar15N+≡N
![SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362129/slide-49.jpg)
⇔ ArN+≡N15
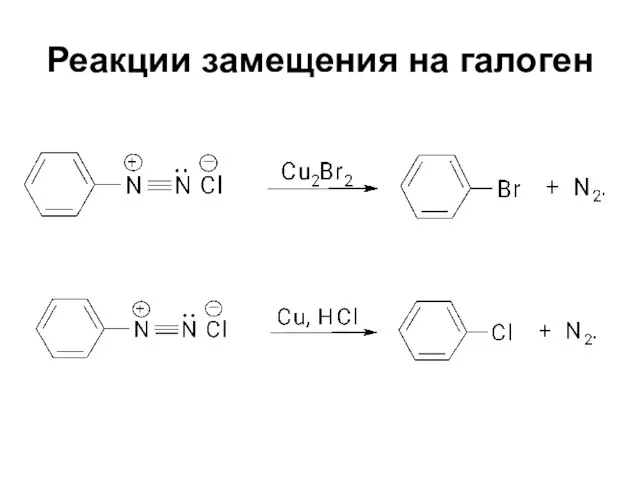
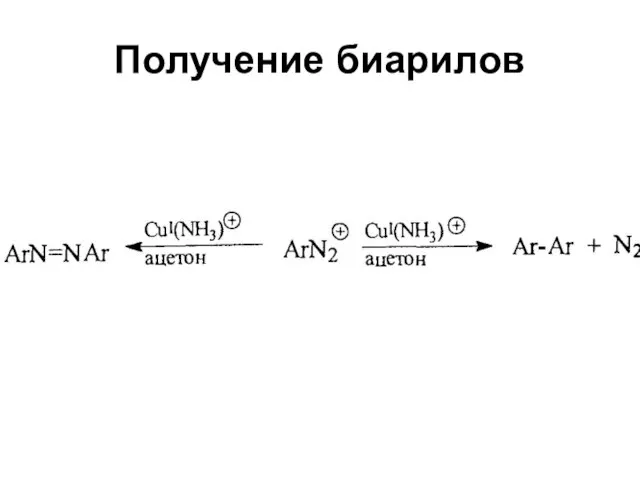
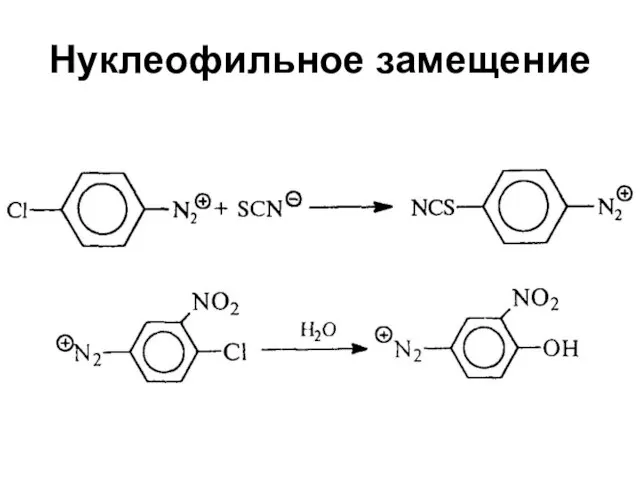
Слайд 52Реакции замещения на галоген
Реакции с использованием галогенида меди (I) называются реакциями

Зандмейера
Реакции с использованием металлической меди называются реакциями Гаттермана
Слайд 54Реакции замещения на галоген
Замещение диазогруппы на I не требует применения, достаточно подействовать
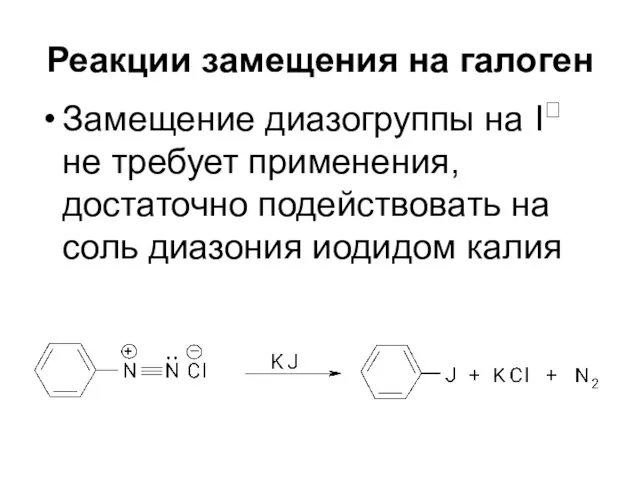
на соль диазония иодидом калия
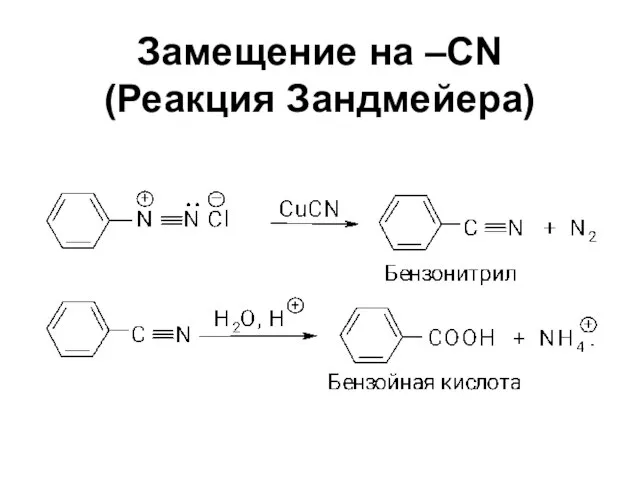
Слайд 56Замещение на –CN
(Реакция Зандмейера)
Слайд 57Замещение на -ОН
Реакция медленно протекает даже в ледяном растворе
Соли диазония надо
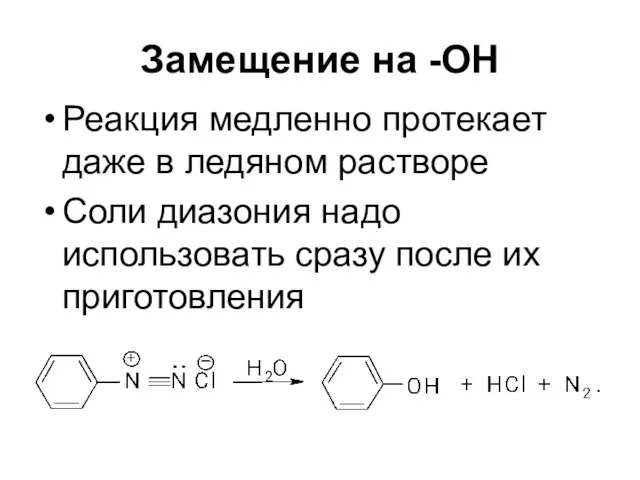
использовать сразу после их приготовления
Слайд 58Замещение на -NО2
реакция Зандмейера
Нитрит-ион – амбидентный нуклеофил
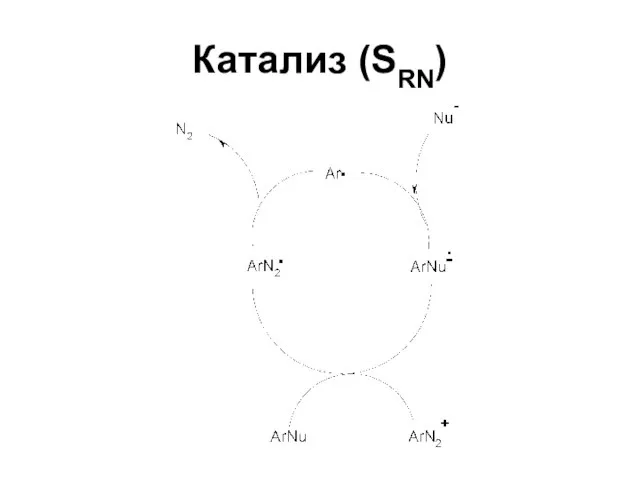
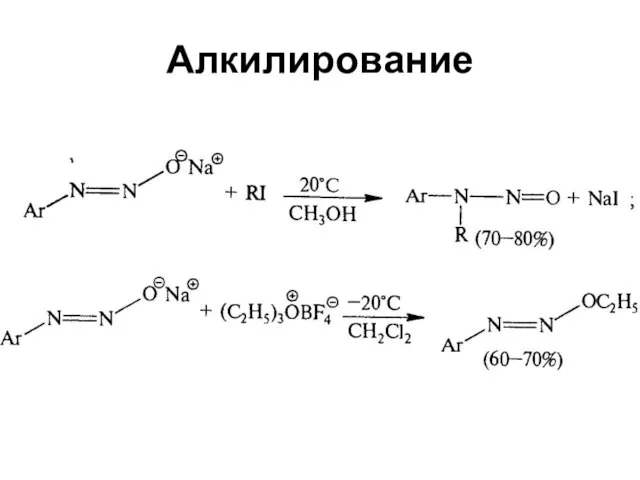
Слайд 60Реакции солей диазония без выделения азота

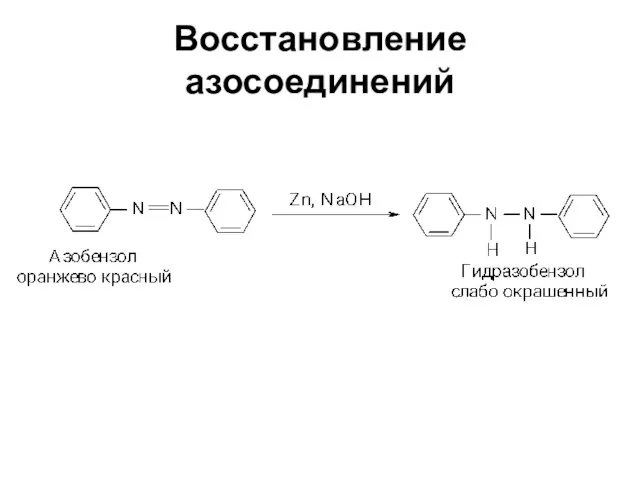
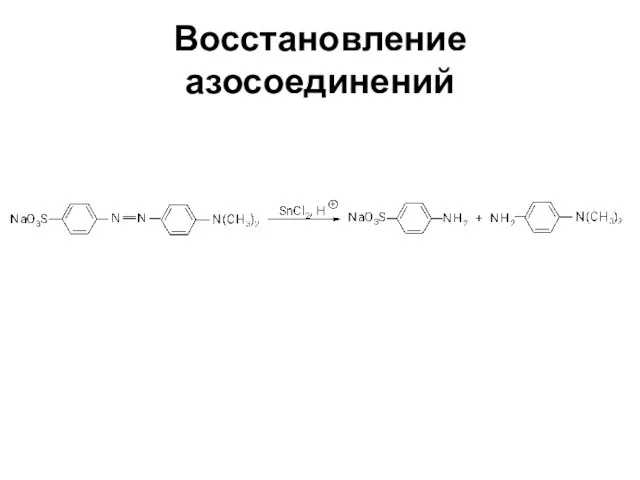
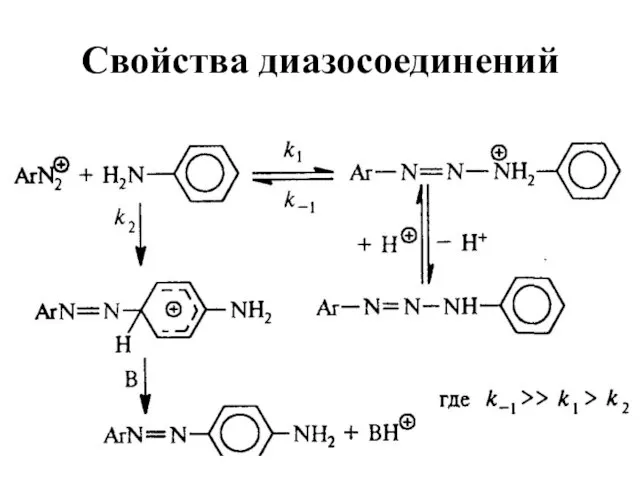
Слайд 62Свойства диазосоединений
ArN2+ + [Н] → ArNHNH2
![Свойства диазосоединений ArN2+ + [Н] → ArNHNH2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362129/slide-61.jpg)
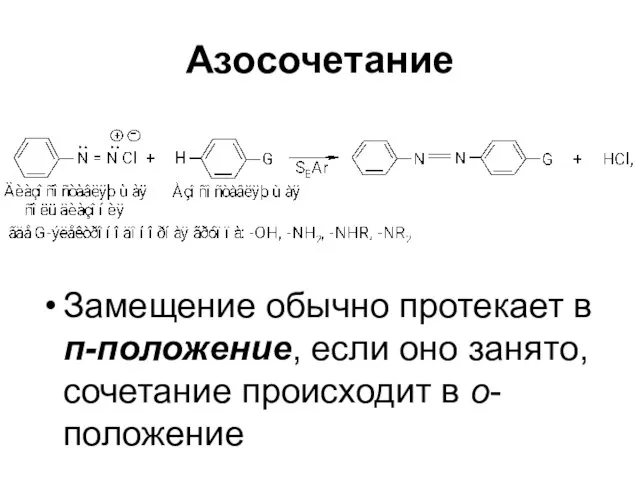
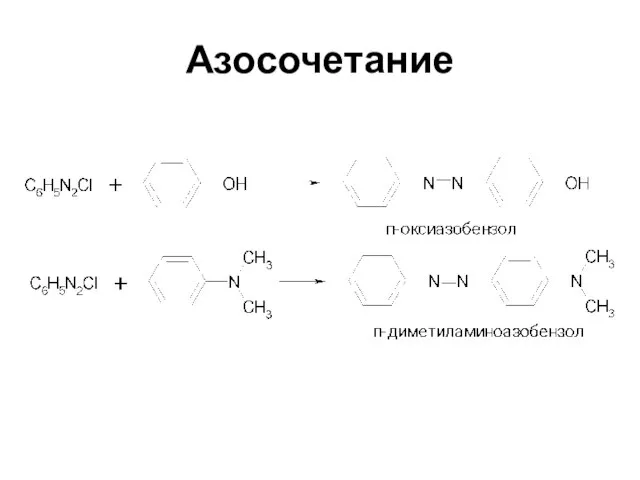
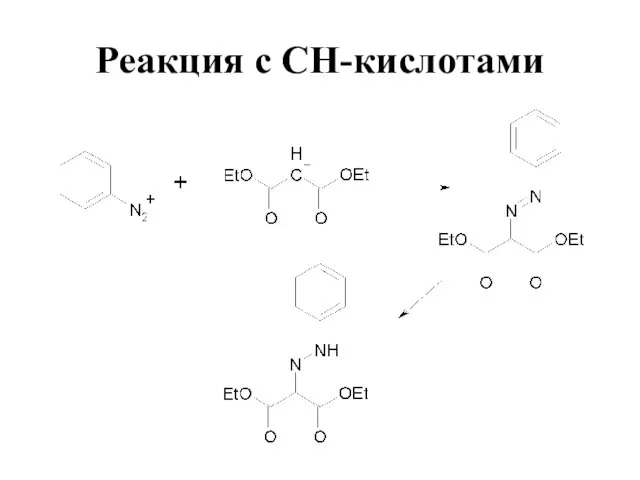
Слайд 63Азосочетание
Соли диазония в определенных условиях реагируют с ароматическими соединениями с образованием

азосоединений Ar–N=N–Ar’
Эти реакции называются реакциями азосочетания
Слайд 64Азосочетание
Замещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение
Слайд 66Окраска веществ
Хромофорные группы:
>C=C<, >C=O, >C=N-, >C=S,
-N=N-, -NO2
хиноидное ядро и др.
Ауксохромные группы:
-OH,
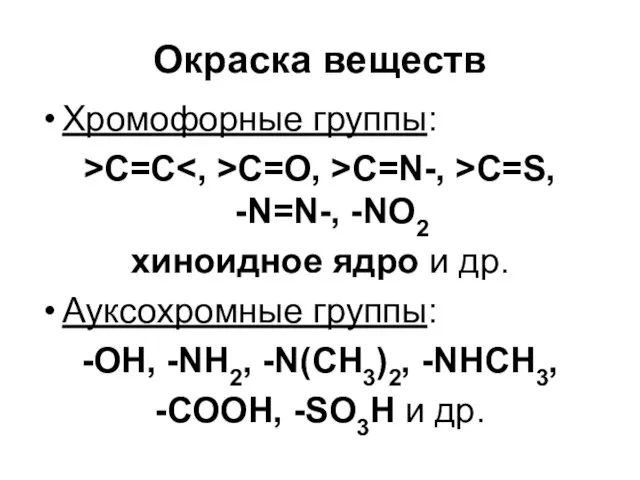
-NH2, -N(CH3)2, -NHCH3,
-COOH, -SO3H и др.
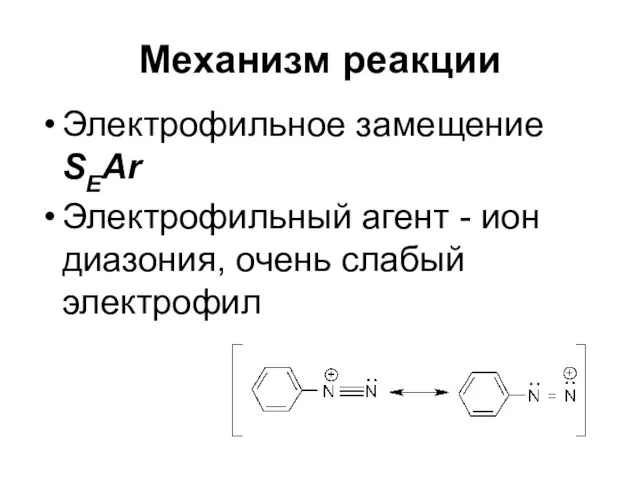
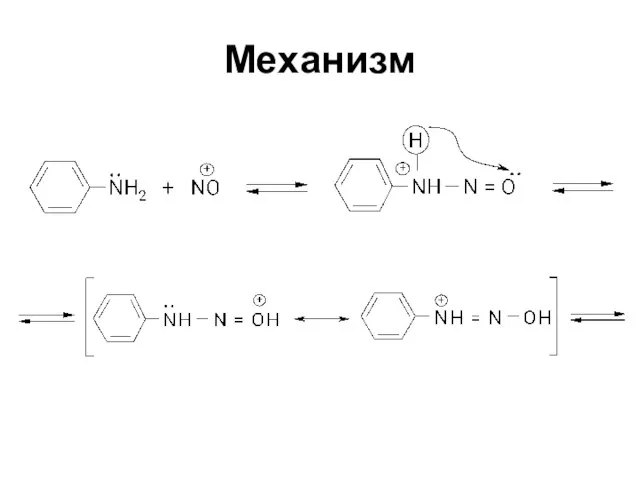
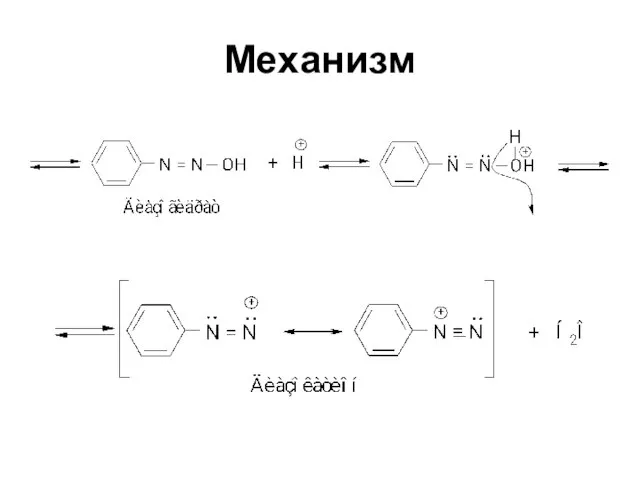
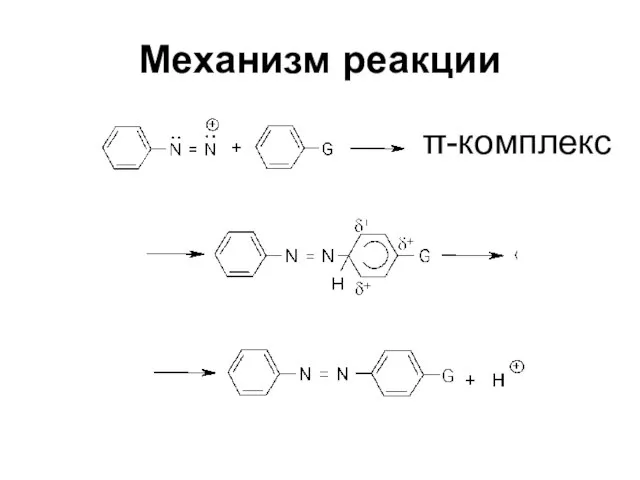
Слайд 67Механизм реакции
Электрофильное замещение SEAr
Электрофильный агент - ион диазония, очень слабый электрофил
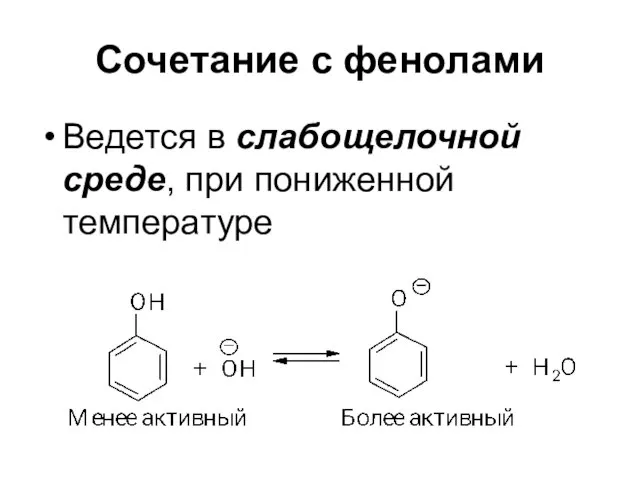
Слайд 69Сочетание с фенолами
Ведется в слабощелочной среде, при пониженной температуре
Слайд 70Сочетание с фенолами
В присутствии ОН ион диазония существует в равновесии с неионизированным
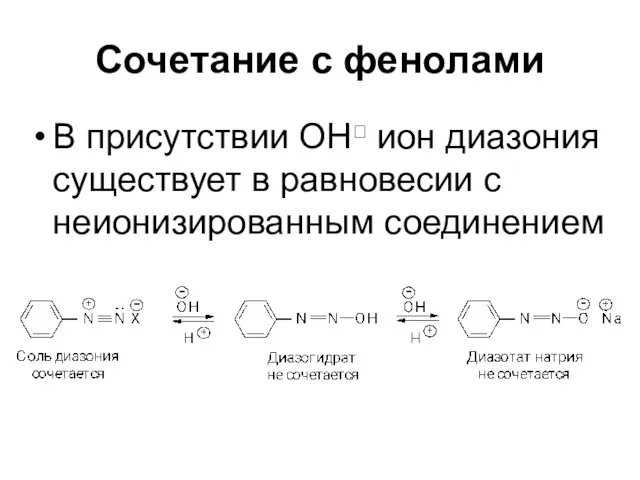
соединением
Слайд 71Сочетание с аминами
Высокая кислотность среды способствует тому, что диазосоединение полностью находится

в виде диазокатиона
Слайд 72Сочетание с аминами
Чем выше кислотность, тем выше доля амина в виде
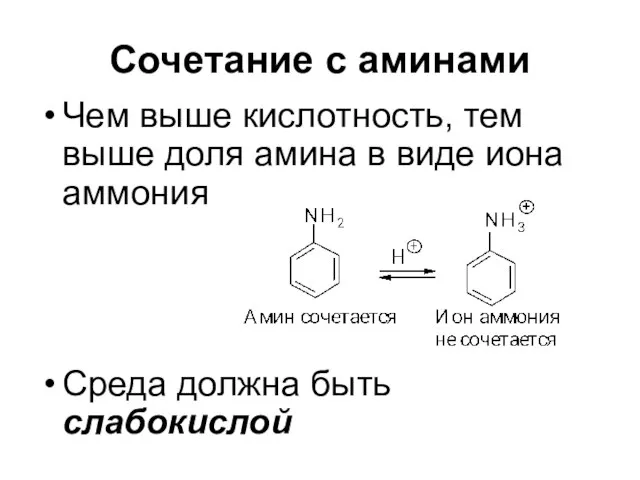
иона аммония
Среда должна быть слабокислой
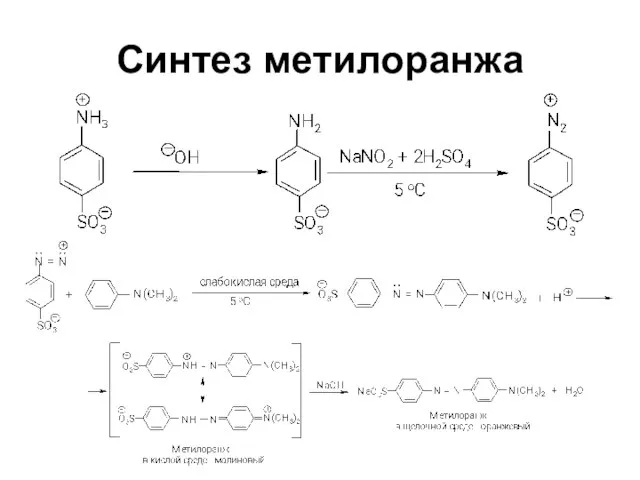
Слайд 73Синтез п-нитроанилинового красного
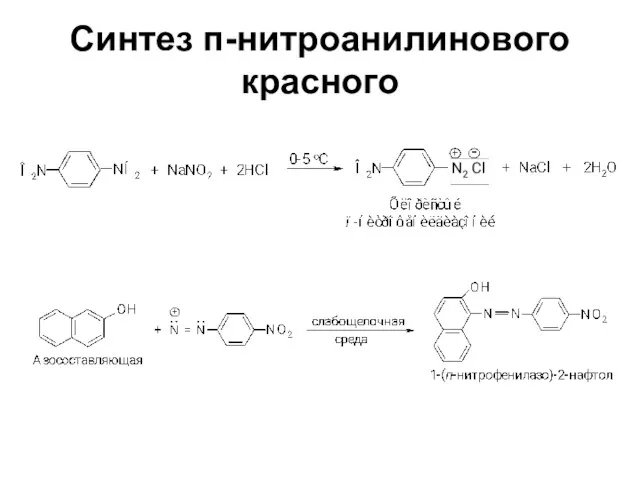
Слайд 77Свойства диазосоединений
Для первичных и вторичных ароматических аминов азогруппа вступает не в ароматическое

кольцо, а в аминогруппу:








![Основность В + Н2О → НВ+ + НО- [OH-][HB+] Kb= ⎯⎯⎯⎯⎯⎯ [B]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362129/slide-14.jpg)

















![SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362129/slide-49.jpg)






![Свойства диазосоединений ArN2+ + [Н] → ArNHNH2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362129/slide-61.jpg)











 Основные понятия, необходимые при написании научно-исследовательской работы
Основные понятия, необходимые при написании научно-исследовательской работы Современное искусство. Граффити. 7 класс
Современное искусство. Граффити. 7 класс Рисуем спектакль. Конкурсная работа
Рисуем спектакль. Конкурсная работа Внедрение ЛЕГО- конструирования в образовательный процесс ДОУ
Внедрение ЛЕГО- конструирования в образовательный процесс ДОУ Peter the great rule
Peter the great rule Формирование действия моделирования на уроках информатики
Формирование действия моделирования на уроках информатики Современные популярные оздоровительные системы физических упражнений
Современные популярные оздоровительные системы физических упражнений Современные методы коммуникации: социальные медиа как площадка для продвижения бренда
Современные методы коммуникации: социальные медиа как площадка для продвижения бренда Морозные узоры
Морозные узоры აქტივაცია
აქტივაცია Жизнь в балансе. Курс для женщин о сохранении баланса в современном ритме на пути к достижению своих целей
Жизнь в балансе. Курс для женщин о сохранении баланса в современном ритме на пути к достижению своих целей Презентация на тему Первые жилища человека
Презентация на тему Первые жилища человека Multilingual Ontology Matching based on Wiktionary Data Accessible via SPARQL Endpoint
Multilingual Ontology Matching based on Wiktionary Data Accessible via SPARQL Endpoint Педагогические технологии при обучении физике: преподавание, развивающее ученика
Педагогические технологии при обучении физике: преподавание, развивающее ученика Varieties of Spoken English
Varieties of Spoken English  Содержание правоотношений
Содержание правоотношений Адаптация детей к ДОУ
Адаптация детей к ДОУ Развитие творческих способностей и личностный рост учащихся начальной школы
Развитие творческих способностей и личностный рост учащихся начальной школы МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ДОШКОЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ЦЕНТР РАЗВИТИЯ РЕБЁНКА ДЕТСКИЙ САД № 9 Орджоникидзевского
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ДОШКОЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ЦЕНТР РАЗВИТИЯ РЕБЁНКА ДЕТСКИЙ САД № 9 Орджоникидзевского  Озеро Байкал (3 класс)
Озеро Байкал (3 класс) ФОРУМ « СОЗДАЙ СЕБЯ САМ»- представление молодежных инициатив в определении будущей карьеры и развития рынка труда
ФОРУМ « СОЗДАЙ СЕБЯ САМ»- представление молодежных инициатив в определении будущей карьеры и развития рынка труда ЭВОЛЮЦИЯ СТАНДАРТА ПАТЕНТОСПОСОБНОСТИ В США М. ФАЙНБЕРГ, патентный юрист США, юридическая фирма "Арент Фокс", Нью Йорк, США Тел. в Нь
ЭВОЛЮЦИЯ СТАНДАРТА ПАТЕНТОСПОСОБНОСТИ В США М. ФАЙНБЕРГ, патентный юрист США, юридическая фирма "Арент Фокс", Нью Йорк, США Тел. в Нь 1666287909342__3mew8
1666287909342__3mew8 Farmina Промо 2021
Farmina Промо 2021 И освящениье и благословение в названьях наших улиц есть
И освящениье и благословение в названьях наших улиц есть Формы и виды права собственности по российскому законодательству
Формы и виды права собственности по российскому законодательству Актуальные направления идеологической работы в Республике Беларусь
Актуальные направления идеологической работы в Республике Беларусь Дорога щастя
Дорога щастя