Слайд 2ТЕМЫ:
Современные представления о строении атомов
Закономерности изменения химических свойств элементов и их

соединений по периодам и группам периодической системы химических элементов Д.И. Менделеева
Химическая связь
Слайд 3Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода с относительной

атомной массой равной 12
1) 4; 2)12; 3)6; 4)2
Слайд 4Строение атома
Атом (от греч. atomos - неделимый) - наименьшая химическая частица, состоящая

из массивного положительно заряженного ядра и движущихся в электрическом поле ядра отрицательно заряженных электронов
Слайд 5Атомные частицы и их свойства
Атом состоит из трёх видов частиц:
Электрон - (е)

- заряд отрицательный, . q=-1,6 . 10-19Кл. Масса mе =9,1.10-31кг
Протон – (р)- заряд положительный .
q = 1,6 . 10-19Кл, Масса mр = 1840 mе
Нейтрон –(n)- не заряжен, . Масса mn≈ mр
Слайд 6Строение атома
Ядро атома - образование из протонов и нейтронов, находящееся в центральной

части атома. Содержит в себе весь положительный заряд и большую часть массы атома (>99,95%).
Количество протонов в ядре, которое равно порядковому номеру элемента в Периодической системе Д.И.Менделеева и поэтому называется атомным номером элемента, определяет благодаря электронейтральности атома число электронов, а следовательно, электронное строение и определяемые им химические свойства элемента.
Количество нейтронов в ядрах атомов одного элемента может различаться; такие атомы называются изотопами этого элемента
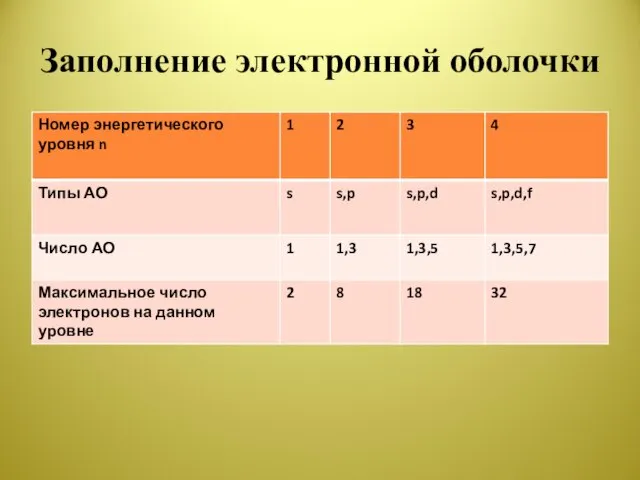
Слайд 7Заполнение электронной оболочки
Слайд 8Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода с относительной

атомной массой равной 12
1) 4; 2)12; 3)6; 4)2
Слайд 9Строение атома
Ядро любого химического элемента состоит из нуклонов.
2. Относительная масса одного нуклона

равна 1
3. Масса ядра изотопа углерода составляет 12 атомных единиц массы, следовательно, в составе его ядра 12 нуклонов.
4. В ядре химического элемента имеется два вида нуклонов, одни имеют заряд +1, другие 0.
5. Элементарная частица, имеющая массу 1 и заряд +1, называется протон.
6. В ядре атома изотопа углерода 12С находится 6 протонов
7. Элементарная частица, имеющая массу 1 и заряд 0, называется нейтрон.
8. Определим число нейтронов в ядре изотопа углерода 12С. С этой целью из числа нуклонов вычтем число протонов.
Число нейтронов = число нуклонов - число протонов.
В ядре атома изотопа углерода 12С находится нейтронов.
Ответ: в составе ядра изотопа углерода 12С имеется 6 протонов и 6 нейтронов
Слайд 10Строение атома
Составьте электронную формулу химического элемента № 17

Слайд 11Строение атома
1. Элемент № 17 называется хлор и имеет химический символ Cl.
2.

Элемент хлор находится в третьем периоде.
3. Внешним энергетическим уровнем в атоме хлора является уровень под номером 3.
4. Элемент хлор находится в группе номер VII.
5. Хлор входит в подгруппу А.
6. На внешнем электронном уровне атома хлора имеется 7 электронов.
7. Заряд ядра атома элемента хлора равен +17.
8. На трёх энергетических уровнях атома хлора располагаются 17 электронов.
9. На первом энергетическом уровне атома хлора располагаются 2 электрона.
10. Первый электронный уровень любого атома периодической системы, кроме атома водорода, можно представить так: 1s2.
Слайд 12Строение атома
11. На втором энергетическом уровне атома хлора находится 8 электронов.
17 -

(2 + 7) = 8
12. На втором энергетическом уровне имеются два подуровня s и р.
13. Число электронов в атоме хлора на втором s - подуровне равняется 2.
14. Число электронов в атоме хлора на втором р - подуровне равняется 6.
8 - 2 = 6
15. Число электронов находящихся на одной р -орбитали не может быть больше чем 2.
16. На втором энергетическом уровне в атоме хлора имеется три р - орбитали, расположенных перпендикулярно друг-другу.
17. Расположение электронов на втором энергетическом уровне можно записать так: 2s22p6. Если прибавить эту запись к ранее сделанной записи первого энергетического уровня, то получится:
1s22s22p6
Слайд 13Строение атома
18. На третьем энергетическом уровне в атоме хлора имеется три подуровня

s, р, d. Из них заполняется семью электронами только два s и р, d - подуровень остаётся пустым.
19. Расположение электронов на третьем энергетическом уровне можно записать так: 3s23p5. Если добавить эту запись к ранее сделанной записи первого и второго энергетического уровней, то получится электронная формула атома хлора:
1s22s22p63s23p5
Ответ: электронная формула атома хлора 1s22s22p63s23p5.
Слайд 14Строение атома
электронная формула иона Br-
1)… 2)…. 3)… 4)…

Слайд 15Строение атома
электронная формула атома брома Br0 1s22s22p63s23p63d104s24p5
атома брома Br0 превращается в ион

брома Br – присоединяя 1 e
электронная формула иона брома Br- 1s22s22p63s23p63d104s24p6
Слайд 16Строение атома
Атом металла имеет электронную конфигурацию 1s2 2s2 2p6 3s2, формула оксида,

гидроксида и сульфата этого элемента
1)ЭО; Э(ОН)2;ЭSO4 2) Э2О; ЭОН;Э2SO4
3)ЭО; ЭОН;ЭSO4 4)Э 2 О 2; Э(ОН)2;Э 2 SO4
Слайд 17Строение атома
1s2 2s2 2p6 3s2
Э+2
1)Э+2О-2; Э+2 (ОН)-2;Э+2SO4-2

Слайд 18ХИМИЧЕСКАЯ СВЯЗЬ
Задание :Укажите соединение с ионной связью
1) CaCl2; 2)SO2; 3)Br2 4)H2O

Слайд 19Окислительно-восстановительные процессы
Используя метод электронного баланса, составьте уравнение реакции:
Cr2O3 + … + KOH

→ KNO2+ K2CrO4 + …
Определите окислитель и восстановитель
Слайд 20Окислительно-восстановительные процессы
Cr2O3 + KNO3+ KOH → KNO2+ K2CrO4 + H2O

Слайд 21Окислительно-восстановительные процессы
1) Составлен электронный баланс:
N+5 + 2ē → N+3 3
2Cr+3– 6ē → 2Cr+6 1





















 Акциз практика
Акциз практика Сила трения 7 класс
Сила трения 7 класс Тема: Где и как переходить дорогу Классный час в 3 и 4 классе 2009-2010 уч. год
Тема: Где и как переходить дорогу Классный час в 3 и 4 классе 2009-2010 уч. год МАТЕМАТИКА В НАШЕЙ ШКОЛЕ
МАТЕМАТИКА В НАШЕЙ ШКОЛЕ БАД «Корень солодки»«Licorice root»
БАД «Корень солодки»«Licorice root» Презентация на тему Казачья хата (2 класс)
Презентация на тему Казачья хата (2 класс) Асфальтосмесительные установки Ardent
Асфальтосмесительные установки Ardent Информационные технологии в интегративной реабилитации детей в рамках ранней помощи
Информационные технологии в интегративной реабилитации детей в рамках ранней помощи Дружба
Дружба Основы цветоведения. Наука о цвете
Основы цветоведения. Наука о цвете Лига золото. Жидкая поталь
Лига золото. Жидкая поталь АВТОРСКИЕ ПРАВА основные понятия
АВТОРСКИЕ ПРАВА основные понятия Операционная деятельность в логистике. ГБПОУ Бурятский аграрный колледж им. М.Н. Ербанова. Ангаев Дмитрий
Операционная деятельность в логистике. ГБПОУ Бурятский аграрный колледж им. М.Н. Ербанова. Ангаев Дмитрий Защита уровня жизни. PPF Страхование жизни
Защита уровня жизни. PPF Страхование жизни Озорной Финдус
Озорной Финдус Возможности сервисов Google в организации современного урока
Возможности сервисов Google в организации современного урока Материнские платы Biostar
Материнские платы Biostar Тренды 2009
Тренды 2009 Общешкольное родительское собрание. Итоги учебной деятельности
Общешкольное родительское собрание. Итоги учебной деятельности Права ребёнка
Права ребёнка Кровоостанавливающие растения
Кровоостанавливающие растения Научный доклад
Научный доклад Вы готовы к занятию по технологии?
Вы готовы к занятию по технологии? 10.09 ИСиП-20-11-1
10.09 ИСиП-20-11-1 Профилактика правонарушений. Профилактика вредных привычек
Профилактика правонарушений. Профилактика вредных привычек Язык культуры разнообразен
Язык культуры разнообразен Проведение государственной (итоговой) аттестации обучающихся9,11классовв 2011-12 уч. году
Проведение государственной (итоговой) аттестации обучающихся9,11классовв 2011-12 уч. году Физическая культура. Волейбол
Физическая культура. Волейбол