Содержание
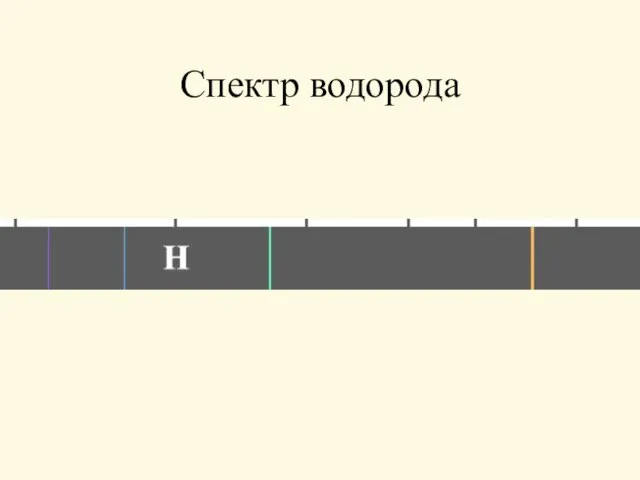
- 2. Спектр водорода
- 3. Экспериментальные данные И. Бальмер (1885г.) п=3, 4, 5 и т.д., R= 3,21015ּ Гц R - "постоянная
- 4. Экспериментальные данные Ф. Пашен п= 4, 5 и т.д.
- 5. Экспериментальные данные Т. Лайман п= 2, 3, 4, 5 и т.д.
- 6. Первый постулат Бора (постулат стационарных состояний) Атомная система может находится только в особых стационарных или квантовых
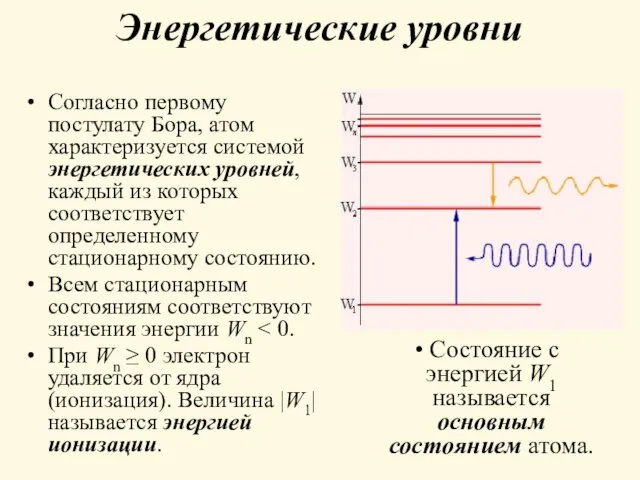
- 7. Энергетические уровни Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному
- 8. при переходе атома из одного стационарного состояния с энергией Wn в другое стационарное состояние с энергией
- 9. Правило квантования (отбора орбит) момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные
- 10. Атом водорода по Н.Бору По правилу квантования:
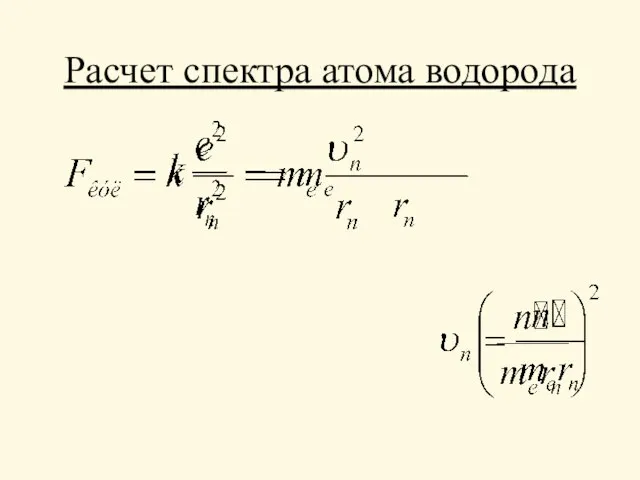
- 11. Расчет спектра атома водорода
- 12. Расчет атома водорода rn ~ n2
- 13. Кинетическая энергия атома водорода
- 14. Потенциальная энергия атома водорода
- 15. Энергия атома водорода
- 16. Формула И.Ридберга (1890) Для серии Бальмера m = 2, n = 3, 4, 5, ... .
- 17. Постоянная Ридберга
- 19. Скачать презентацию








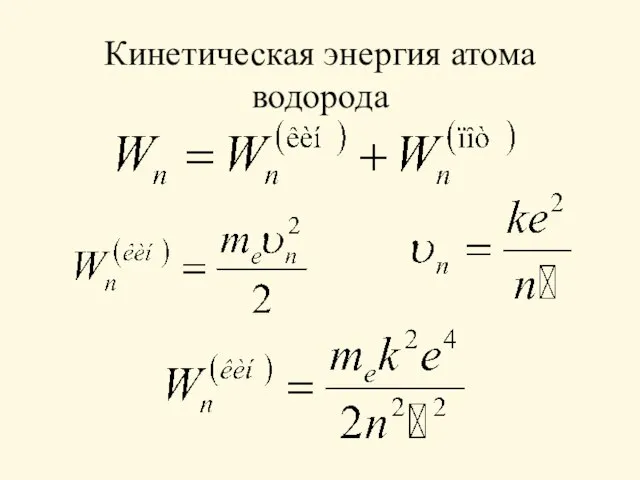




 Установление империи в Риме
Установление империи в Риме Шаблон презентации
Шаблон презентации Моя родина - Россия 4 класс
Моя родина - Россия 4 класс Семинар 1. Знакомство с языками программирования
Семинар 1. Знакомство с языками программирования Оценка инвестиционных проектов
Оценка инвестиционных проектов Презентация на тему "Формы работы с активом детских организаций (Методические рекомендации организаторам детского движения )&quo
Презентация на тему "Формы работы с активом детских организаций (Методические рекомендации организаторам детского движения )&quo 2 сентября 2009 г.
2 сентября 2009 г. Презентация на тему Мой любимый Волгодонск
Презентация на тему Мой любимый Волгодонск Международная Инвестиционная Премия «Инвестиционный Ангел»
Международная Инвестиционная Премия «Инвестиционный Ангел» Импульс
Импульс Розробити технологічний процес складання та ремонту противопожежної системи двигунів АІ-450М вертольота МІ-2МСБ
Розробити технологічний процес складання та ремонту противопожежної системи двигунів АІ-450М вертольота МІ-2МСБ Противоэрозионные мероприятия
Противоэрозионные мероприятия Природа Европейского Севера
Природа Европейского Севера ИНДИКАТОРНЫЙ АНАЛИЗ
ИНДИКАТОРНЫЙ АНАЛИЗ  Дифференциация букв и звуков О-У
Дифференциация букв и звуков О-У Особенности развития современных дошкольников
Особенности развития современных дошкольников Рецепт успешного политического лидера
Рецепт успешного политического лидера Социально-психологическое сопровождение детей с ограничеными возможностями
Социально-психологическое сопровождение детей с ограничеными возможностями Допинг
Допинг тестирование обучающихся образовательных учреждений Санкт-Петербурга с использованием АИС «Знак» по общеобразовательным пред
тестирование обучающихся образовательных учреждений Санкт-Петербурга с использованием АИС «Знак» по общеобразовательным пред ПРИЗНАКИ ТЕКСТА
ПРИЗНАКИ ТЕКСТА 22 марта 2011 г. Процедура проведения закупок кафедрами и подразделениями в 2011 году
22 марта 2011 г. Процедура проведения закупок кафедрами и подразделениями в 2011 году Наши соседи - белки
Наши соседи - белки Седация в анестезиологии и интенсивной терапии
Седация в анестезиологии и интенсивной терапии но
но Предстартовый синдром. Психологическая подготовка спортсмена
Предстартовый синдром. Психологическая подготовка спортсмена The Political Consequences of Brexit
The Political Consequences of Brexit УРОК - презентация "Олимпийские чемпионы"
УРОК - презентация "Олимпийские чемпионы"