Содержание
- 2. И это всё о ней… Это вещество было описано в VIII веке арабским алхимиком Джабиром ибн
- 3. Знаете ли Вы, почему HNO3 назвали… к и с л о т о й ? взрывоопасной
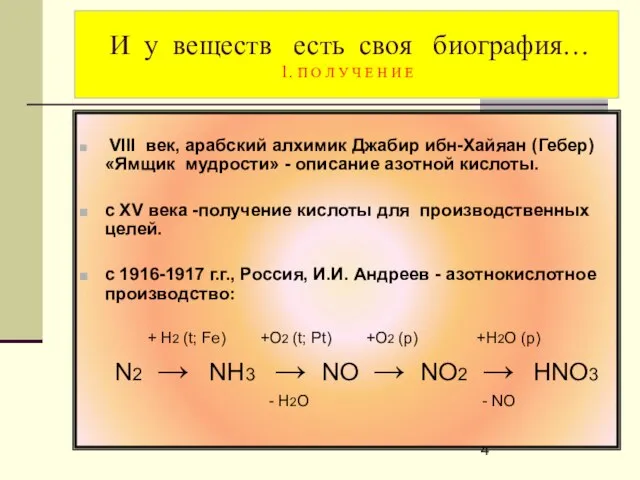
- 4. И у веществ есть своя биография… 1. П О Л У Ч Е Н И Е
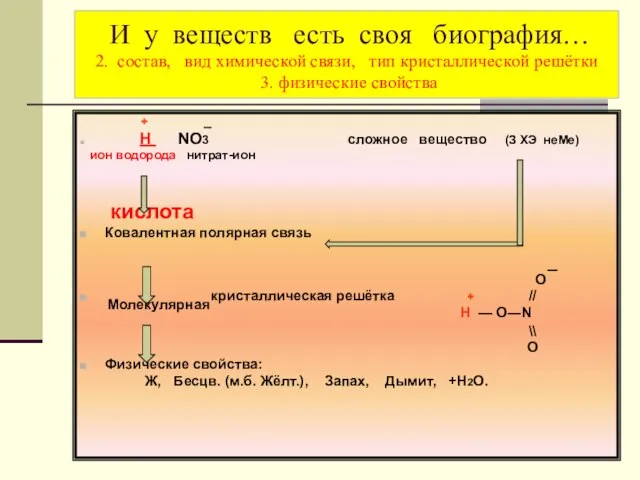
- 5. И у веществ есть своя биография… 2. состав, вид химической связи, тип кристаллической решётки 3. физические
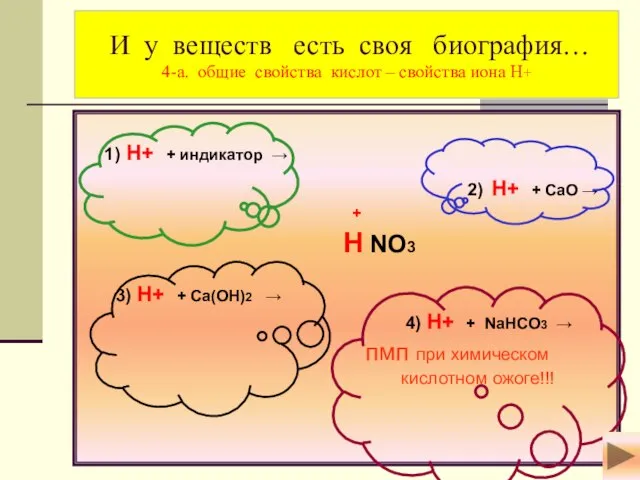
- 6. 1) H+ + индикатор → 2) H+ + СaO → + H NO3 3) H+ +
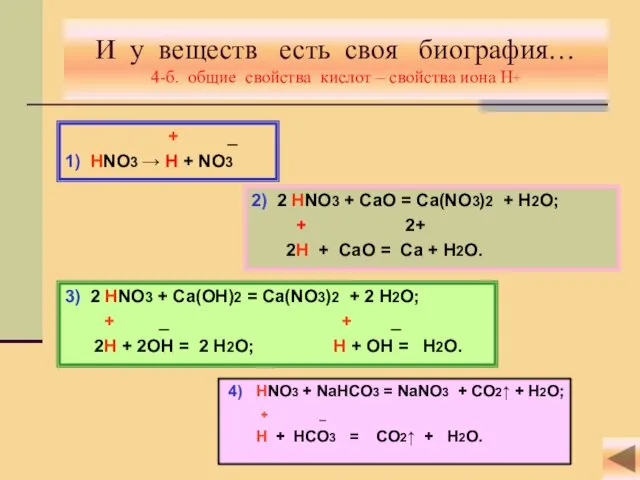
- 7. И у веществ есть своя биография… 4-б. общие свойства кислот – свойства иона Н+ + _
- 8. И у веществ есть своя биография… 5. особые свойства +5 -3, 0, +1, +2, +3, +4
- 9. И у веществ есть своя биография… 5-а. особое «царское» свойство 1 HNO3 + 3 HCl «Царская
- 10. И у веществ есть своя биография… 5-б. особое «взрывоопасное» свойство 4 HNO3 t 4 NO2 ↑
- 11. Эта страница для Ваших открытий… А пока … Д/З: § 27 (с.156-157), закончить и выучить записи
- 13. Скачать презентацию






 Паспорт объекта сети Харьковская региональная дирекция
Паспорт объекта сети Харьковская региональная дирекция Презентация на тему Средства для борьбы с насекомыми
Презентация на тему Средства для борьбы с насекомыми Задачи и методы современной психологии
Задачи и методы современной психологии Подходы к моделированию ГРА
Подходы к моделированию ГРА Технология продуктивного чтения или формирование типа правильной читательской деятельности
Технология продуктивного чтения или формирование типа правильной читательской деятельности Заработать в интернете без вложений и без продаж
Заработать в интернете без вложений и без продаж Понятие стратегического менеджмента
Понятие стратегического менеджмента Ультразвуковой уровнемер на микроконтроллере PIC16F628
Ультразвуковой уровнемер на микроконтроллере PIC16F628 Роза из бумаги
Роза из бумаги ОАО «Противокарстовая и береговая защита» 606019, Нижегородская обл., г.Дзержинск, ул.Гастелло, 10/15 Тел./факс (8313) 25-98-01 E-mail:
ОАО «Противокарстовая и береговая защита» 606019, Нижегородская обл., г.Дзержинск, ул.Гастелло, 10/15 Тел./факс (8313) 25-98-01 E-mail:  Готовимся к части С
Готовимся к части С EBG Customer Training Map
EBG Customer Training Map Виды и назначение технологических карт
Виды и назначение технологических карт Учредитель: Администрация Городского округа «Город Волжск». Адрес:425000, ул. Коммунистическая, д.1.
Учредитель: Администрация Городского округа «Город Волжск». Адрес:425000, ул. Коммунистическая, д.1. Презентация на тему Русь и Золотая Орда (6 класс)
Презентация на тему Русь и Золотая Орда (6 класс) Анализ системы подготовки и аттестации кадров предприятия туризма. Задание 5
Анализ системы подготовки и аттестации кадров предприятия туризма. Задание 5 Нетрадиционная техника рисования граттаж Праздничный салют
Нетрадиционная техника рисования граттаж Праздничный салют сочинение
сочинение Проект « Профессии наших родителей»
Проект « Профессии наших родителей» Натюрморт
Натюрморт Ц у н а м и
Ц у н а м и Публичная презентация результатов педагогической деятельностии инновационной работыучителя начальных классов МКОУ «Лицей се
Публичная презентация результатов педагогической деятельностии инновационной работыучителя начальных классов МКОУ «Лицей се Психологический климат в семье (8 класс)
Психологический климат в семье (8 класс) Игры с залом PowerPoint
Игры с залом PowerPoint Кулинарный поединок
Кулинарный поединок Food rap
Food rap ЗУП КОРП: реализованная функциональность и выпуск конфигурации Докладчик: Лохтин Т.О.
ЗУП КОРП: реализованная функциональность и выпуск конфигурации Докладчик: Лохтин Т.О. Правила судейства игры Баскетбол
Правила судейства игры Баскетбол