Содержание
- 2. Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде
- 3. Её величество Азотная кислота Яконюк Вера Сергеевна учитель химии МОУ Знаменская СОШ Урок химии 9класс
- 4. СОДЕРЖАНИЕ: Историческая справка Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические
- 5. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O)
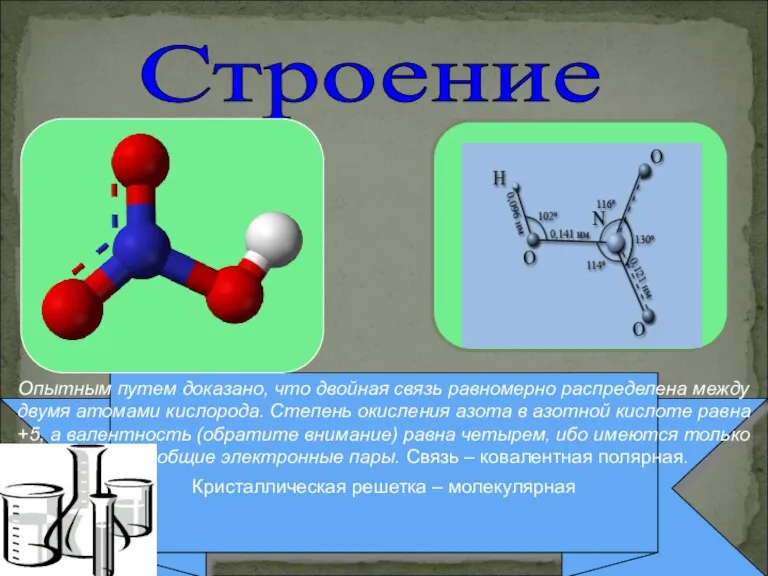
- 6. Опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в
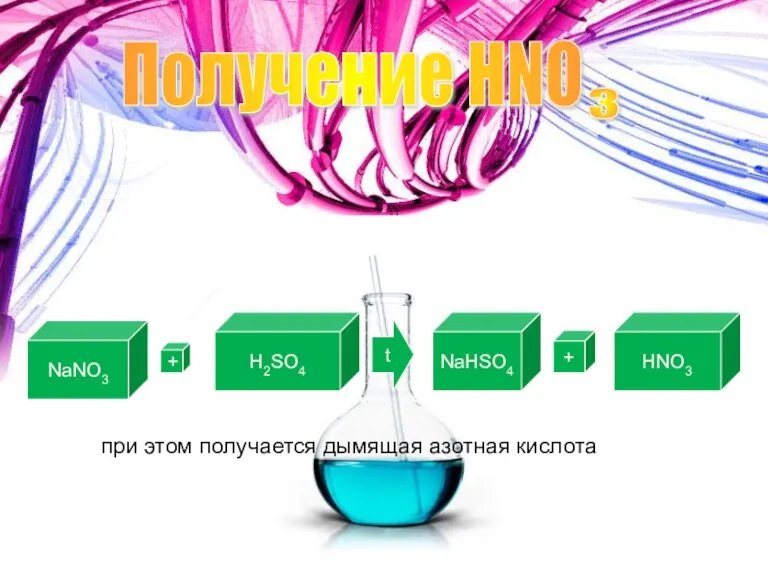
- 7. Получение HNO 3 Лабороторный способ получения: NaNO3 + H2SO4 t NaHSO4 + HNO3 при этом получается
- 8. Промышленный способ 1. Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO
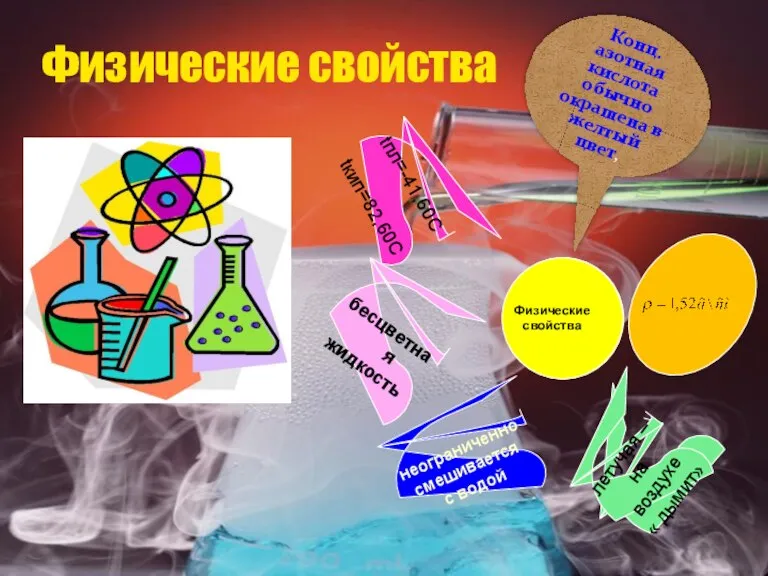
- 9. Физические свойства Физические свойства бесцветная жидкость tпл=-41,60C tкип=82,60C неограниченно смешивается с водой летучая – на воздухе
- 10. Исследования (задания по группам): (Повторение ПТБ!). 1 группа: провести реакцию раствора азотной кислоты и оксида меди
- 11. Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO
- 12. Общие с другими кислотами: 1. Сильный электролит, хорошо диссоциируют на ионы HNO3 -> H+ +NO3- Изменяет
- 13. Специфические: При нагревании и под действием света разлагается 4HNO3 = 2H2O + 4NO2 + O2 Реагирует
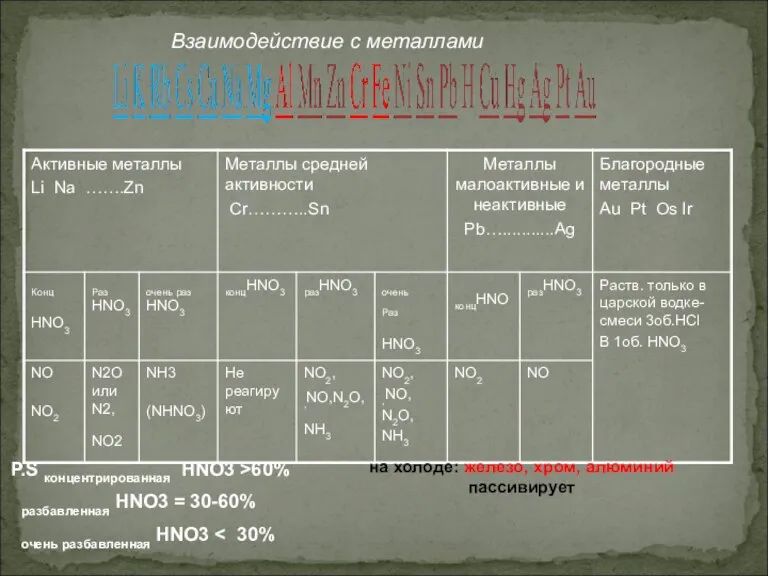
- 14. Взаимодействие азотной кислоты с металлами изучено довольно хорошо, т.к. конц. HNO3 используется в качестве окислителя ракетного
- 15. Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме: HNO3(р.)+Me(до
- 16. P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 на холоде: железо, хром, алюминий
- 17. Применение Азотной кислоты: - производство азотных и комбинированных удобрений, -взрывчатых веществ (тринитротолуола и др.), -органических красителей.
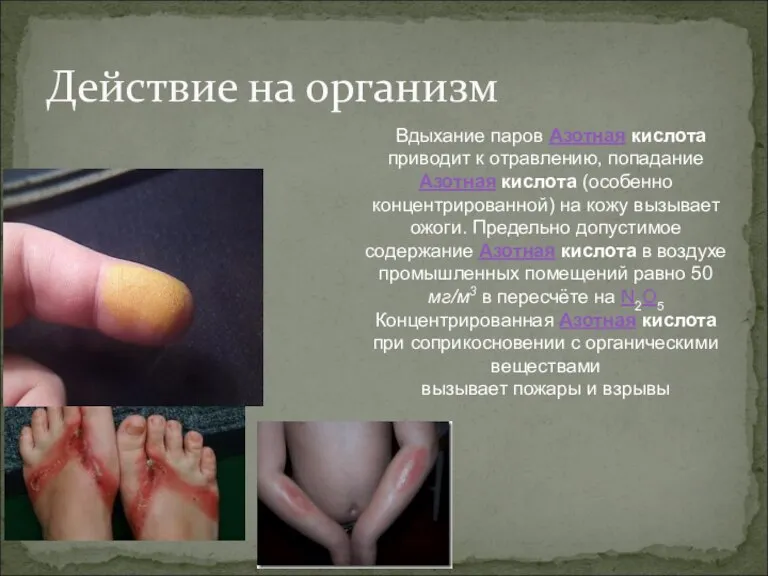
- 18. Действие на организм Вдыхание паров Азотная кислота приводит к отравлению, попадание Азотная кислота (особенно концентрированной) на
- 19. Проверь себя: Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3
- 20. 1 - в 2 - б 3 - а 4 - а 5 - б ключ
- 21. вывод: 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами,
- 22. Домашнее задание: §26 упр 4,5 Творческое задание –презентация история открытия азотной кислоты. Применение азотной кислоты
- 23. Спасибо за урок
- 25. Скачать презентацию

















 Пиломатериалы, получение и применение
Пиломатериалы, получение и применение Совместное использование пакета Microsoft Office Excel 2007 и служб интеллектуального анализа данных SQL Server Analysis Services
Совместное использование пакета Microsoft Office Excel 2007 и служб интеллектуального анализа данных SQL Server Analysis Services Управление качеством
Управление качеством Стиль модерн и сопряжение
Стиль модерн и сопряжение «Удивительный мир многогранников»
«Удивительный мир многогранников» Промышленная Группа СОЮЗ. Многопрофильный холдинг, производитель полного спектра мебельных комплектующих для сборки мебели
Промышленная Группа СОЮЗ. Многопрофильный холдинг, производитель полного спектра мебельных комплектующих для сборки мебели Автономные энергетические системы на базе нетрадиционных источников энергии для горных поселений КР
Автономные энергетические системы на базе нетрадиционных источников энергии для горных поселений КР Модели и технологии обучения персонала розницы в период изменений
Модели и технологии обучения персонала розницы в период изменений Чрезвычайные ситуации техногенного характера
Чрезвычайные ситуации техногенного характера Тема проповеди: Виденье церковное – мое виденье
Тема проповеди: Виденье церковное – мое виденье Из конфликта в эффективную коммуникацию
Из конфликта в эффективную коммуникацию Политические режимы. Урок 3
Политические режимы. Урок 3 Зрительное восприятие цвета
Зрительное восприятие цвета Стратегия развития современных технологий мобильной связи на Дальнем Востоке и в Восточной Сибири
Стратегия развития современных технологий мобильной связи на Дальнем Востоке и в Восточной Сибири Сачки и дезертиры
Сачки и дезертиры Художественные образы СПБ: российский город на перекрёстке мировых культур
Художественные образы СПБ: российский город на перекрёстке мировых культур Фактори забезпечення конкурентоспроможності підприємства
Фактори забезпечення конкурентоспроможності підприємства Три клада у Природы есть:вода,Земля и воздух – три ее основы.Какая бы ни грянула беда,Целы они – все возродится снова.
Три клада у Природы есть:вода,Земля и воздух – три ее основы.Какая бы ни грянула беда,Целы они – все возродится снова. Конвейер проектов. Критерии и роли. Специфика выполнения
Конвейер проектов. Критерии и роли. Специфика выполнения Проектно-изыскательские работы. Градостроительная документация. Лекция 1
Проектно-изыскательские работы. Градостроительная документация. Лекция 1 Добыча нефти
Добыча нефти Презентация на тему Правописание падежных окончаний имен существительных единственного числа (4 класс)
Презентация на тему Правописание падежных окончаний имен существительных единственного числа (4 класс) THE PRESENT PERFECT TENSE НАСТОЯЩЕЕ СОВЕРШЕННОЕ ВРЕМЯ
THE PRESENT PERFECT TENSE НАСТОЯЩЕЕ СОВЕРШЕННОЕ ВРЕМЯ Кобелев Н.Б.ВЗФЭИ, Москва
Кобелев Н.Б.ВЗФЭИ, Москва Театрально-игровая деятельность - как средство развития творческих способностей детей дошкольного возраста
Театрально-игровая деятельность - как средство развития творческих способностей детей дошкольного возраста Презентация на тему Частица как служебная часть речи.
Презентация на тему Частица как служебная часть речи.  Спасенный сад
Спасенный сад Караоке-баттл 99 баллов. Описание игры
Караоке-баттл 99 баллов. Описание игры