Содержание
- 2. Внутренняя среда организма формируется совокупностью биологических жидкостей (кровь, лимфа, тканевая жидкость), омывающих клетки и структуры тканей.
- 4. Химический состав плазмы
- 5. Функции крови Дыхательная -транспорт кислорода от легких к тканям и CO2 от тканей к легким Выделительная
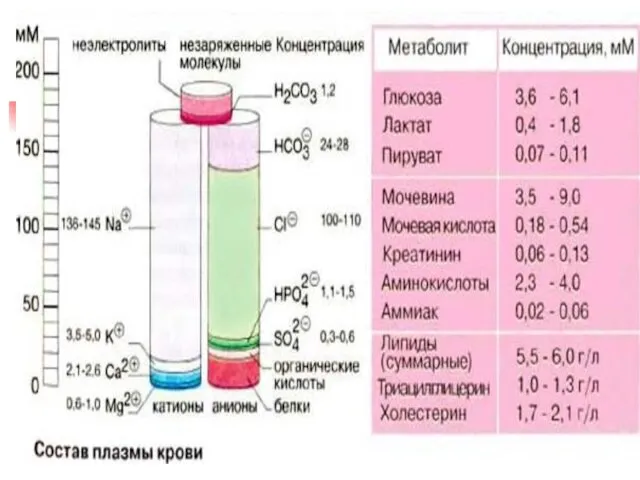
- 6. Химический состав крови Большую часть этих функций выполняют компоненты плазмы крови. Плазма крови состоит на 90-93%
- 7. Характеристика белков плазмы крови содержатся в плазме крови синтезируются в печени или РЭС (реже в специализированных
- 8. Состав белков плазмы крови В плазме обнаружено более 100 разных белков соответствующих этим критериям, содержание которых
- 9. Остаточный азот Все азотсодержащие вещества плазмы образуют общий пул азота, состоящий из: Азота белкового – осаждаемого
- 10. Состав ОА Мочевина - 50% (главный компонент) АК - 25% (~ 10% ГЛУ и ГЛН) Ураты
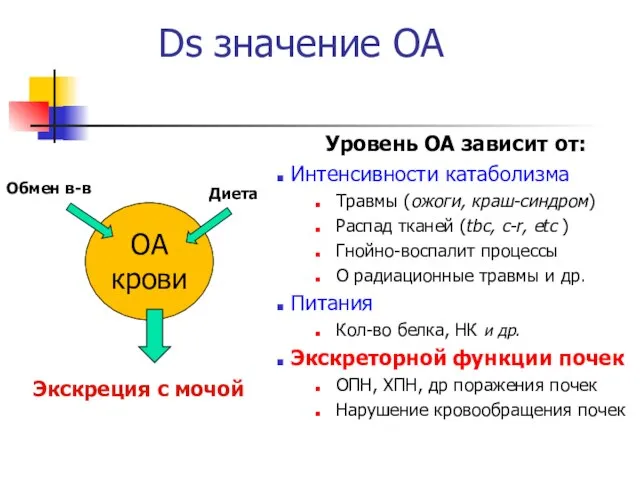
- 11. Ds значение ОА Уровень ОА зависит от: Интенсивности катаболизма Травмы (ожоги, краш-синдром) Распад тканей (tbc, c-r,
- 12. Азотемия - повышение уровня ОА в крови Ретенционная – задержка компонентов ОА в организме из-за нарушения
- 13. Общие понятия КОС КОС – система гомеостаза рН внутри- и внеклеточной среды организма. Единицы измерения :рН
- 14. рН – производное метаболизма За сутки организм hs образует 50-100 мМ [Н+] на 15-20л ВКЖ. Весь
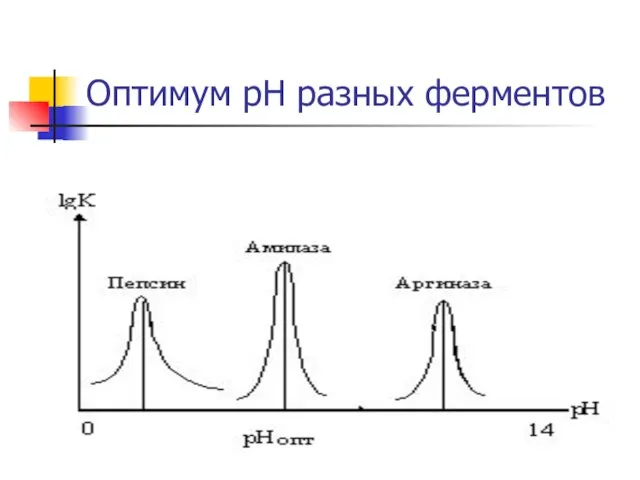
- 15. Стабильный рН - необходимое условие метаболизма Изменение рН приводит к изменению: заряда и функции белков (ферментов,
- 16. Оптимум рН разных ферментов
- 17. Изоосмолярность – осм. давление=310 осМ/л - const любые изменения должны поддерживать эту константу Электронейтральность – (по
- 19. Механизмы регуляции КОС Физико-хим – действует в автоматическом режиме и представлен: разбавлением т.е. выходом Н+ или
- 20. Классификация нарушений КОС рНО =7.40±0.04 рН = 7.35 и ниже – ацидоз рН = 7.45 и
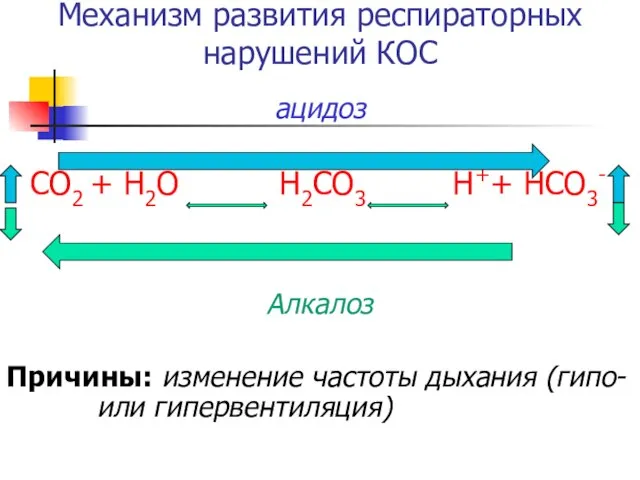
- 21. Механизм развития респираторных нарушений КОС ацидоз СО2 + Н2О Н2СО3 Н++ НСО3- Алкалоз Причины: изменение частоты
- 22. Межорганное взаимодействие в регуляции рН Если этих респираторных механизмов недостаточно, то активируются др.экскреторные системы. В печени
- 25. Эритропоэтин (Эпо) Эпо – цитокин, специфический регулятор эритропоэза в костном мозге Эпо человека – гликопротеид, состоит
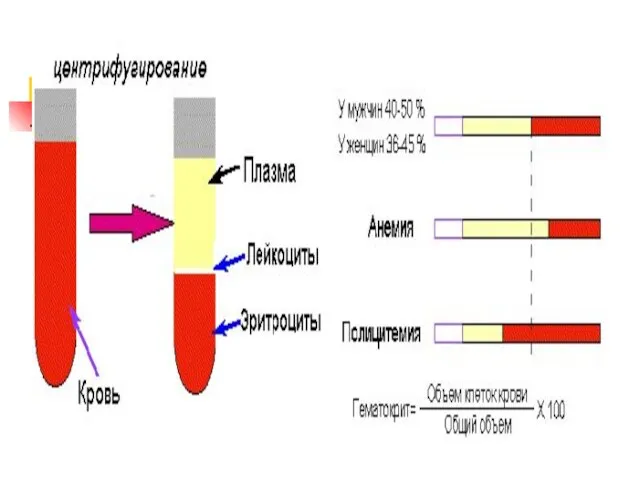
- 26. Э общий обзор Кол-во Э у мужчин - 4.6-6.2 млн/мкл крови, а у женщин - 4.2-5.4
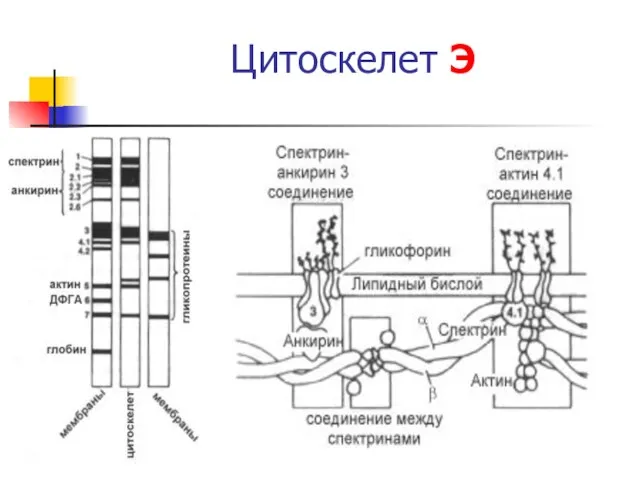
- 27. Цитоскелет Э
- 28. Структура цитоскелета Э Большинство мембран Э - интегральные Б, гликопротеиды. Б без углеводной части находятся на
- 29. Метаболизм глюкозы в Э Глюкоза в Э используется в: Гликолизе (90-95%) – образование АТФ ПФП (10-5%)
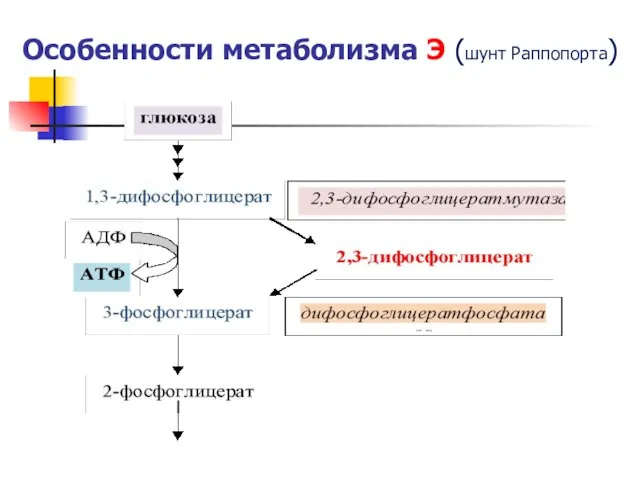
- 30. Особенности метаболизма Э (шунт Раппопорта)
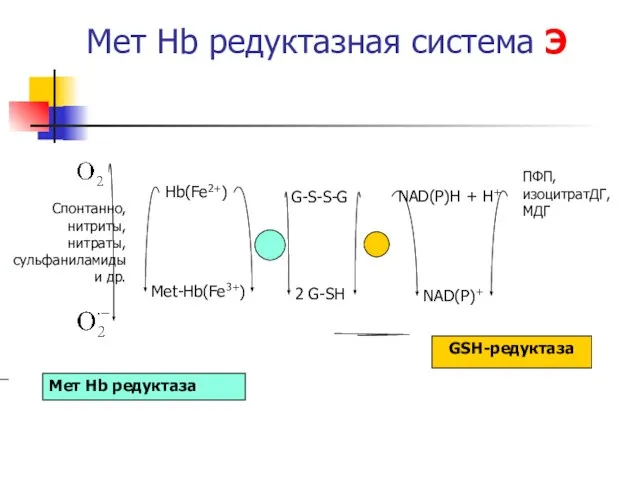
- 31. Мет Hb редуктазная система Э Hb(Fe2+) Met-Hb(Fe3+) 2 G-SH G-S-S-G NAD(P)H + H+ NAD(P)+ Мет Hb
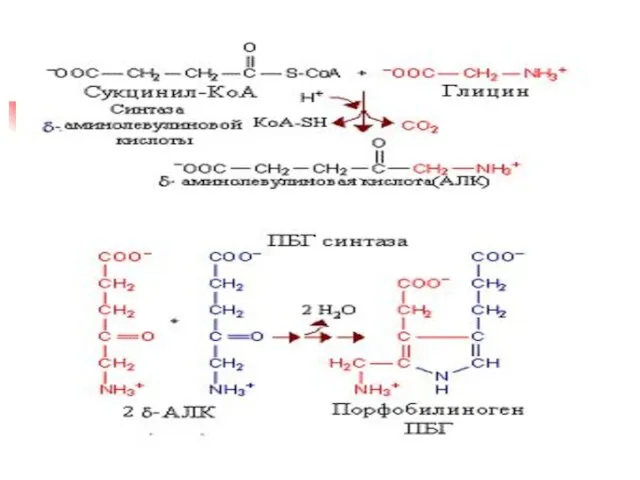
- 32. Синтез порфобилиногена и гема Первая реакция б/с гема происходит в Мх и происходит путем конденсации гли
- 34. Синтез порфобилиногена и гема (прод) Затем следует этап конденсации (голова-хвост) 4 молекул порфобилиногена с образованием линейного
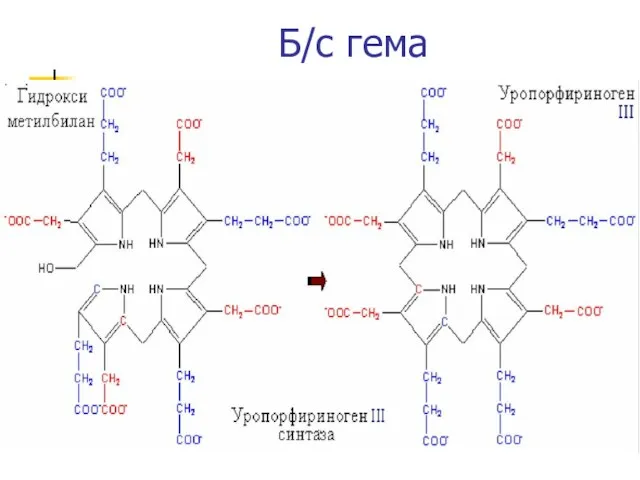
- 35. Б/с гема
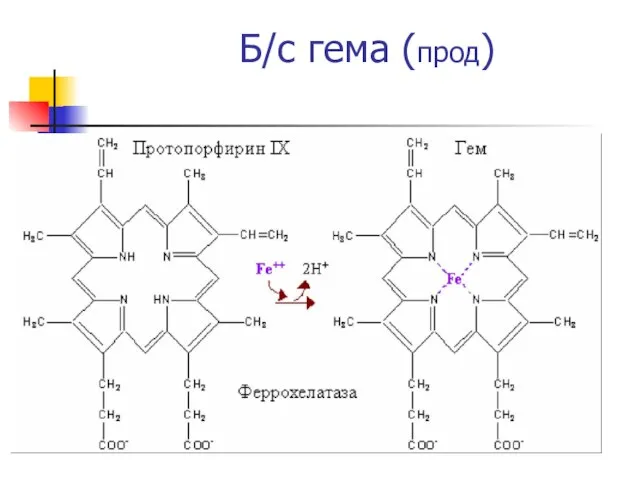
- 36. Б/с гема (прод)
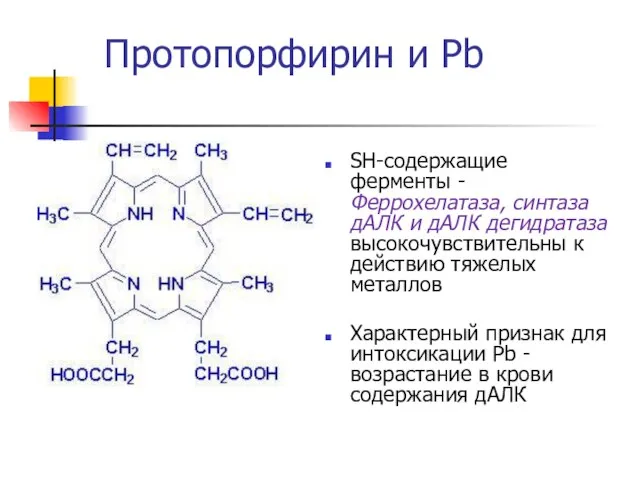
- 37. SH-содержащие ферменты - Феррохелатаза, синтаза дАЛК и дАЛК дегидратаза высокочувствительны к действию тяжелых металлов Характерный признак
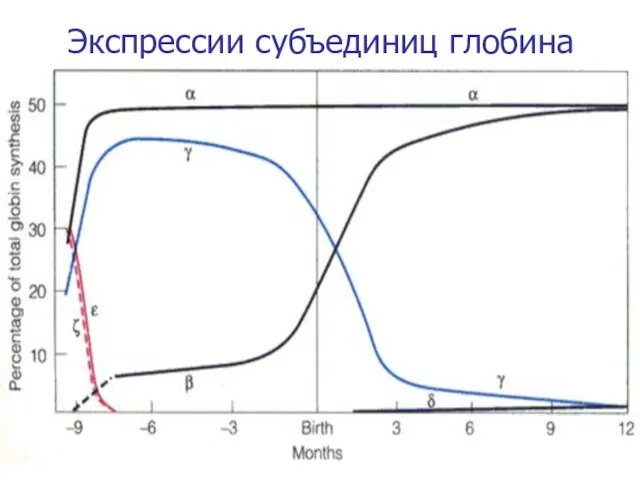
- 38. Экспрессии субъединиц глобина
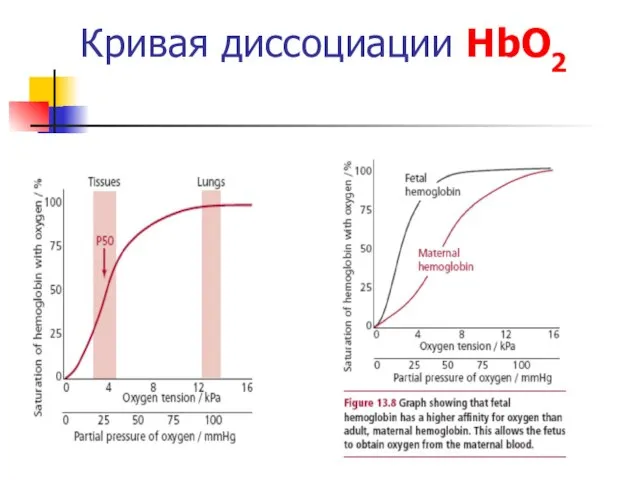
- 39. Кривая диссоциации HbО2
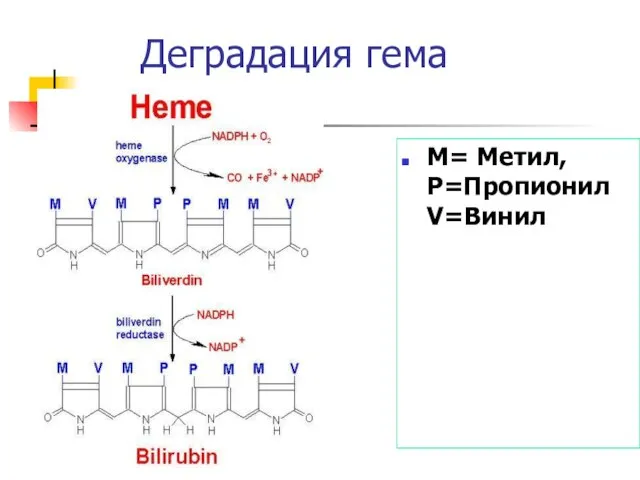
- 40. Распад гема Продолжительность жизни Э ~120 дней, ежедневный оборот Hb ~6 г/день. Гем из старых Э
- 41. Образование билирубина Следующий этап СН2 мост (между кольцами III и IV) биливердина восстанавливается биливердин редуктазой до
- 42. Деградация гема M= Метил, P=Пропионил V=Винил
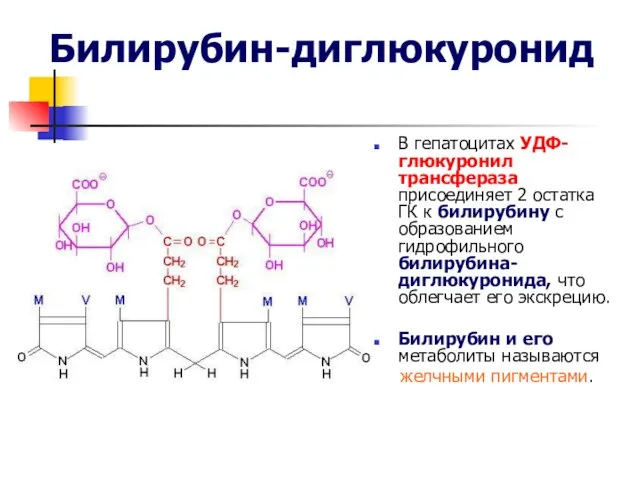
- 43. Билирубин-диглюкуронид В гепатоцитах УДФ-глюкуронил трансфераза присоединяет 2 остатка ГК к билирубину с образованием гидрофильного билирубина-диглюкуронида, что
- 44. Клинические аспекты метаболизма гема представлены в виде: Дефектов ферментов и нарушения б/с гема – порфирий, которые
- 45. Желтухи Гипербилирубинемия проявляется в виде желтух – желтой пигментации кожи и слизистых. В норме в кишечнике
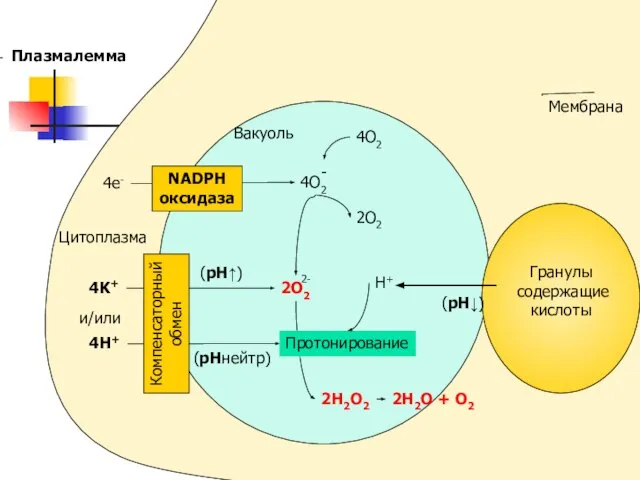
- 46. Нейтрофилы (гранулоциты) –полиморфноядерные лейкоциты: обладают выраженной способностью к фагоцитозу, Хорошо развитый, подвижный цитоскелет, Активное Мх и
- 47. 4O2 2O2 H+ 2H2O2 2H2O + O2 (pH↓) Цитоплазма 4e- Вакуоль 4K+ и/или 4H+ (pHнейтр) (pH↑)
- 49. Скачать презентацию










![рН – производное метаболизма За сутки организм hs образует 50-100 мМ [Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382117/slide-13.jpg)
















 New Year Merry Christmas
New Year Merry Christmas Компания DominiSoft www.dominisoft.ru Компания “БУКА” www.buka.ru www.bukasoft.ru
Компания DominiSoft www.dominisoft.ru Компания “БУКА” www.buka.ru www.bukasoft.ru ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ, КАК ВЗАИМОДЕЙСТВИЕ УЧЕНИКА И УЧИТЕЛЯ.
ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ, КАК ВЗАИМОДЕЙСТВИЕ УЧЕНИКА И УЧИТЕЛЯ. Презентация на тему природа коми края
Презентация на тему природа коми края Синдром эмоционального выгорания
Синдром эмоционального выгорания Система образования и проблемы её структуры
Система образования и проблемы её структуры Волейбол. 5-7 классы
Волейбол. 5-7 классы Война — жесточе нету слова,Война — печальней нету слова. Война — святее нету слова В тоске и славе этих лет.И на устах у нас иного
Война — жесточе нету слова,Война — печальней нету слова. Война — святее нету слова В тоске и славе этих лет.И на устах у нас иного Евгений Львович Шварц (1896-1958)
Евгений Львович Шварц (1896-1958) Водоёмы нашей местности
Водоёмы нашей местности Фармакоэпидемиологические и фармакоэкономические аспекты нежелательных реакций лекарственных препаратов – неявная проблема и
Фармакоэпидемиологические и фармакоэкономические аспекты нежелательных реакций лекарственных препаратов – неявная проблема и  Зиянкестердің экономикалық шекті. Зиянын табиғи жауларының тиімділігінің деңгейін анықтау. (Лекция 15)
Зиянкестердің экономикалық шекті. Зиянын табиғи жауларының тиімділігінің деңгейін анықтау. (Лекция 15) Séjour d’études linguistiques Découverte de la Provence
Séjour d’études linguistiques Découverte de la Provence Символи України. Національний український одяг
Символи України. Національний український одяг Законы развития теории судебной экспертизы
Законы развития теории судебной экспертизы Командный проект. Бизнес-задача
Командный проект. Бизнес-задача Взаимодействие с заинтересованными сторонами при подготовке интегрированных отчетов
Взаимодействие с заинтересованными сторонами при подготовке интегрированных отчетов Экономить - значит зарабатывать! Плакат для рабочих
Экономить - значит зарабатывать! Плакат для рабочих Что такое деятельность
Что такое деятельность Микеланджело
Микеланджело  Лучший центр. Белорецк. Скалодром
Лучший центр. Белорецк. Скалодром Здоровьесберегающие технологии в образовательном процессе. Подготовил: зам.директора по УВР Павлов В.В.
Здоровьесберегающие технологии в образовательном процессе. Подготовил: зам.директора по УВР Павлов В.В. Лекция 5. Проблема психологического контроля и управления спортивной деятельностью
Лекция 5. Проблема психологического контроля и управления спортивной деятельностью Опорные схемы и рисунки в помощь учащимся
Опорные схемы и рисунки в помощь учащимся Топология компьютерных сетей
Топология компьютерных сетей Процессоры фирм Intel и AMD
Процессоры фирм Intel и AMD Стили в одежде
Стили в одежде «1С:Предприятие 8. Управление водоканалом»
«1С:Предприятие 8. Управление водоканалом»