Содержание
- 2. Литература к курсу биохимии Основной 1. Основы биохимии / Под ред. А.А. Анисимова. М., 1986. 2.
- 3. Биохимия – это наука о веществах, из которых построены живые организмы и о химических процессах, протекающих
- 4. Основные задачи биохимии: исследование взаимосвязи строения веществ и их функций; изучение превращения химических соединений и преобразования
- 5. Открытия, подготовившие возникновение биохимии 1748 год – М.В. Ломоносов открыл закон сохранения материи и показал его
- 6. История биохимии В 1828 году немецкий химик Вёлер синтезировал в лаборатории мочевину из циановой кислоты и
- 7. 1880г. – возникает учение о витаминах - начало которому положили работы русского ученого Н.И. Лунина 19
- 8. В 20 веке биохимия достигла подлинного расцвета. В 1902 году Эмиль Фишер с сотрудниками впервые осуществил
- 9. Особенности химического состава живой материи Общая масса всех живых организмов, населяющих земной шар, 10 13 –
- 10. В организме человека содержится свыше 50 000 индивидуальных белков Ферменты Регуляторные белки Рецепторные белки. Транспортные белки
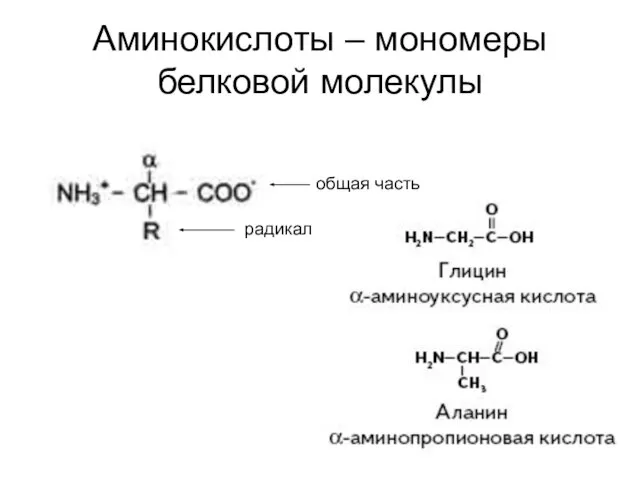
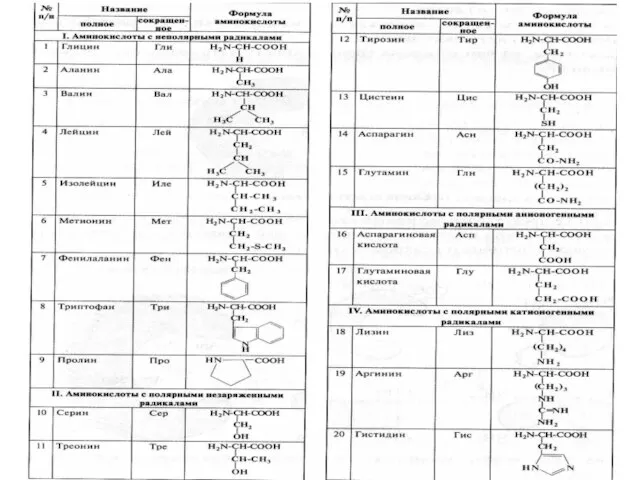
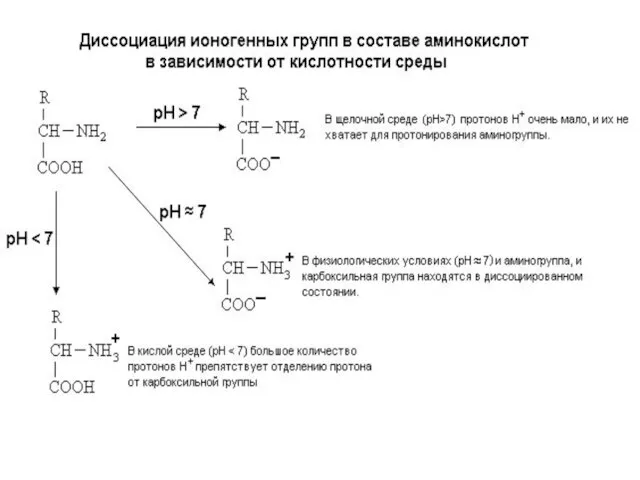
- 11. Аминокислоты – мономеры белковой молекулы общая часть радикал
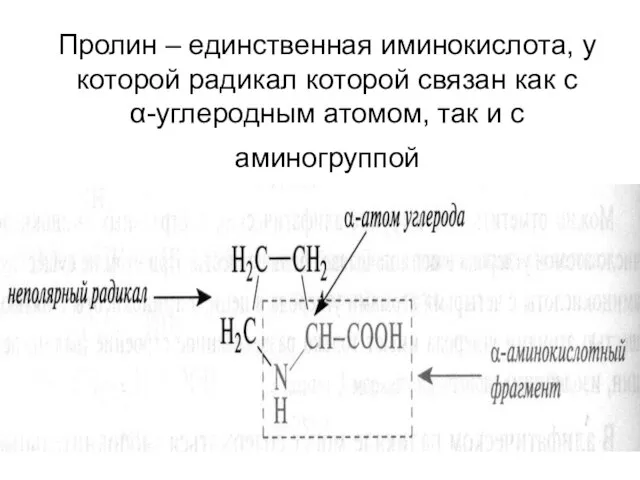
- 12. Пролин – единственная иминокислота, у которой радикал которой связан как с α-углеродным атомом, так и с
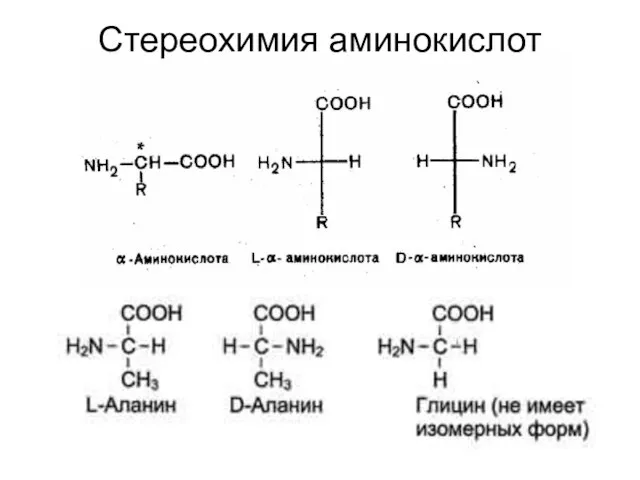
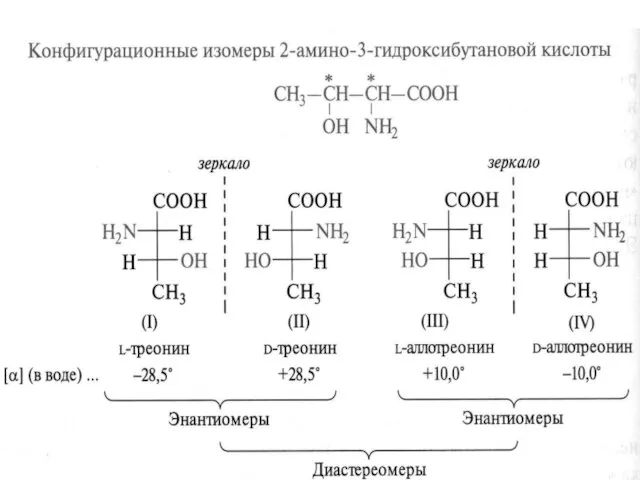
- 13. Стереохимия аминокислот
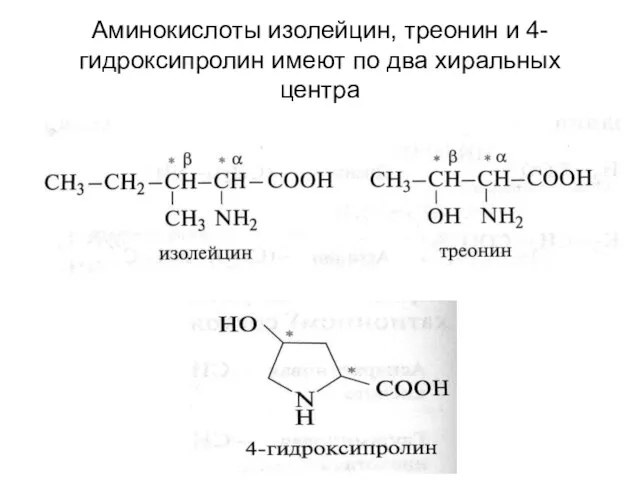
- 14. Аминокислоты изолейцин, треонин и 4-гидроксипролин имеют по два хиральных центра
- 16. Приняты три классификации аминокислот: биологическая или физиологическая, т.е. по степени незаменимости для организма. Делят на заменимые,
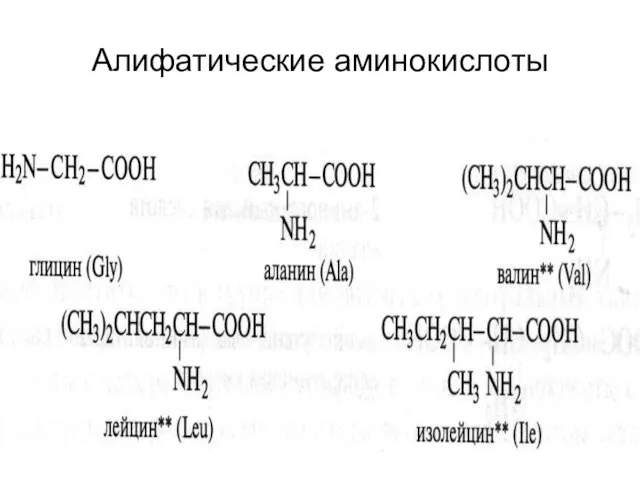
- 18. Алифатические аминокислоты
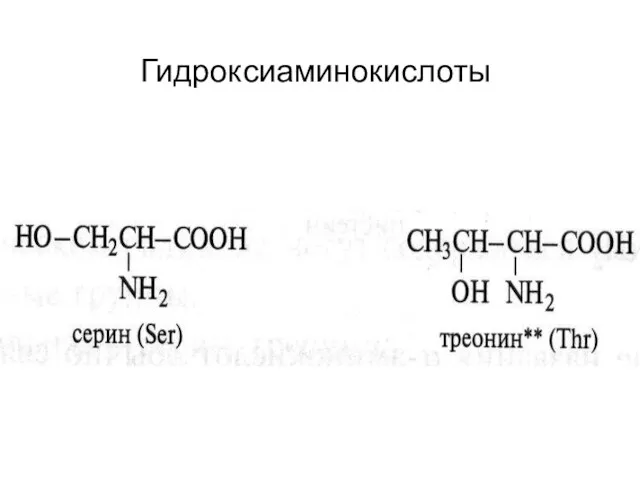
- 19. Гидроксиаминокислоты
- 20. Аминокислоты, содержащие дополнительную карбоксильную группу (моноаминодикарбоновые)
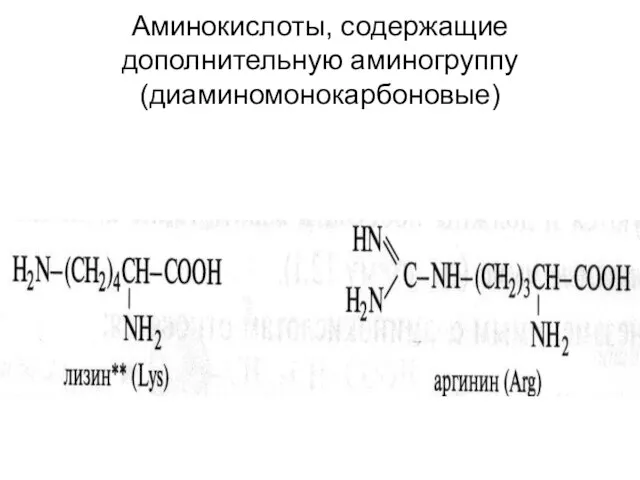
- 21. Аминокислоты, содержащие дополнительную аминогруппу (диаминомонокарбоновые)
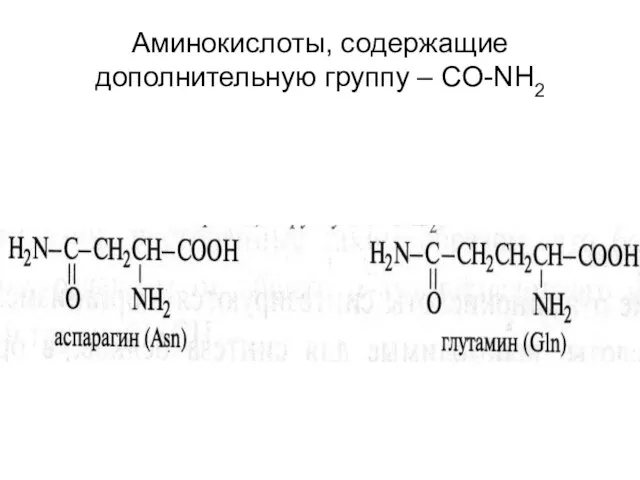
- 22. Аминокислоты, содержащие дополнительную группу – CO-NH2
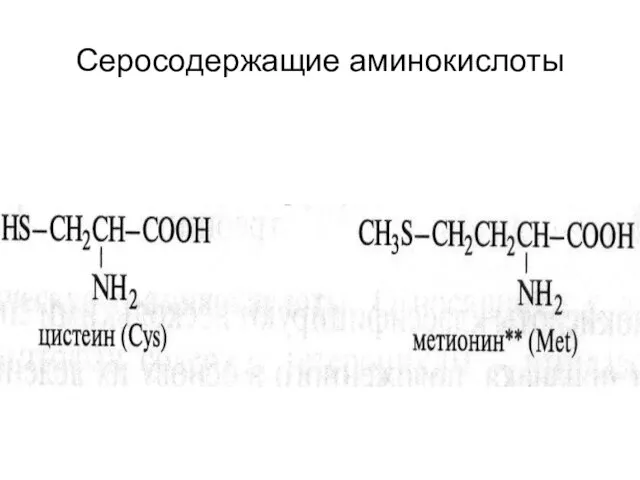
- 23. Серосодержащие аминокислоты
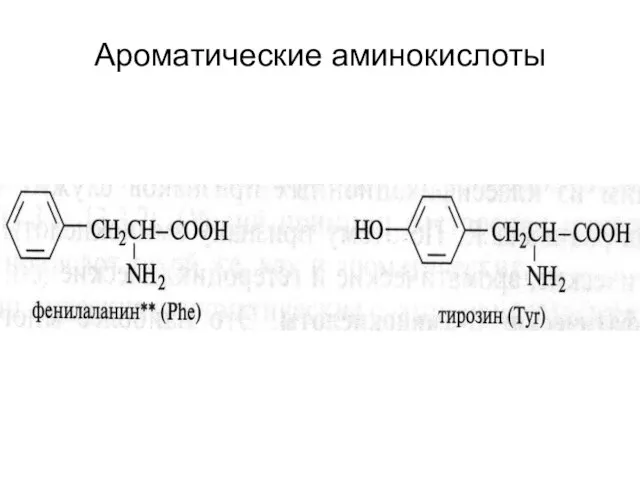
- 24. Ароматические аминокислоты
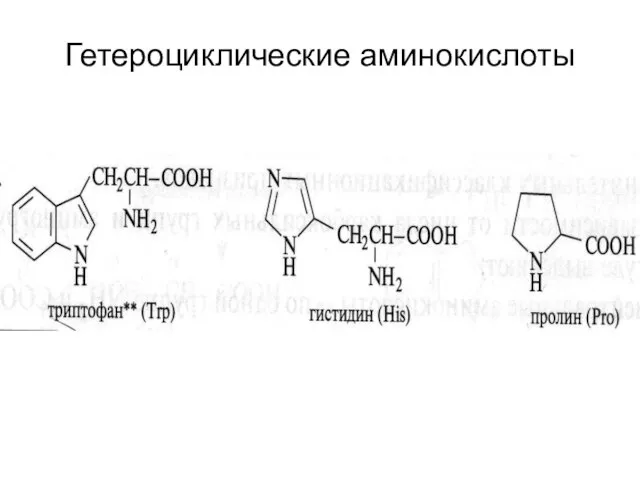
- 25. Гетероциклические аминокислоты
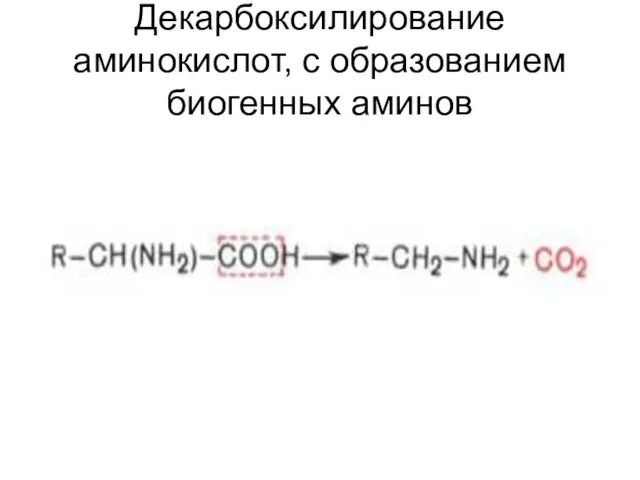
- 29. Декарбоксилирование аминокислот, с образованием биогенных аминов
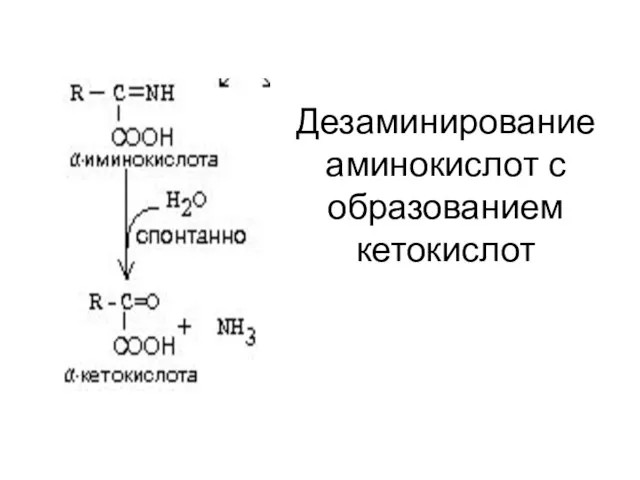
- 31. Дезаминирование аминокислот с образованием кетокислот
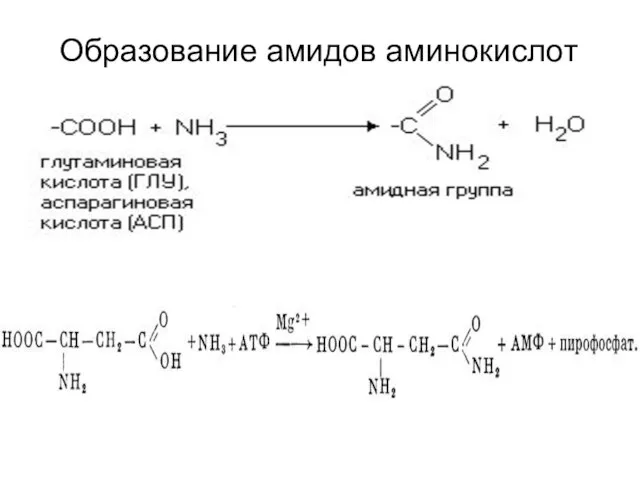
- 32. Образование амидов аминокислот
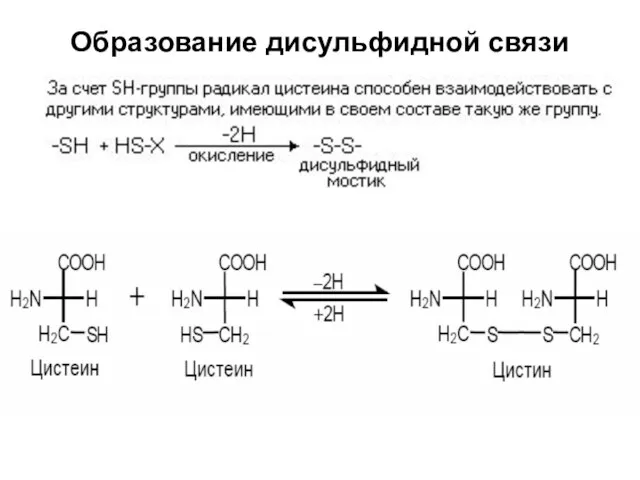
- 33. Образование дисульфидной связи
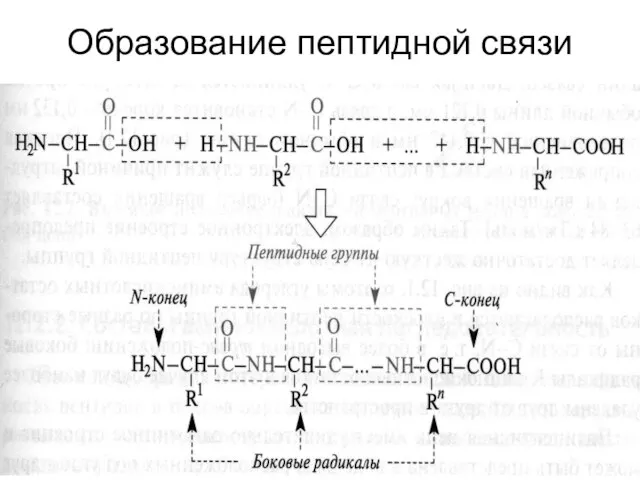
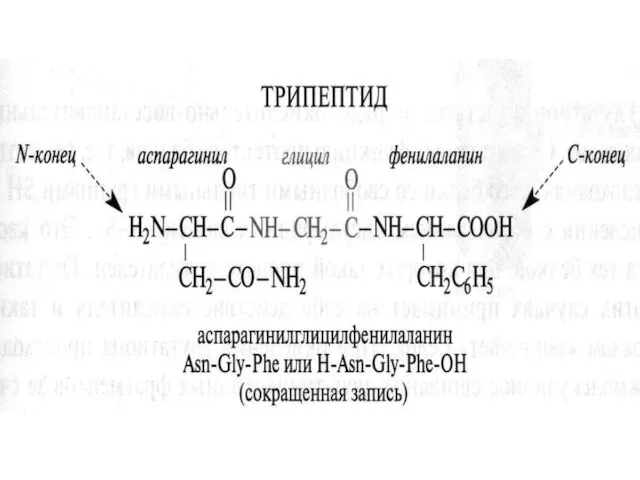
- 34. Образование пептидной связи
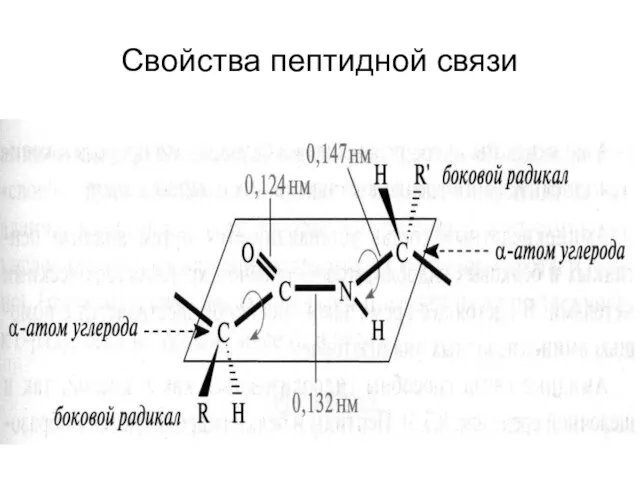
- 36. Свойства пептидной связи
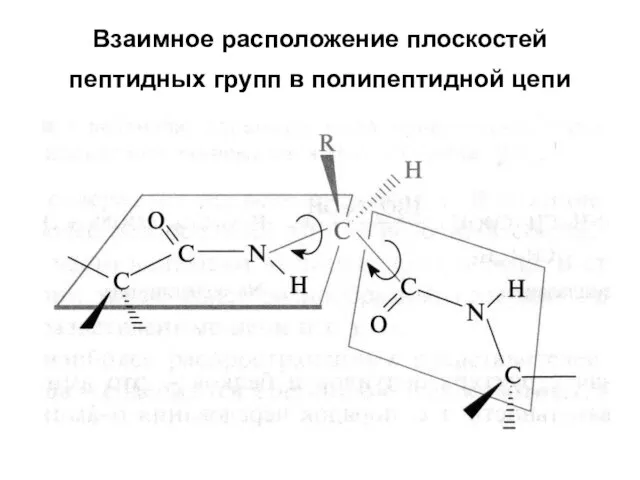
- 38. Взаимное расположение плоскостей пептидных групп в полипептидной цепи
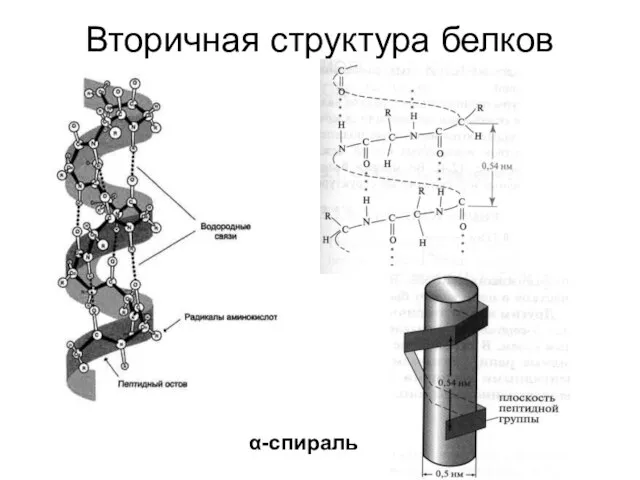
- 39. Вторичная структура белков α-спираль
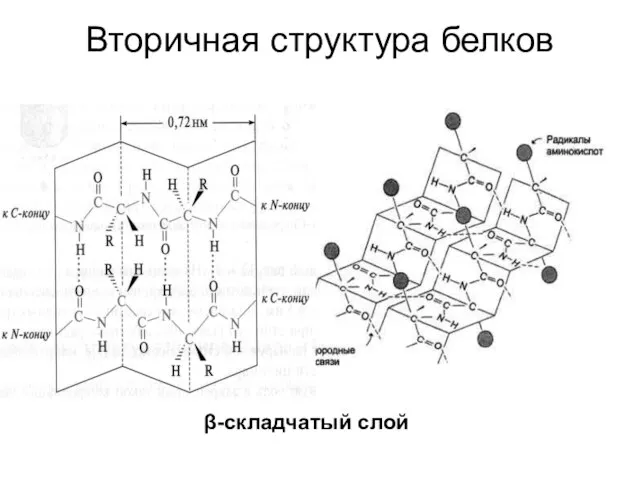
- 40. Вторичная структура белков β-складчатый слой
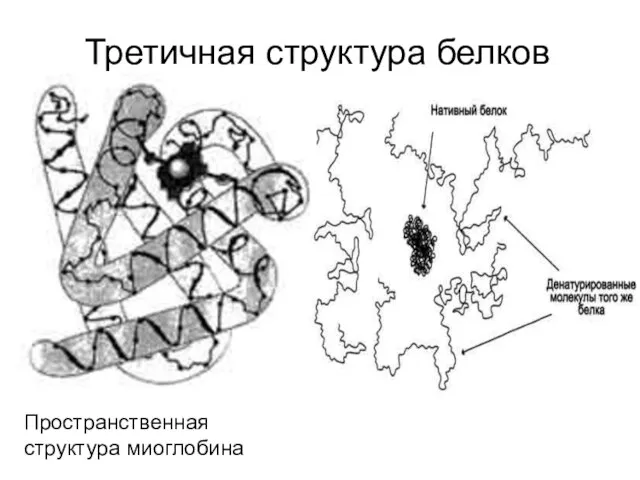
- 41. Третичная структура белков Пространственная структура миоглобина
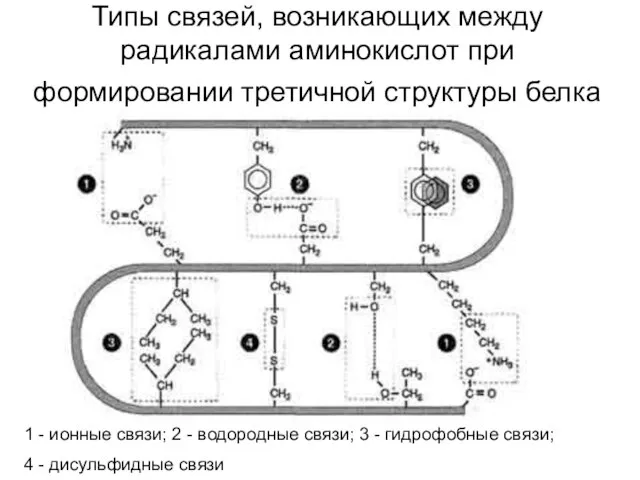
- 42. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка 1 - ионные связи; 2
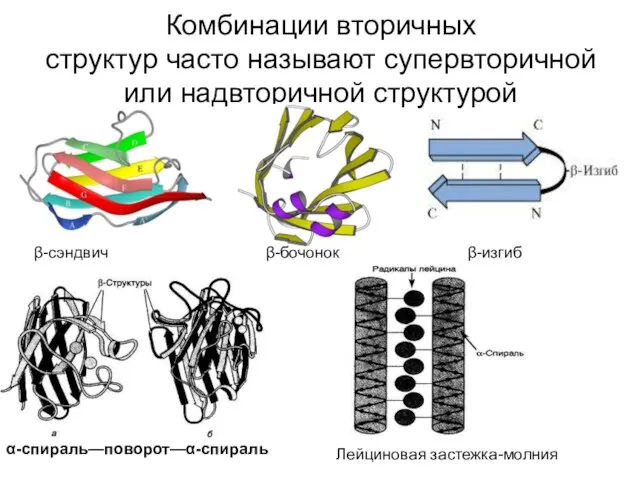
- 43. Комбинации вторичных структур часто называют супервторичной или надвторичной структурой β-сэндвич β-бочонок β-изгиб α-спираль—поворот—α-спираль Лейциновая застежка-молния
- 44. 1. α-белки – белки, состоящие главным образом из α-спиралей, которые обычно образуют общее гидрофобное ядро (22%);
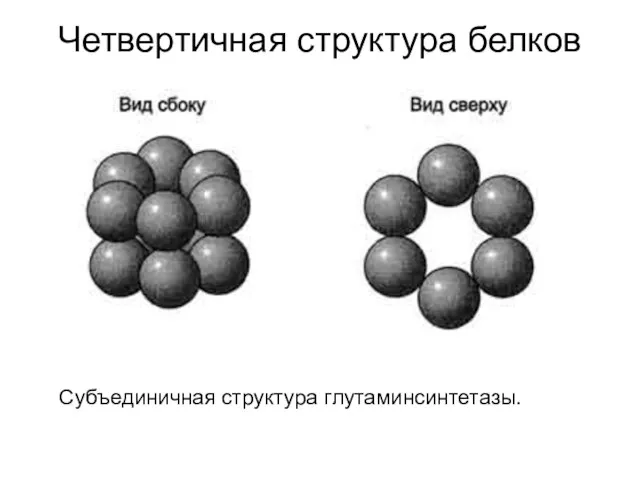
- 45. Четвертичная структура белков Субъединичная структура глутаминсинтетазы.
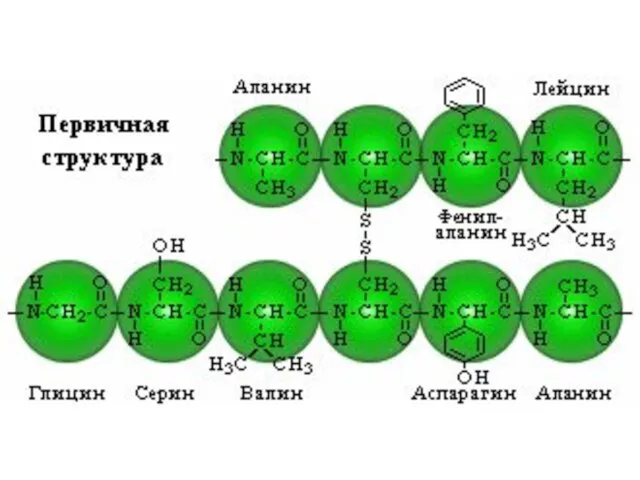
- 46. Различают четыре уровня молекулярной организации белка: •Первичная структура – последовательность аминокислотных остатков в полипептидной цепи. •Вторичная
- 47. Нативный белок – белок, находящийся в природном состоянии, сохраняющий структуру, присущую ему в живой клетке. Денатурация
- 48. Физико-химические свойства белков Гидрофильность, способность образовывать коллоидные растворы. Растворы белков имеют низкое осмотическое давление и высокую
- 49. Методы выделения и очистки белков дробление биологического материала и разрушение клеточных мембран; фракционирование органелл, содержащих те
- 50. Методы очистки белков Грубое фракционирование: Очистка белков избирательной денатурацией Высаливание Осаждение в изоэлектрической точке
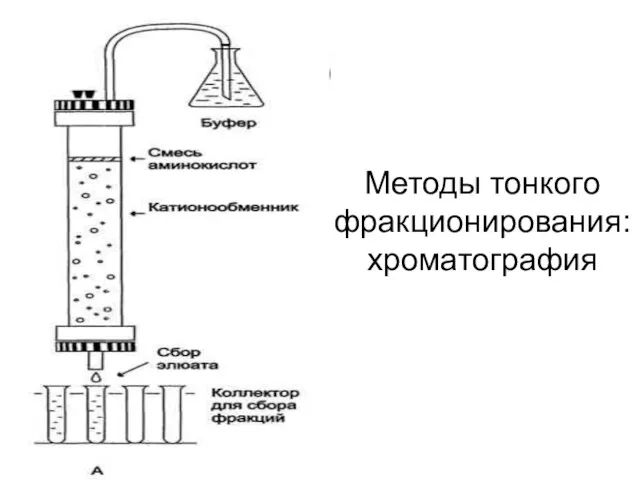
- 51. Методы тонкого фракционирования: хроматография
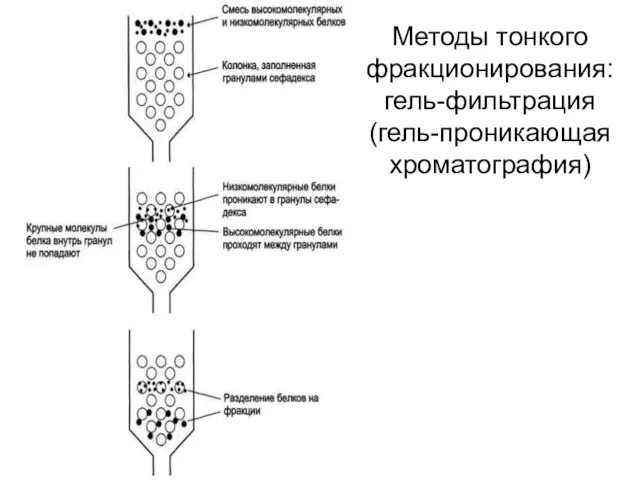
- 52. Методы тонкого фракционирования: гель-фильтрация (гель-проникающая хроматография)
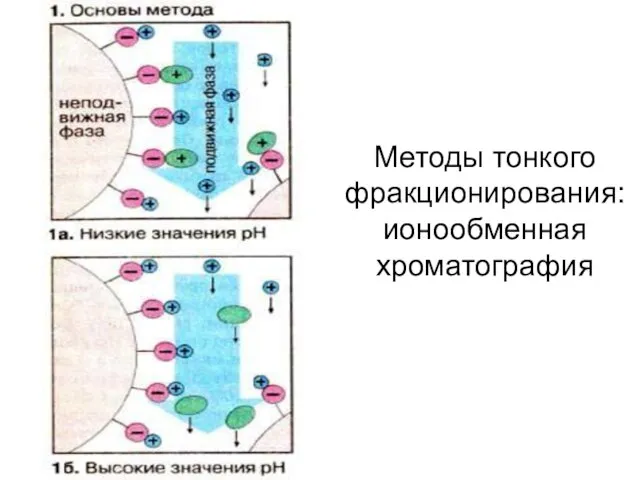
- 53. Методы тонкого фракционирования: ионообменная хроматография
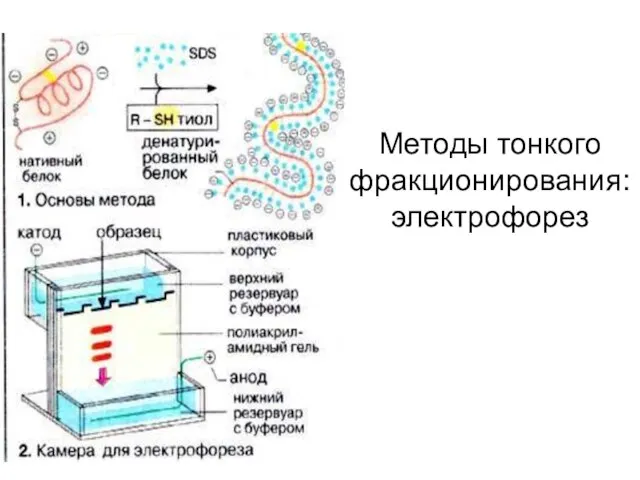
- 54. Методы тонкого фракционирования:электрофорез
- 55. В 1958г. была присуждена Нобелевская премия по химии «за установление структур белков, особенно инсулина» (Biochem J.
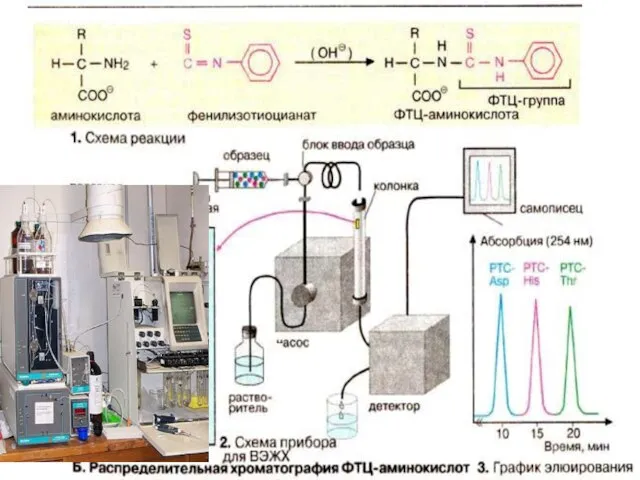
- 56. Определение аминокислотного состава белков: аминокислотный анализатор. Деградация по Сенгеру 1-фтор-2,4-динитробензол (FDNB) FDNB- производное аминокислоты Современный аминокислотный
- 57. •Автоматическая процедура последовательного отщепления и идентификации N-концевых аминокислот в виде их фенилтиогидантоиновых производных (деградация по Эдману)
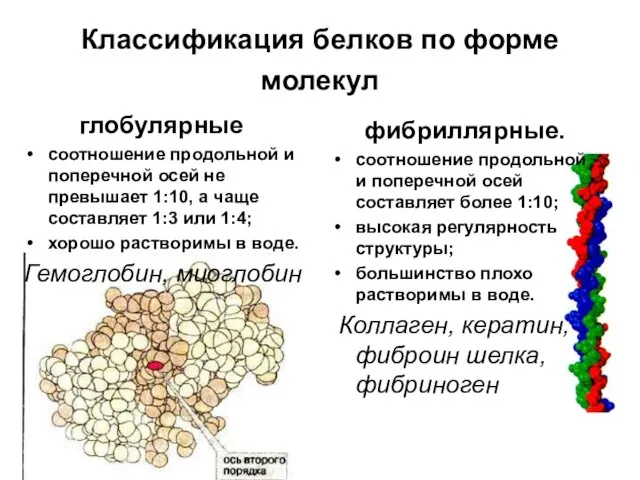
- 59. Классификация белков по форме молекул (глобулярные или фибриллярные); по молекулярной массе (низкомолекулярные, высокомолекулярные и др.); по
- 60. Классификация белков по форме молекул глобулярные соотношение продольной и поперечной осей не превышает 1:10, а чаще
- 61. Классификация белков по функциям Ферменты. Регуляторные белки (инсулин, кальмодуллин, ДНК-связывающие белки). Транспортные белки (альбумин сыворотки крови,
- 62. Классификация белков по химическому составу Простые Состоят только из аминокислот Сложные Содержат кроме аминокислот еще небелковые
- 63. Простые белки Альбумины - глобулярные белки 40-70кДа, растворимы в воде. Глобулины - нейтральные глобулярные белки св.150кДа,
- 64. Сложные белки Гликопротеины (содержат углеводы). Липопротеины (содержат липиды). Фосфопротеины (содержат фосфорную кислоту). Хромопротеины (содержат окрашенную простетическую
- 65. Гликопротеины Содержат от 1 до 30 % углеводов (моносахариды, их ацетил-амино-производные, дезоксисахариды, нейраминовые и сиаловые кислоты).
- 66. Протеогликаны Содержат до 95% углеводов. Простетическая группа представлена высокомолекулярными гетерополисахаридами (гиалуроновой и хондроитиновой кислотами, гепарином…). Основное
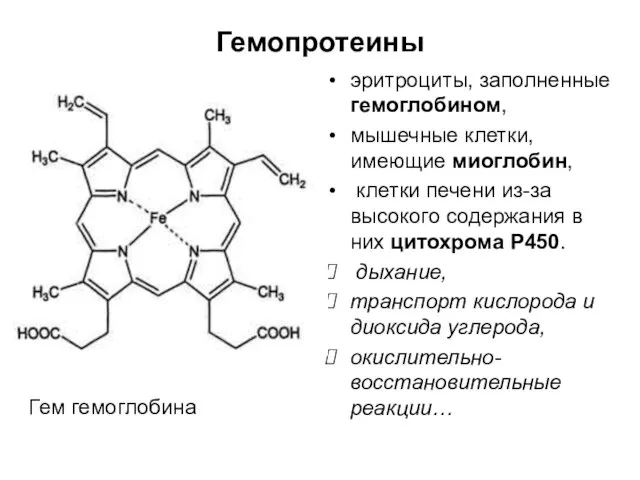
- 67. Хромопротеины (от греч. chroma – краска) Простетическая группа – окрашенный компонент: гемопротеины или железопорфирины (простетическая группа
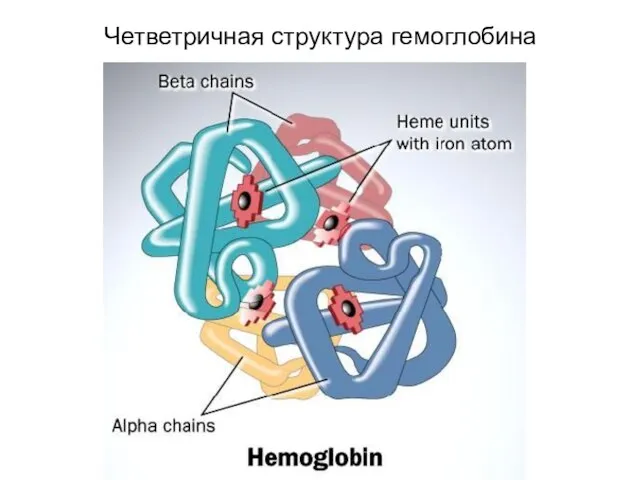
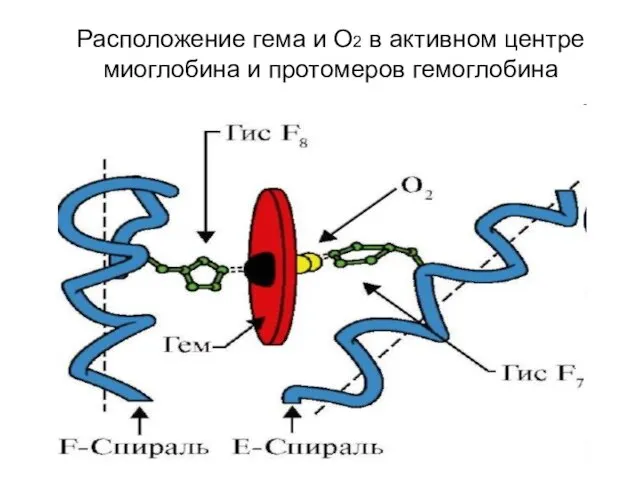
- 68. Гемопротеины эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, клетки печени из-за высокого содержания в них цитохрома
- 69. Четветричная структура гемоглобина
- 70. Расположение гема и O2 в активном центре миоглобина и протомеров гемоглобина
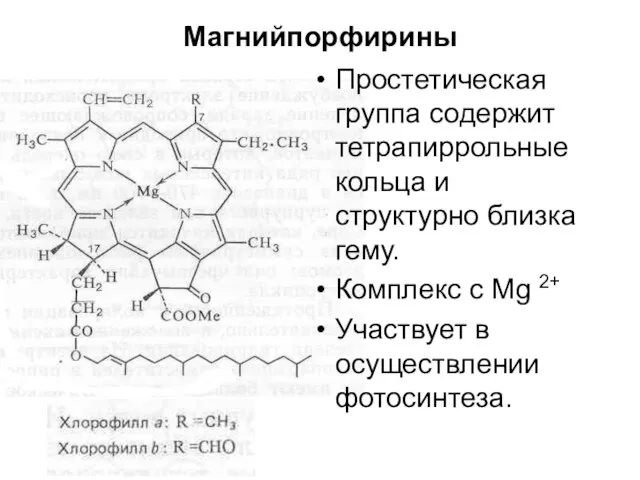
- 71. Магнийпорфирины Простетическая группа содержит тетрапиррольные кольца и структурно близка гему. Комплекс с Mg 2+ Участвует в
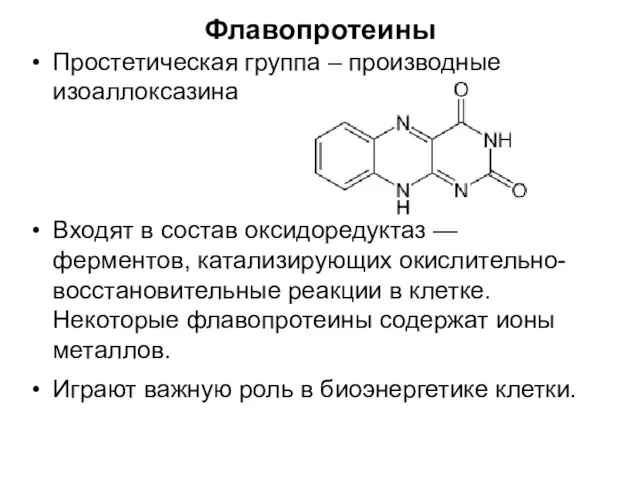
- 72. Флавопротеины Простетическая группа – производные изоаллоксазина Входят в состав оксидоредуктаз — ферментов, катализирующих окислительно-восстановительные реакции в
- 73. Липопротеины Простетическая группа – липиды: нейтральные жиры, свободные жирные кислоты, фосфолипиды, стерины и др. Входят в
- 74. Нуклеопротеины Дезоксирибонуклео-протеины (ДНП) Простетическая группа – ДНК. Входят в состав хроматина (5 классов гистонов и негистоновые
- 75. Фосфопротеины Простетическая группа - остатки фосфорной кислоты, соединенные с белковой частью сложноэфирными связями через гидрокси-группы серина
- 77. Скачать презентацию


































 Презентация на тему Гуляй по улицам с умом
Презентация на тему Гуляй по улицам с умом Яблочный спас
Яблочный спас Фотографии тружеников промышленности и сельского хозяйства 60-70 годов
Фотографии тружеников промышленности и сельского хозяйства 60-70 годов Программист. Математика в профессии
Программист. Математика в профессии Моя малая Родина
Моя малая Родина Виды декоративно-прикладного искусства
Виды декоративно-прикладного искусства Социальная интеграция инвалидов в Приволжском федеральном округе
Социальная интеграция инвалидов в Приволжском федеральном округе Производство, перевозка либо сбыт продукции, выполнение работ или оказание услуг, не отвечающих требованиям безопасности
Производство, перевозка либо сбыт продукции, выполнение работ или оказание услуг, не отвечающих требованиям безопасности Поиск информации (в Интернете)
Поиск информации (в Интернете) ОГП тема 3
ОГП тема 3 Нуриева М
Нуриева М Культурное значение Царского Села
Культурное значение Царского Села Яблони в цвету
Яблони в цвету Международное гуманитарное право
Международное гуманитарное право 1
1 Спрос и предложение
Спрос и предложение Тепловые двигатели. Паровая турбина.
Тепловые двигатели. Паровая турбина. Ковров фильм представляет. С днем рождения. Фотоальбом
Ковров фильм представляет. С днем рождения. Фотоальбом Порядок формирования муниципальных заказов и использования средств в рамках одноканального финансирования.
Порядок формирования муниципальных заказов и использования средств в рамках одноканального финансирования. Методическое объединение учителей математики, информатики и физики Хоринской СОШ имени Георгия Николаевича Чиряева
Методическое объединение учителей математики, информатики и физики Хоринской СОШ имени Георгия Николаевича Чиряева Ориентирование на местности. Компас
Ориентирование на местности. Компас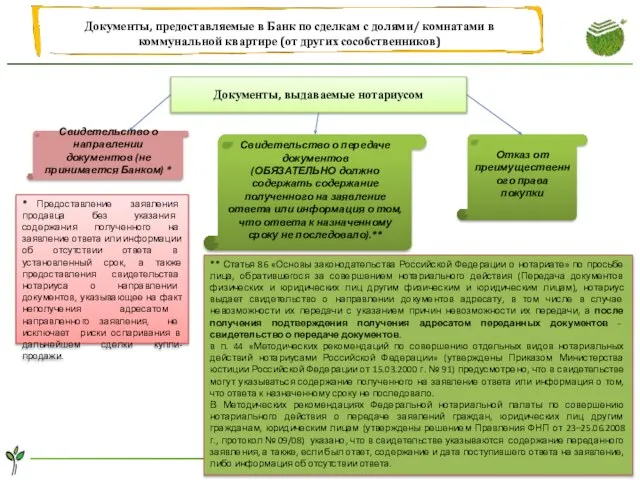 Документы, предоставляемые в банк по сделкам с долями, комнатами в коммунальной квартире (от других сособственников)
Документы, предоставляемые в банк по сделкам с долями, комнатами в коммунальной квартире (от других сособственников) Цветок- символ Удмуртии- Италмас
Цветок- символ Удмуртии- Италмас  Привычки полезные и вредные
Привычки полезные и вредные Активные продажи. Взгляни по-новому. Дистанционный тренинг
Активные продажи. Взгляни по-новому. Дистанционный тренинг Магнитное поле Земли
Магнитное поле Земли Презентация вариант исправления 999 лвл хард лив
Презентация вариант исправления 999 лвл хард лив Презентация на тему Дециметр (1 класс)
Презентация на тему Дециметр (1 класс)