Содержание
- 2. Протеиногенные и непротеиногенные аминокислоты Все α-аминокислоты могут быть подразделены на две большие группы: 1) Протеиногенные аминокислоты
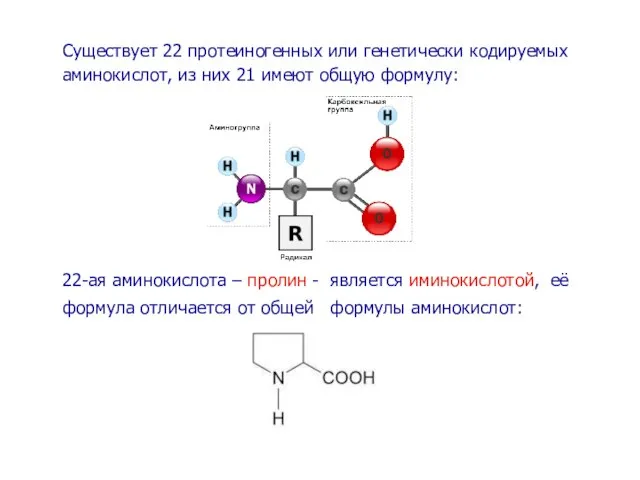
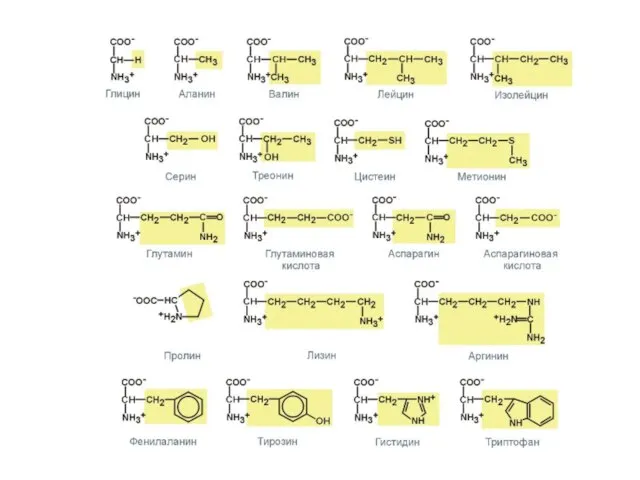
- 3. Существует 22 протеиногенных или генетически кодируемых аминокислот, из них 21 имеют общую формулу: 22-ая аминокислота –
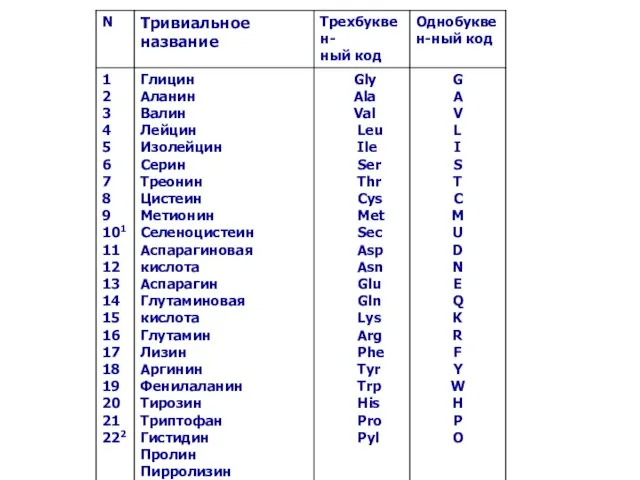
- 6. 1 Селеноцистеин (Sec, U) кодируется на мРНК стоп-кодоном UGA при условии присутствия в мРНК особой последовательности
- 7. У гидроксиаминокислот после первых двух букв Hy (от лат. hydroxi) следует название аминокислоты или его первая
- 8. Классификация генетически кодируемых аминокислот По изоэлектрической точке аминокислоты разделяют на кислые (Asp, Glu, Tyr), основные (Lys,
- 9. Генетический код аминокислот Генетический код определяют как правило кодирования структуры белка по первичной структуре ДНК или
- 10. Стереохимия аминокислот
- 11. Изомерия – явление существования химических соединений (изомеров), одинаковых по составу, молекулярной массе и брутто-формуле, но различающихся
- 12. Стереоизомерия 1. Оптическая изомерия (энантиомерия). 2. Геометрическая изомерия (цис-транс- изомерия).
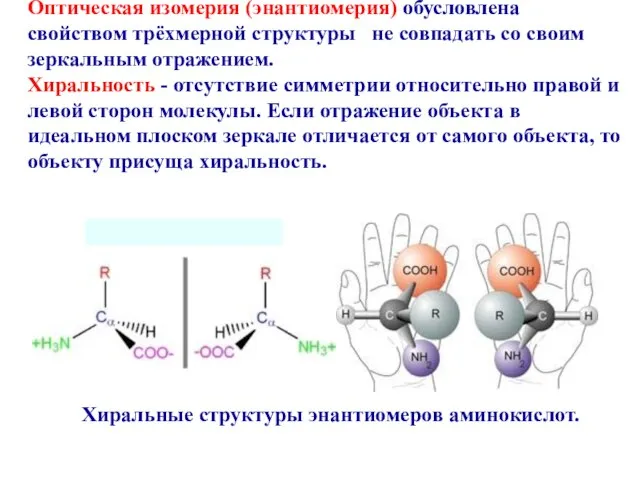
- 13. Оптическая изомерия (энантиомерия) обусловлена свойством трёхмерной структуры не совпадать со своим зеркальным отражением. Хиральность - отсутствие
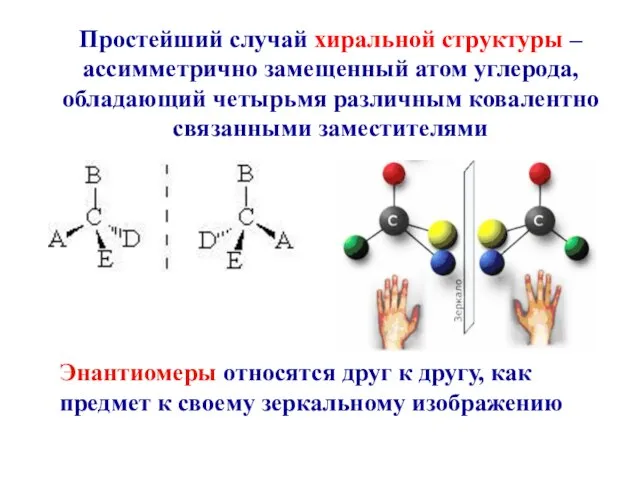
- 14. Простейший случай хиральной структуры – ассимметрично замещенный атом углерода, обладающий четырьмя различным ковалентно связанными заместителями Энантиомеры
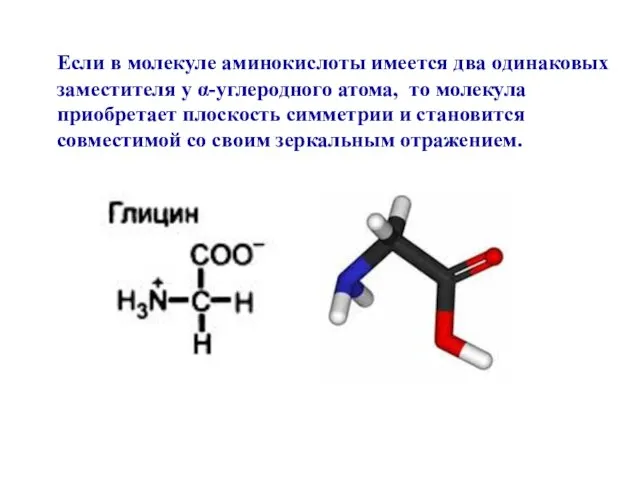
- 15. Если в молекуле аминокислоты имеется два одинаковых заместителя у α-углеродного атома, то молекула приобретает плоскость симметрии
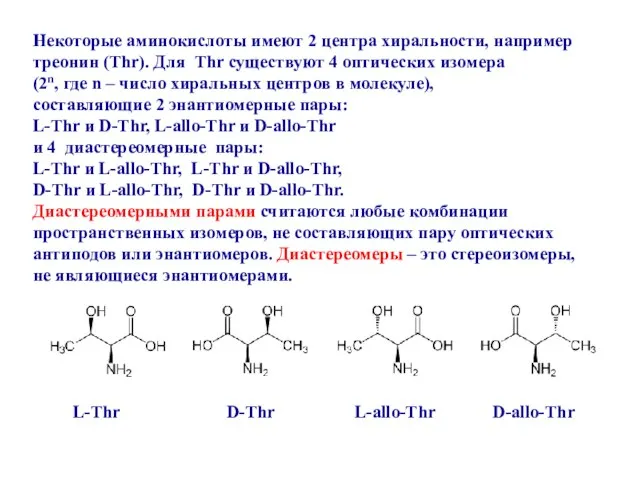
- 16. L-Thr D-Thr L-allo-Thr D-allo-Thr Некоторые аминокислоты имеют 2 центра хиральности, например треонин (Thr). Для Thr существуют
- 17. Оптическая активность изомеров При прохождении плоско-поляризованного света через раствор оптически активного изомера хирального соединения плоскость поляризации
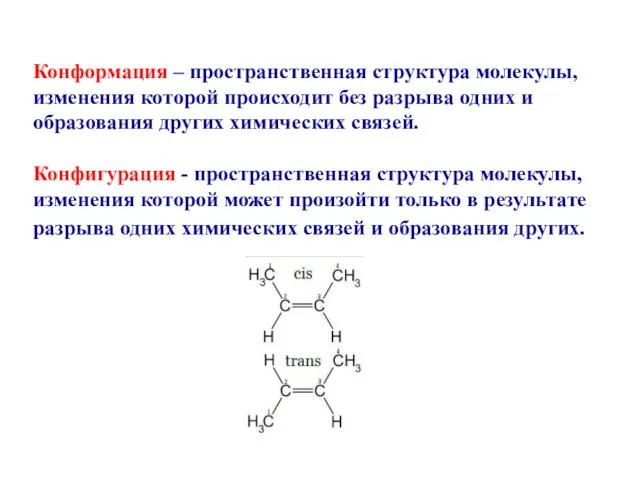
- 18. Конформация – пространственная структура молекулы, изменения которой происходит без разрыва одних и образования других химических связей.
- 19. Для установления абсолютной конфигурации молекул энантиомеров углеводов в качестве стандарта был выбран правовращающий энантиомер глицеринового альдегида
- 20. Правило жёсткого тела. Плоские проекции рассматриваются как жёсткие тела, лежащие в плоскости. Поворот проекции на 1800
- 21. D или L обозначают конфигурационный ряд, к которому принадлежит α-углеродный атом. Дополнительно может быть введен символ
- 22. Система Кана-Ингольда-Прелога (RS-система) Система использует символы R- (rectus - правый) и S- (sinister - левый). Для
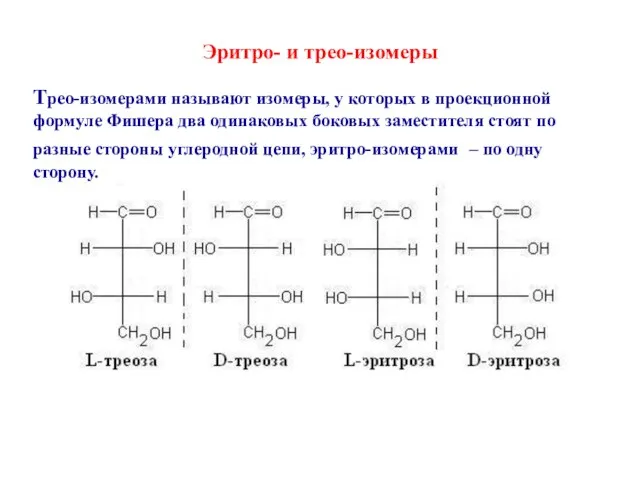
- 23. Эритро- и трео-изомеры Трео-изомерами называют изомеры, у которых в проекционной формуле Фишера два одинаковых боковых заместителя
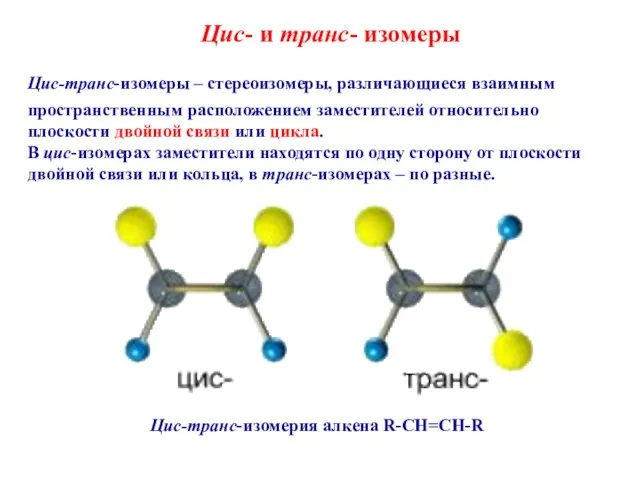
- 24. Цис- и транс- изомеры Цис-транс-изомеры – стереоизомеры, различающиеся взаимным пространственным расположением заместителей относительно плоскости двойной связи
- 25. Физико-химические свойства аминокислот Молекулы аминокислот обладают двумя функциональными группами: кислой карбоксильной группой и основной аминогруппой. Однако
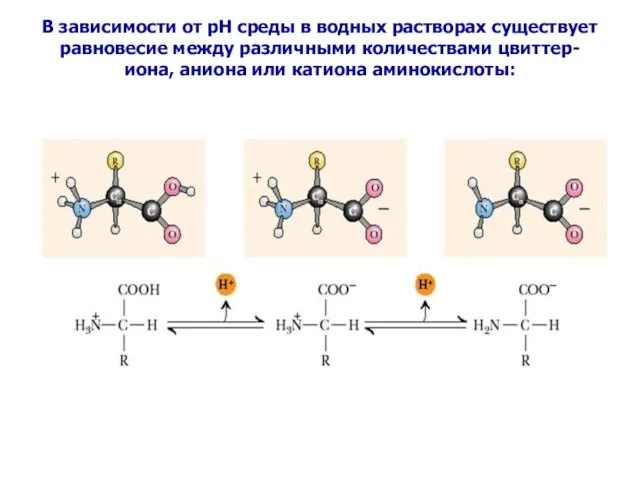
- 26. В зависимости от рН среды в водных растворах существует равновесие между различными количествами цвиттер-иона, аниона или
- 27. Диамикарбоновые и аминодикарбоновые кислоты также образуют цвиттер-ионы, но вследствие присутствия второй амино- или карбоксильной группы сохраняют
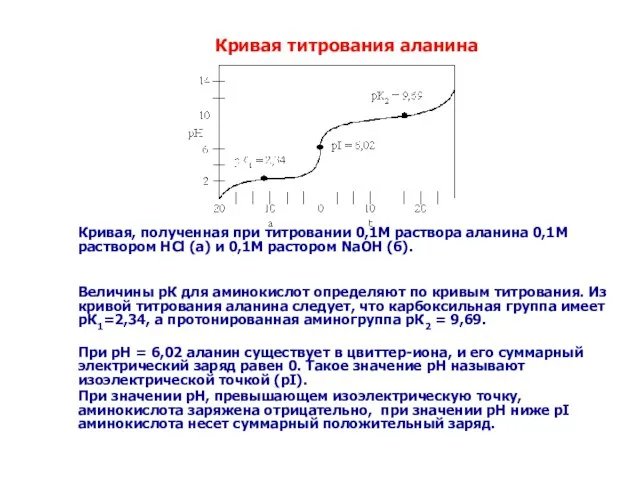
- 28. Изоэлектрическая точка Значение рН раствора, при котором концентрация анионов аминокислоты равна концентрации ее катионов, называется изоэлектрической
- 29. Кислотно-основные свойства аминокислот Что такое кислота или основание? В 1923 г. Брёнстед и Лоури независимо друг
- 30. В теории Льюиса (1923 г.) было расширено понятие кислоты и основания. Кислота Льюиса — молекула или
- 31. Кривая, полученная при титровании 0,1М раствора аланина 0,1М раствором HCl (а) и 0,1М растором NaOH (б).
- 32. Химические свойства аминокислот I. Реакции, свойственные алифатическим кислотам. Подобно обычным карбоновым кислотам, α-аминокислоты вступают во многие
- 33. 1. Образование солей с основаниями. α-Аминокислоты образуют соли при действии на них оснований. H2N–CH2–COOH + NaOH
- 34. 2. Образование эфиров. Эфиры α-аминокислот можно получить, действуя на аминокислоты спиртом и хлористым водородом: H2N–CH2–COOH +
- 35. 3. Образование ангидридов. Галоидангидриды получают действием на аминокислоты пятихлористым фосфором: H2N–CH2–COOH + PCl5 Cl- [H3N+-CH2-COCl] +
- 36. 4. Реакция декарбоксилирования. При декарбоксилировании аминокислот (отщеплении карбоксильной группы) образуются амины. Аминокислоты декарбоксилируются при сухой перегонке
- 37. II. Реакции, свойственные аминам. Активная аминогруппа и защита аминогруппы. Аминогруппа активна, если у атома азота имеется
- 38. 2. Действие азотистой кислоты. α-Аминокислоты как первичные амины реагируют с HNO2 c отщеплением азота. При этом
- 39. 3. Получение N-алкилзамещенных аминокислот. При действии галоидных алкилов или алкилсульфатов на аминокислоты получаются моно- и диалкилзамещенные
- 40. 4. Образование N-ацильных производных. α-Аминокислоты реагируют с хлорангидридами и ангидридами кислот, образуя N-ацильные производные аминокислот. CH3COCl
- 41. 5. Взаимодействие с альдегидами. Аминокислоты легко реагируют с формальальдегидом. Реакция идет в щелочной среде: H2N-CH2-COO- +
- 42. 5. Реакция дезаминирования. α-Аминокислоты могут подвергаться окислительному дезаминированию. При этом происходит отщепление аммиака с образованием кетокислоты,
- 43. Реакции боковых групп α-аминокислот 1. Боковые группы таких аминокислот, как Gly, Ala, Val, Ile, Leu, Phe
- 44. 5. Боковая группа остатка Tyr может вступать в следующие реакции: а) ацилирования фенольного гидроксила, т.е. образование
- 45. Синтез аминокислот
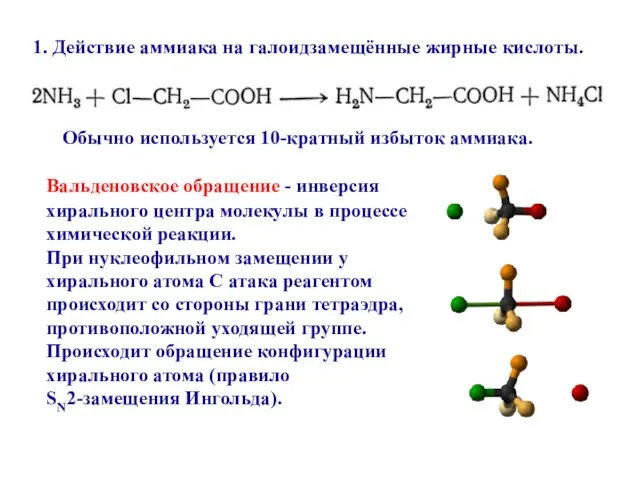
- 46. Обычно используется 10-кратный избыток аммиака. 1. Действие аммиака на галоидзамещённые жирные кислоты. Вальденовское обращение - инверсия
- 48. Скачать презентацию
































 Формирование познавательных универсальных учебных действийметодист Терещенко Т.И.
Формирование познавательных универсальных учебных действийметодист Терещенко Т.И. Осадчая Галина Ивановна Проректор РГСУ Руководитель научно- исследовательского комплекса доктор социологических наук, профессор
Осадчая Галина Ивановна Проректор РГСУ Руководитель научно- исследовательского комплекса доктор социологических наук, профессор 2 года
2 года Маркетинг
Маркетинг Правописание окончаний имён прилагательных мужского и среднего рода
Правописание окончаний имён прилагательных мужского и среднего рода Ученые, открывшие основные законы электротехники
Ученые, открывшие основные законы электротехники Существует такое шуточное правило: если в названии месяца есть буква р (например, январь), то в этом месяце нельзя сидеть на голой зе
Существует такое шуточное правило: если в названии месяца есть буква р (например, январь), то в этом месяце нельзя сидеть на голой зе ПРИНЦИП ПАКЕТИРОВАНИЯ
ПРИНЦИП ПАКЕТИРОВАНИЯ Стратегический план развития виртуальной компании
Стратегический план развития виртуальной компании Презентация на тему Гоголь Ревизор
Презентация на тему Гоголь Ревизор  Australian financial services consulting company (fintech)
Australian financial services consulting company (fintech) Оценка рисков
Оценка рисков Общие положения о договоре купли-продажи
Общие положения о договоре купли-продажи Художники-анималисты
Художники-анималисты Праздник цветов в Ижевске
Праздник цветов в Ижевске Родина моя – Россия
Родина моя – Россия Психологические типы личности
Психологические типы личности Новый год. Помоги бычку узнать кинозвезду!
Новый год. Помоги бычку узнать кинозвезду! Формирование системы мониторинга качества услуг учреждений культуры
Формирование системы мониторинга качества услуг учреждений культуры Сжатое изложение
Сжатое изложение печка теплица объезд штопка
печка теплица объезд штопка Основные требования к оформлению проекта
Основные требования к оформлению проекта Animals of North America
Animals of North America Координатный луч
Координатный луч Язык SQL
Язык SQL Интернет технологии в образовании
Интернет технологии в образовании Обзор
Обзор Информация в биологии
Информация в биологии