Слайд 2Повторение
Число электронов в атоме элемента = числу протонов = заряду ядра атома

= порядковому номеру элемента.
Электроны в атомах располагаются слоями; число слоёв (энергетических уровней) = номеру периода, в котором находится элемент.
Слайд 3Повторение
Число электронов в наружном слое атомов элементов = номеру группы, в котором

находится элемент. (Для элементов главных подгрупп)
Электроны движутся вокруг ядра с огромной скоростью по орбиталям. Часть пространства, где наиболее вероятно нахождение электрона, называют электронным облаком.
Слайд 4Распределение электронов по уровням
N=2n2 формула для вычисления количества электронов на энергетических уровнях.
1Й

уровень - 2 электрона.
2Й уровень - 8 электронов.
3Й уровень - 18 электронов.
4Й уровень - 32 электрона.
Слайд 5Распределение электронов по уровням
1 уровень:
2ē

Слайд 6Распределение электронов по уровням
1 уровень: 2ē
2 уровень:8ē

Слайд 7Распределение электронов по уровням
1 уровень-2
2 уровень-8
3 уровень-18

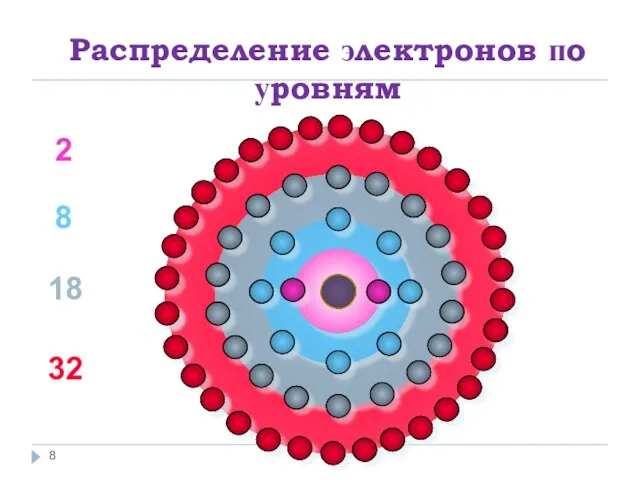
Слайд 8Распределение электронов по уровням
2
8
18
32
Слайд 9s- электронное облако
Форма s-электронного облака - шар. На нем 1-2 электрона.

Слайд 10p- электронное облако
Форма p-электронного облака - объёмная восьмёрка. На нем от 1

до 6 электронов.
Слайд 11d- электронное облако
Форма d-электронных облаков - две объемные восьмёрки. На нем от

1 до 10 электронов.
Слайд 12f- электронное облако
Форма f-электронных облаков сложная и в школьных учебниках не приводится.

На них от 1 до 14 электронов.
Слайд 13Атом водорода
Электрон этого атома при вращении образует сферическое облако.
+1 Н )1 это

схема строения атома. Здесь на первом месте - заряд ядра, на втором месте - химическое обозначение, далее - одна орбиталь и электроны на ней.
1s1 это электронная формула атома.
Слайд 14Атом гелия
+2 Не )2 это схема строения атома.
1s2 это электронная формула атома.
Здесь

два s-электрона. Облака их одинаковой формы и при совмещении образуют общее двухэлектронное облако.
Про такие электроны говорят, что они спарены.
Слайд 15Атом лития
+3 Li )2)1 это схема строения атома.
1s2 2s1 это электронная формула.

Элемент располагается во втором периоде, имеет два электронных слоя.
Слайд 16Атом бериллия
+4 Be )2 )2 это схема строения атома.
1s2 2s2 это электронная

формула.
В этом атоме имеется два спаренных s-электрона во внутреннем слое и два спаренных s-электрона в наружном.
Слайд 17Атом углерода
+6 С ) 2 ) 4 схема строения атома.
1s2 2s 2

2p2 электронная формула.
В обычном состоянии атом углерода двухвалентен.
1s2 2s 1 2p3
В возбужденном состоянии (получил дополнительное количество энергии) атом углерода четырёхвалентен.
Слайд 18Атом хлора
+17 Cl )2 )8 )7 схема строения атома.
1s2 2s2 2p6 3s2

3p5 это электронная формула.
Атом располагается в III периоде, и имеет три энергетических уровня.
Атом располагается в VII группе, главной подгруппе - на внешнем энергетическом уровне 7 электронов.
Слайд 19Заключение
Существуют s, p, d, f электроны.
Электроны располагаются вокруг ядра слоями (уровнями).

Электроны распределяются по уровням 2, 8, 18, 32.


















 Архітектура України ХІХ ст
Архітектура України ХІХ ст Обучение правилам чтения
Обучение правилам чтения Презентация на тему Названия месяцев и дней недели
Презентация на тему Названия месяцев и дней недели  Нижний Новгород, 2020
Нижний Новгород, 2020 Weddings in different countries
Weddings in different countries Лев Николаевич Толстой
Лев Николаевич Толстой Название бизнес-плана
Название бизнес-плана 90 лет на планете Земля
90 лет на планете Земля Gli ospiti di Jerry. Chi è?
Gli ospiti di Jerry. Chi è? Первый день творения (земля, вода, небо)
Первый день творения (земля, вода, небо) Электроснабжение объектов
Электроснабжение объектов Генерация вероятностных автоматов методами Reinforcement Learning
Генерация вероятностных автоматов методами Reinforcement Learning Взаимодействие токов. Магнитное поле
Взаимодействие токов. Магнитное поле Летние Олимпийские игры 2012 в Лондоне
Летние Олимпийские игры 2012 в Лондоне Финансовый калькулятор
Финансовый калькулятор Абсцесс и гангрена легких
Абсцесс и гангрена легких Marshrutnaya set s perechnem ostanovochnyh punktov
Marshrutnaya set s perechnem ostanovochnyh punktov Nikolay Mikhaylovich Przhevalsky and Russian geography and exploration.
Nikolay Mikhaylovich Przhevalsky and Russian geography and exploration. Дисграфия как одна из причин школьной неуспешности по русскому языку
Дисграфия как одна из причин школьной неуспешности по русскому языку Отчет по производственной практике
Отчет по производственной практике Публичный отчет директора МВ(с)ОУ О(с)ОШ №1
Публичный отчет директора МВ(с)ОУ О(с)ОШ №1 СПБ 2018-2019. Наше маленькое путешествие
СПБ 2018-2019. Наше маленькое путешествие Иван Грозный
Иван Грозный Артериальная гипертония.Антигипертензивные препараты.
Артериальная гипертония.Антигипертензивные препараты. Буквы потерялись
Буквы потерялись МЕТОДЫ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
МЕТОДЫ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ Дом и вещи
Дом и вещи Презентация на тему Великая отечественная война на Кубани
Презентация на тему Великая отечественная война на Кубани