Содержание
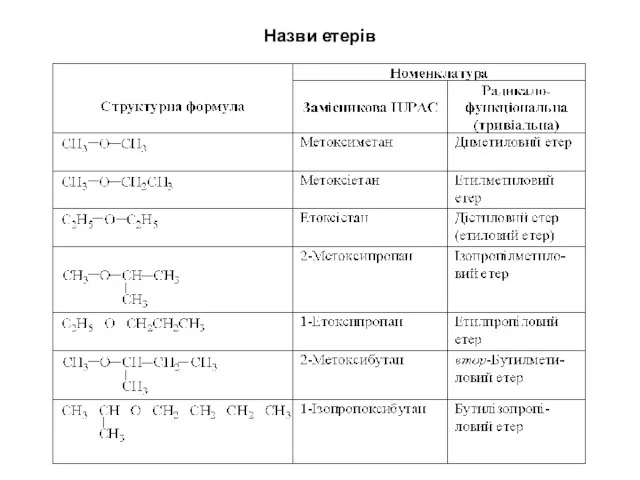
- 2. Назви етерів
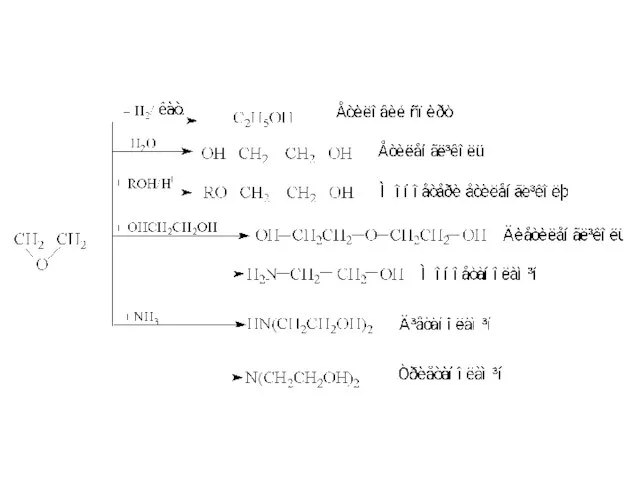
- 3. МЕТОДИ ОДЕРЖАННЯ Міжмолекулярна дегідратація спиртів у присутностi мінеральних кислот Вторинні, а тим більше третинні спирти не
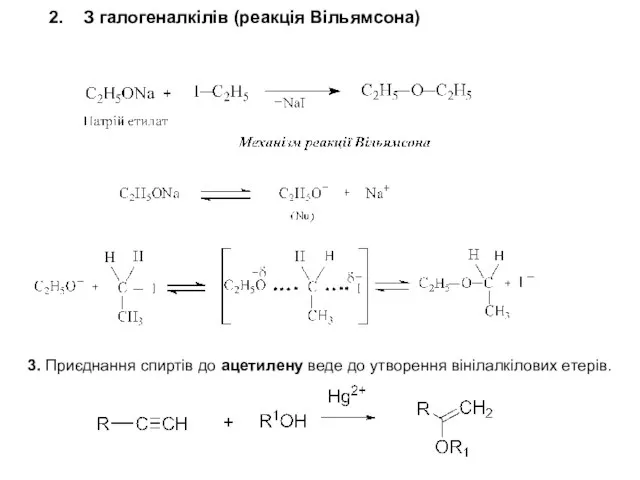
- 4. 2. З галогеналкілів (реакція Вільямсона) 3. Приєднання спиртів до ацетилену веде до утворення вінілалкілових етерів.
- 5. ФІЗИЧНІ ВЛАСТИВОСТІ У етерів відсутнi водневi зв’язки, тому вони не розчиняються у водi i мають відносно
- 6. 1. Утворення оксонієвих сполук (оксонієвих солей) У присутностi сильних кислот утворюються протонованi етери (оксонієвi солi або
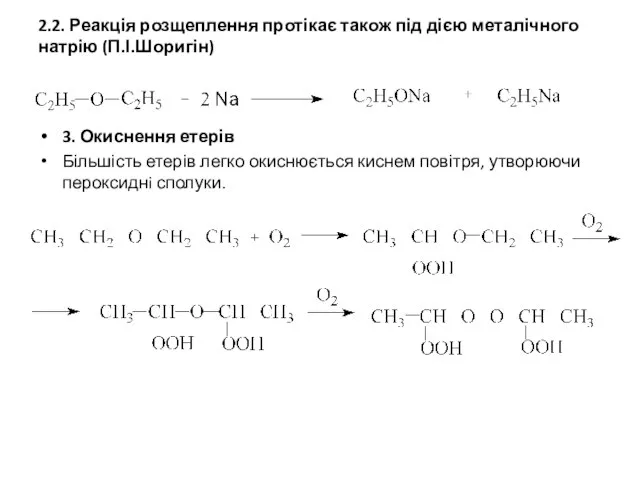
- 7. 2.2. Реакція розщеплення протікає також під дією металічного натрію (П.І.Шоригін) 3. Окиснення етерів Більшість етерів легко
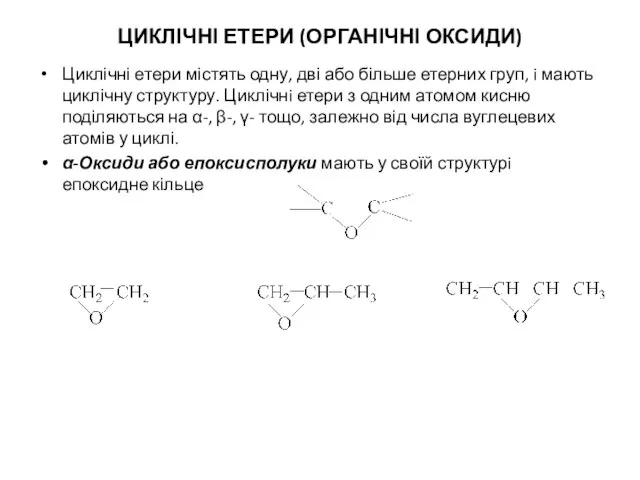
- 8. ЦИКЛІЧНІ ЕТЕРИ (ОРГАНІЧНІ ОКСИДИ) Циклічні етери містять одну, дві або більше етерних груп, i мають циклічну
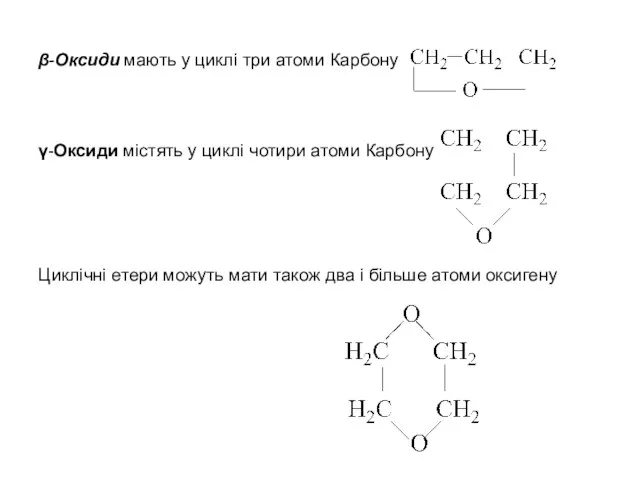
- 9. β-Оксиди мають у циклi три атоми Карбону γ-Оксиди містять у циклi чотири атоми Карбону Циклічнi етери
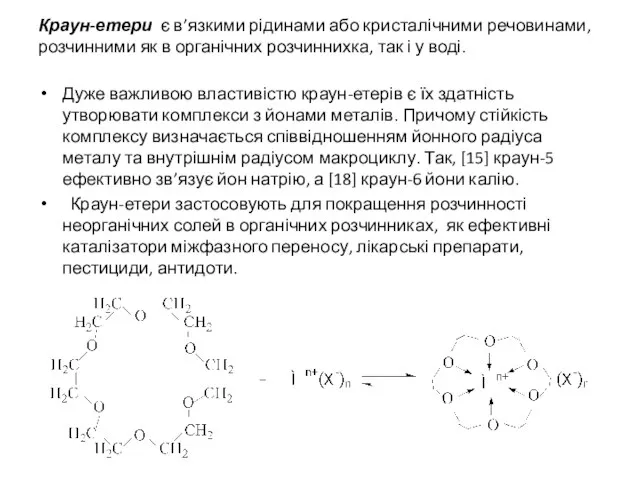
- 10. В особливу групу виділенi циклічнi етери з кількома атомами оксигену, які називаються краун-етерами [18]-Краун-6
- 11. Краун-етери є в’язкими рідинами або кристалічними речовинами, розчинними як в органічних розчиннихка, так і у воді.
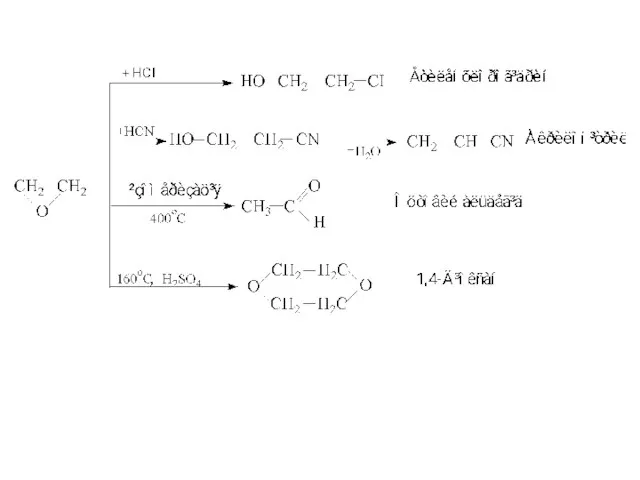
- 12. ОДЕРЖАННЯ ОКСИРАНІВ (ЕПОКСИДНИХ СПОЛУК) 1. Епоксисполуки одержують з етену або пропену двома шляхами. З алкіленхлорогідринів -
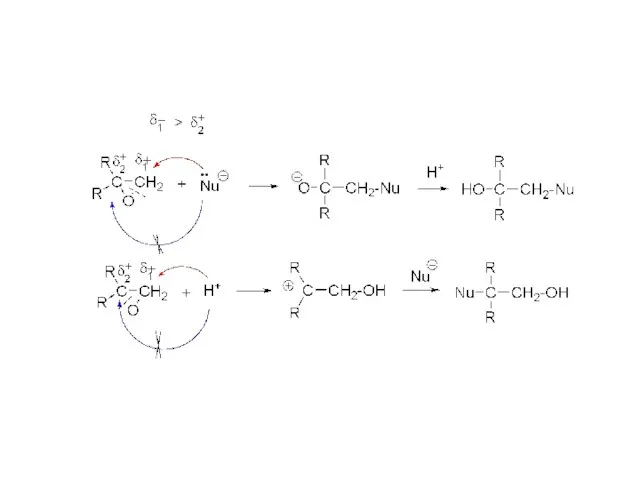
- 13. ХІМІЧНІ ВЛАСТИВОСТІ ЕПОКСИДНИХ СПОЛУК Епоксидне кільце має вигляд правильного трикутника зі значно деформованими валентними кутами. Таке
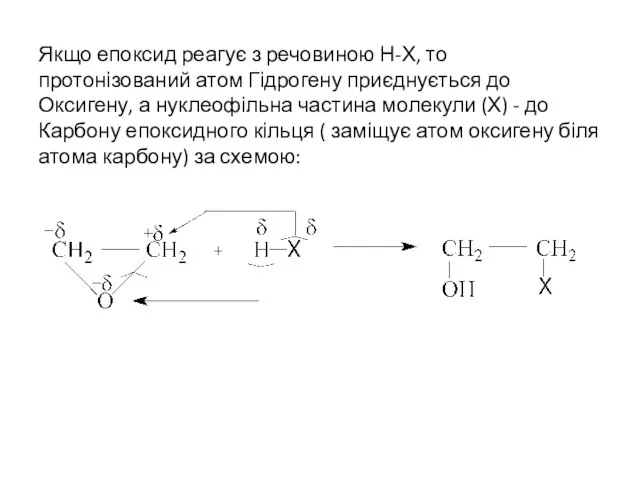
- 14. Якщо епоксид реагує з речовиною Н-Х, то протонізований атом Гідрогену приєднується до Оксигену, а нуклеофільна частина
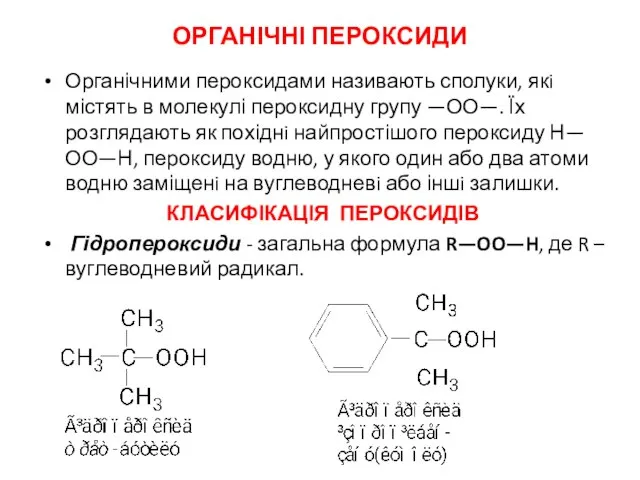
- 18. ОРГАНІЧНІ ПЕРОКСИДИ Органічними пероксидами називають сполуки, якi містять в молекулі пероксидну групу —ОО—. Їх розглядають як
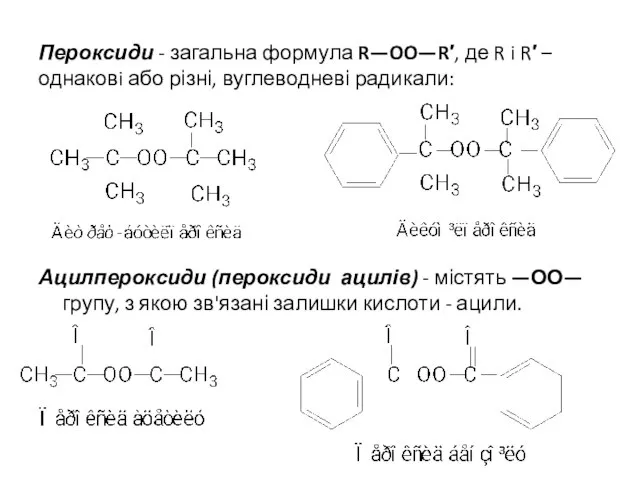
- 19. Пероксиди - загальна формула R—OO—R′, де R i R′ – однаковi або різні, вуглеводневі радикали: Ацилпероксиди
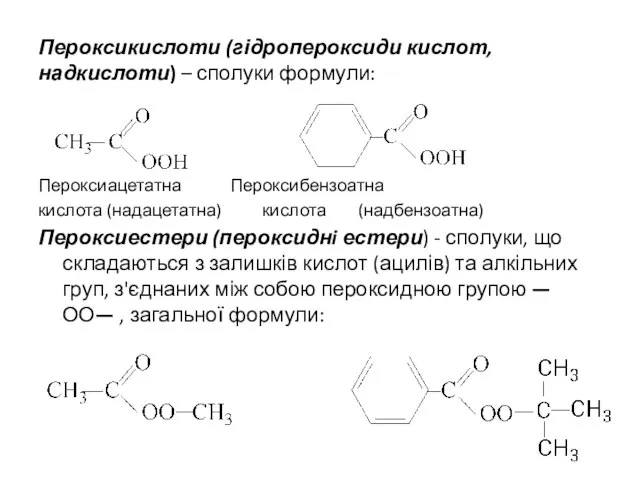
- 20. Пероксикислоти (гідропероксиди кислот, надкислоти) – сполуки формули: Пероксиацетатна Пероксибензоатна кислота (надацетатна) кислота (надбензоатна) Пероксиестери (пероксиднi естери)
- 22. Скачать презентацию



![В особливу групу виділенi циклічнi етери з кількома атомами оксигену, які називаються краун-етерами [18]-Краун-6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/375265/slide-9.jpg)


 укр.м
укр.м Презентация на тему Экосистема Структура экосистемы
Презентация на тему Экосистема Структура экосистемы Приготовление завтрака
Приготовление завтрака Тема 1. Финансы как экономическая категория
Тема 1. Финансы как экономическая категория Огонь (9 класс)
Огонь (9 класс) ENGLAND
ENGLAND Презентация на тему Уменьшаемое. Вычитаемое. Значение разности
Презентация на тему Уменьшаемое. Вычитаемое. Значение разности Презентация на тему Комплексная работа. Игрушка Робот-трансформер
Презентация на тему Комплексная работа. Игрушка Робот-трансформер Путешествие в страну гимнастику
Путешествие в страну гимнастику Альтернативные, возобновляемые источники энергии и энергосбережение: естественное и принудительное
Альтернативные, возобновляемые источники энергии и энергосбережение: естественное и принудительное Vánoce v České republice
Vánoce v České republice кандидат технических наук, доцент Грекул Владимир Иванович
кандидат технических наук, доцент Грекул Владимир Иванович Цифровые вычислительные устройства и микропроцессоры приборных комплексов
Цифровые вычислительные устройства и микропроцессоры приборных комплексов Число и цифра 10
Число и цифра 10 1С-Битрикс: Сайт школы
1С-Битрикс: Сайт школы О новой системе оплаты труда, формировании фонда заработной платы педагогических и руководящих работников
О новой системе оплаты труда, формировании фонда заработной платы педагогических и руководящих работников Как реализовать задуманное?
Как реализовать задуманное? Приготування бутербродiв
Приготування бутербродiв «Методология образовательного процесса»
«Методология образовательного процесса» Информационные технологии в индустрии гостеприимства INTERNET
Информационные технологии в индустрии гостеприимства INTERNET Конфликты и пути их решения
Конфликты и пути их решения Механизмы возникновения и разрешения конфликтов
Механизмы возникновения и разрешения конфликтов Чтобы зубы не болели
Чтобы зубы не болели Урок- игра по творчеству М.Горького
Урок- игра по творчеству М.Горького Сравненительный анализ цен на сельскохозяйственную продукцию: Беларусь и мировые рынкиComparing agricultural prices: Belarus and internatioal markets
Сравненительный анализ цен на сельскохозяйственную продукцию: Беларусь и мировые рынкиComparing agricultural prices: Belarus and internatioal markets Безличные предложения (8 класс)
Безличные предложения (8 класс) Стилистическое использование средств словообразования
Стилистическое использование средств словообразования Кабинетное исследование
Кабинетное исследование