Содержание
- 4. Harvey Washington Wiley, head of the Division of Chemistry of the U.S. Department of Agriculture, predecessor
- 5. В 1977 г. в США появился специальный термин GCP (good clinical practice), не имеющий прямого перевода
- 6. Страны Европы, Австралия, Япония так же приняли соответствующие законы для своих стран на основе Хельсинкской декларации
- 7. V.R. Potter
- 8. КОМИТЕТЫ (КОМИССИИ) ПО БИОЭТИКЕ Российский национальный комитет по биоэтике РАН (1992) Комитет по биомедицинской этике при
- 9. Три основные функции ЭК 1. образование в области биоэтике, 2. разработка этических нормативов врачебной деятельности 3.
- 10. Медицинское вмешательство – это любое профилактическое, диагностическое, лечебное или реабилитационное воздействие на пациента со стороны медицинского
- 11. Биомедицинские исследования - исследования, направленные на сохранение и укрепление здоровья, улучшение профилактики, диагностики и лечения заболеваний,
- 12. Принципы этической экспертизы Научная обоснованность, Соотношение пользы и риска, Информированное согласие.
- 13. Обоснованность Научное исследование не может считаться этичным, если отсутствует полное научное его обоснование. Плохо аргументированное исследование
- 14. 1. жестокое, или негуманное отношение к участникам исследований не может быть оправдано; 2. риск должен быть
- 15. Информированное согласие Основным методом защиты личности (по рекомендациям GCP) является: добровольное согласие субъекта испытания согласование с
- 16. Основные документы, регламентирующие правила проведения МБИ с участием человека А) Международные: Нюрнбергский кодекс (1947 г.) Хельсинкская
- 17. Основные документы, регламентирующие правила проведения МБИ с участием человека Б) Отечественные: Конституция РФ (1993), глава 2,
- 18. Этическая экспертиза – обеспечение защиты прав, безопасности и благополучия субъектов исследования и гарантирование общественности этой защиты
- 19. «Законы придуманы не для прекращения человеческой деятельности, а для ее направления, подобно тому как природа создала
- 21. Скачать презентацию

















 НазванияХимическихЭлементов
НазванияХимическихЭлементов Акты применения права. Характеристика и классификация
Акты применения права. Характеристика и классификация САМЫЕ-САМЫЕ
САМЫЕ-САМЫЕ Отчет о научно-организационной деятельности Президиума АН РБ в 2009 году
Отчет о научно-организационной деятельности Президиума АН РБ в 2009 году Невидимые нити (2 класс)
Невидимые нити (2 класс) НИКОЛАЯ ДМИТРИЕВИЧА ПАПАЛЕКСИ
НИКОЛАЯ ДМИТРИЕВИЧА ПАПАЛЕКСИ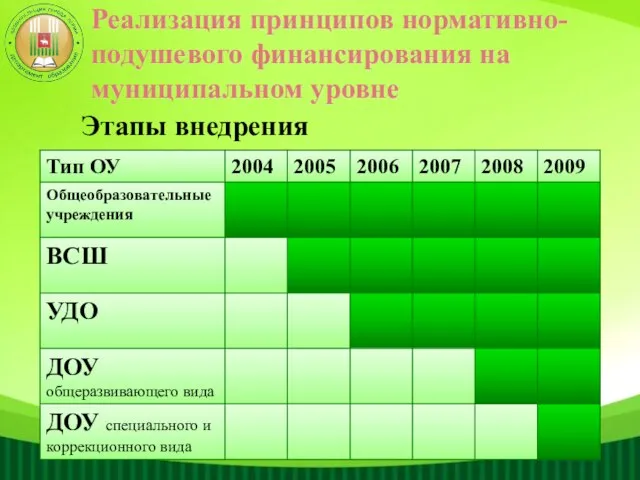 Реализация принципов нормативно-подушевого финансирования на муниципальном уровне
Реализация принципов нормативно-подушевого финансирования на муниципальном уровне Верейская по деньгам - ИТОГ
Верейская по деньгам - ИТОГ Дизайнер в отечественном ИТ бизнесе: многообразие деятельности, недооцененные компоненты профессионализма, стратегия роста Сер
Дизайнер в отечественном ИТ бизнесе: многообразие деятельности, недооцененные компоненты профессионализма, стратегия роста Сер Симметрия в архитектуре
Симметрия в архитектуре Презентация на тему Основные типы задач на проценты
Презентация на тему Основные типы задач на проценты  Вопросы внедрения национальной Интернет-адресации (IDN) .КАЗ
Вопросы внедрения национальной Интернет-адресации (IDN) .КАЗ Шаблон. Название темы
Шаблон. Название темы Презентация на тему Деревья
Презентация на тему Деревья  Учимся рисовать синичку (1)
Учимся рисовать синичку (1) Ох, уж эта функция
Ох, уж эта функция ЕДИНАЯ СИСТЕМА КЛАССИФИКАТОРОВ АНАЛИТИЧЕСКИХ ДАННЫХ
ЕДИНАЯ СИСТЕМА КЛАССИФИКАТОРОВ АНАЛИТИЧЕСКИХ ДАННЫХ Основы программирования промышленных роботов
Основы программирования промышленных роботов Образ матери в искусстве
Образ матери в искусстве Исследование опорно-двигательного аппарата учащихся Кугультинской средней школы
Исследование опорно-двигательного аппарата учащихся Кугультинской средней школы Шар ( сфера )
Шар ( сфера ) Школа нумерологии Светланы Сорокиной. Основы нумерологии. Базовый курс. Урок 2
Школа нумерологии Светланы Сорокиной. Основы нумерологии. Базовый курс. Урок 2 С Новым годом поздравляю
С Новым годом поздравляю Презентация на тему Книжная миниатюра Востока
Презентация на тему Книжная миниатюра Востока  О ДОЛГОСРОЧНОМ РЕГУЛИРОВАНИИ ТАРИФОВ НА УСЛУГИ ПО ПЕРЕДАЧЕ ТЕПЛОВОЙ ЭНЕРГИИ ООО «СВЕРДЛОВСКАЯ ТЕПЛОСНАБЖАЮЩАЯ КОМПАНИЯ»
О ДОЛГОСРОЧНОМ РЕГУЛИРОВАНИИ ТАРИФОВ НА УСЛУГИ ПО ПЕРЕДАЧЕ ТЕПЛОВОЙ ЭНЕРГИИ ООО «СВЕРДЛОВСКАЯ ТЕПЛОСНАБЖАЮЩАЯ КОМПАНИЯ» Начало Второй Мировой Войны
Начало Второй Мировой Войны Понятие психологии
Понятие психологии Страховые фонды Понятие, сущность, основные формы
Страховые фонды Понятие, сущность, основные формы