Содержание
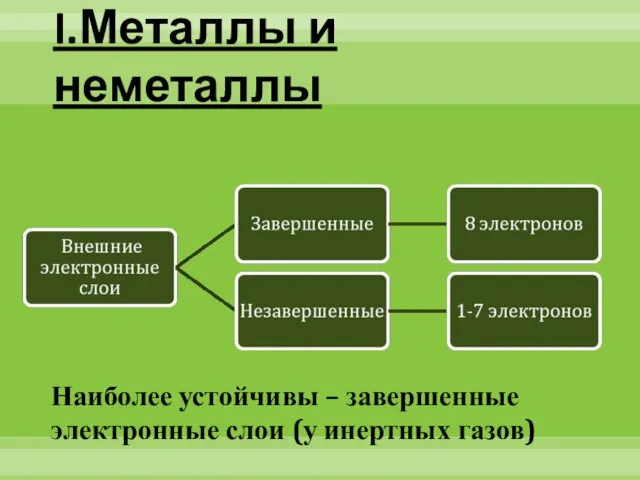
- 2. I.Металлы и неметаллы Наиболее устойчивы – завершенные электронные слои (у инертных газов)
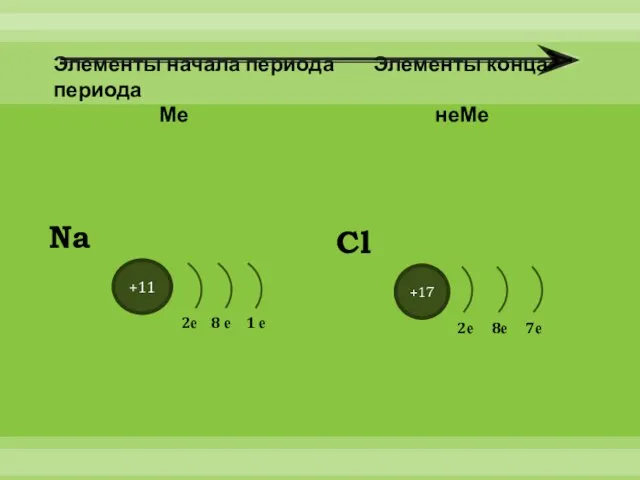
- 3. Элементы начала периода Элементы конца периода Ме неМе +11 2е 8 е 1 е Na +17
- 4. Атомы металлов имеют небольшое число электронов на внешнем электронном слое и большие радиусы атомов, следовательно легко
- 5. Энергия ионизации (Eионизации ) - это энергия, необходимая для отрыва наименее связанного с атомом электрона
- 6. Энергия сродства к электрону (Eсродства ) - это энергия, которая выделяется при присоединении одного электрона к
- 7. Электроотрицательность (ЭО) ЭО = Eионизации + Eсродства 2 Чем больше ЭО, тем больше выражены металлические свойства
- 8. Электроотрицательность - это способность атомов оттягивать на себя электроны от атомов других элементов
- 9. II. Изменение характеристик элементов в периодах и группах
- 10. Электроны удерживаются в атоме за счет притяжения к положительно заряженному ядру Сила притяжения между разноименно заряженными
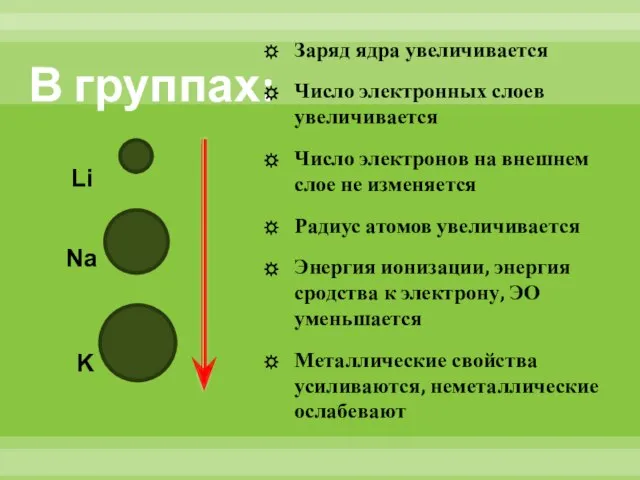
- 11. В группах: Заряд ядра увеличивается Число электронных слоев увеличивается Число электронов на внешнем слое не изменяется
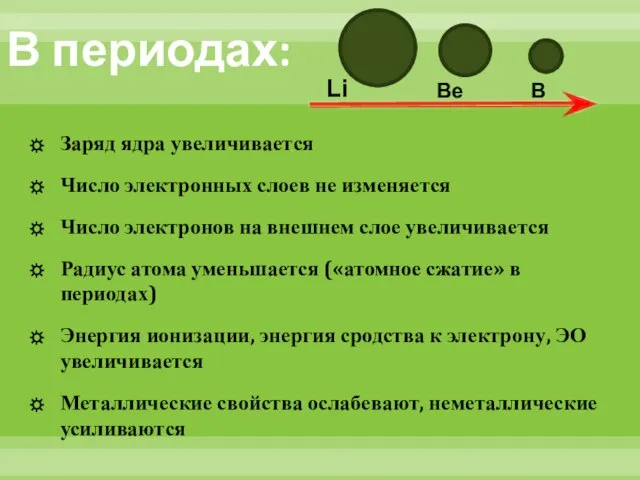
- 12. В периодах: Заряд ядра увеличивается Число электронных слоев не изменяется Число электронов на внешнем слое увеличивается
- 13. Закрепление № 6 – 26 (задачник)
- 15. Скачать презентацию








 Сказкотерапия в работе с детьми раннего возраста с нарушением слуха
Сказкотерапия в работе с детьми раннего возраста с нарушением слуха Мебель. Стул
Мебель. Стул Уроки «Введение в православную отечественную культуру» в начальной школе
Уроки «Введение в православную отечественную культуру» в начальной школе Экономические основы налогоообложения. Принципы и методы налогообложения
Экономические основы налогоообложения. Принципы и методы налогообложения Каналы рекламной коммуникации и средства рекламы
Каналы рекламной коммуникации и средства рекламы  Моя цветочная полянка
Моя цветочная полянка Презентация к уроку математики в 1 классе по УМК «Школа России»
Презентация к уроку математики в 1 классе по УМК «Школа России» Сущность и методологические основы управления организацией
Сущность и методологические основы управления организацией День Земли
День Земли СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО «
СОВРЕМЕННЫЕ СИСТЕМЫ ЗАЩИТЫ И АВТОМАТИЗАЦИИ НА МНОГОЦЕПНЫХ ЛИНИЯХ ЭЛЕКТРОПЕРЕДАЧИ СВЕРХВЫСОКОГО НАПРЯЖЕНИЯ Янез Законьшек ЗАО « Школьный бизнес-стартап
Школьный бизнес-стартап Рынок ценных бумаг
Рынок ценных бумаг Презентация по английскому языку _Oscar Wilde_
Презентация по английскому языку _Oscar Wilde_ The 25 th of December is Christmas
The 25 th of December is Christmas Остановись, мгновение! (к истории возникновения и развития фотографии)
Остановись, мгновение! (к истории возникновения и развития фотографии) Веб-аналитика в 2011 году
Веб-аналитика в 2011 году Организационная структура вооруженных сил РФ
Организационная структура вооруженных сил РФ Плавание и его воздействие на развитие системы опорно-двигательного аппарата
Плавание и его воздействие на развитие системы опорно-двигательного аппарата Лечение и профилактика синдрома смежного уровня
Лечение и профилактика синдрома смежного уровня Строительный рынок в Росиии. Алексеев Дмитрий гр.ПИ-07
Строительный рынок в Росиии. Алексеев Дмитрий гр.ПИ-07 Основные положения Таможенного кодекса таможенного союзаТаможенная служба Республики КазахстанБрюссель, 25 января 2010 года
Основные положения Таможенного кодекса таможенного союзаТаможенная служба Республики КазахстанБрюссель, 25 января 2010 года Курс S60 days for result
Курс S60 days for result Половое размножение растений
Половое размножение растений Вредные привычки – нам не друзья
Вредные привычки – нам не друзья Presentation Title
Presentation Title  Практика работы на компьютере 3 класс
Практика работы на компьютере 3 класс Психологическая теория возникновения права
Психологическая теория возникновения права Электробалластер ЭЛБ-4
Электробалластер ЭЛБ-4