Содержание
- 2. ГЛАВНАЯ ЦЕЛЬ ЭТИЧЕСКОЙ ЭКСПЕРТИЗЫ Определить, с каким риском для субъекта исследования может быть связано их участие
- 3. НЕЗАВИСИМЫЙ ЭТИЧЕСКИЙ КОМИТЕТ Эта структура создается и существует именно для того, чтобы проводить этическую экспертизу Это
- 4. Обязательное требование GCP: Каждый исследовательский проект может осуществляться только после того, как независимым этическим комитетом будет
- 5. ЧТО НЕОБХОДИМО ЗНАТЬ? До начала исследования исследователь должен получить письменное одобрение этического комитета письменной формы информированного
- 6. ЭТАПЫ ПРОХОЖДЕНИЯ ЭТИЧЕСКОЙ ЭКСПЕРТИЗЫ
- 7. 1. Представление документов Документация по планируемому клиническому испытанию подается в Этический комитет от лица заявителя, несущего
- 8. 2. Сроки и адрес представления Документы подаются в Этический комитет СибГМУ каждый понедельник месяца с 14.00
- 9. Общие требования к предоставлению документов: Материалы исследования должны направляться в Этический комитет СибГМУ на имя председателя
- 10. Титульный лист 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
- 11. Титульный лист (на бумажную папку с завязками): Название протокола: Название исследования (должно соответствовать протоколу и аннотации)
- 12. 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ: 2.Подписанное заявителем и датированное заявление на рассмотрение Заявление
- 13. Заявка на проведение этической экспертизы Председателю Комитета по Этике СибГМУ д.м.н., профессору Е.Б.Букреевой Дата подачи документов
- 14. 3.Протокол планируемого исследования вместе с необходимыми приложениями и сопутствующими документами 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА
- 15. ПРОТОКОЛ ИССЛЕДОВАНИЯ Введение (краткое описание проблемы и схемы лечения) Цели исследования Длительность исследования Количество испытуемых Информированное
- 16. 4.Аннотация планируемого научного исследования 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
- 17. АННОТАЦИЯ НАУЧНОГО ИССЛЕДОВАНИЯ Требования стандартные для диссертационных работ
- 18. 5. Форма информационного листка субъекта исследования 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
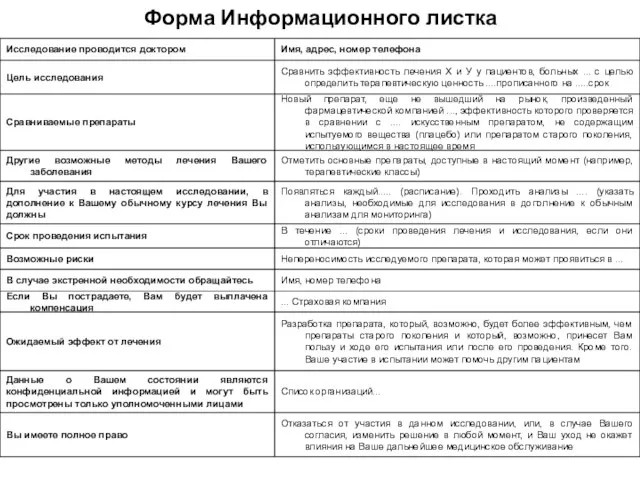
- 19. ФОРМА ИНФОРМАЦИОННОГО ЛИСТКА
- 20. ЗАЧЕМ ИНФОРМАЦИОННЫЙ ЛИСТОК НУЖЕН ПАЦИЕНТУ Оно дает возможность участнику исследования ознакомиться с тем, … что его
- 21. РОЛЬ ИНФОРМАЦИОННОГО ЛИСТКА В КЛИНИЧЕСКОМ ИССЛЕДОВАНИИ Правильно заполненный информационный листок подтверждает правомерность участия пациента в клиническом
- 22. ПРОЦЕДУРА ПОЛУЧЕНИЯ ИНФОРМАЦИОННОГО ЛИСТКА Наличие времени для ознакомления Возможность ознакомиться с информационным листком субъекта или лиц,
- 23. ТРЕБОВАНИЯ К ФОРМЕ ИНФОРМАЦИОННОГО ЛИСТКА Текст на понятном пациенту языке Исключение использования не понятной пациенту терминологии
- 24. ТРЕБОВАНИЯ К ФОРМЕ ИНФОРМАЦИОННОГО ЛИСТКА При наличии специальных терминов необходима расшифровка или объяснение в тексте Шрифт
- 25. ОСНОВНЫЕ ЭЛЕМЕНТЫ ИНФОРМАЦИОННОГО ЛИСТКА Утверждение о статусе лечения Описание целей исследования Описание возможного риска Описание ожидаемой
- 26. Форма Информационного листка
- 27. 6. Информированное согласие 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
- 28. ИНФОРМИРОВАННОЕ СОГЛАСИЕ Это процесс, в ходе которого субъект исследования добровольно подтверждает свою волю участвовать в данном
- 29. ИНФОРМИРОВАННОЕ СОГЛАСИЕ Обеспечивает отношение к пациенту как к личности, которая вправе осуществлять свободный выбор и контролировать
- 30. ЦЕЛЬ ПОЛУЧЕНИЯ ИНФОРМИРОВАННОГО СОГЛАСИЯ Минимизировать возможность морального или материального ущерба вследствие недобросовестного лечения Способствовать повышению чувства
- 31. ПРОЦЕДУРА ПОЛУЧЕНИЯ ИНФОРМИРОВАННОГО СОГЛАСИЯ Это процесс ОБМЕНА ИНФОРМАЦИЕЙ, который имеет место между пациентом и исследователем –
- 32. КОГДА ИНФОРМИРОВАННОЕ СОГЛАСИЕ ДОЛЖНО БЫТЬ ПОДПИСАНО? Подписано до момента включения субъекта в исследование
- 33. КОГДА ИНФОРМИРОВАННОЕ СОГЛАСИЕ МОЖНО НЕ ПОДПИСЫВАТЬ? Процедуры, которые являются рутинными и предоставляются пациенту в обычном порядке
- 34. Типовые формы информированного согласия Настоящим я ___________________________________________________________ даю согласие на участие в испытании (название исследуемого препарата
- 35. ПОЛУЧЕНИЕ СОГЛАСИЯ ЗАКОННОГО ПРЕДСТАВИТЕЛЯ В некоторых случаях, если невозможно получить согласие пациента до начала исследования, возможна
- 36. ПОЛУЧЕНИЕ СОГЛАСИЯ ЗАКОННОГО ПРЕДСТАВИТЕЛЯ КОГДА ЭТО НУЖНО? Неотложные реанимационные состояния (инсульт, тяжелая травма и т.д.) В
- 37. ПОЛУЧЕНИЕ СОГЛАСИЯ ЗАКОННОГО ПРЕДСТАВИТЕЛЯ Если пациент включен в испытание с согласия его законного представителя, он должен
- 38. ПРИВЛЕЧЕНИЕ НЕЗАВИСИМЫХ СВИДЕТЕЛЕЙ КОГДА ЭТО НУЖНО? Пациент слепой Пациент неграмотный Перевод невозможен КТО ИМ МОЖЕТ БЫТЬ?
- 39. ПРИВЛЕЧЕНИЕ НЕЗАВИСИМЫХ СВИДЕТЕЛЕЙ Свидетель НЕ ДАЕТ согласия от лица испытуемого Свидетель подписывает и датирует Свидетель подтверждает,
- 40. «УЯЗВИМЫЕ» ИСПЫТУЕМЫЕ Лица, на желание которых участвовать в клинических исследованиях может повлиять ожидание каких-либо выгод от
- 41. «УЯЗВИМЫЕ» ИСПЫТУЕМЫЕ Студенты медицинских, фармакологических, сестринских учебных заведений Младший персонал больниц и лабораторий, военнослужащие, заключенные Несовершеннолетние
- 42. «УЯЗВИМЫЕ» ИСПЫТУЕМЫЕ Испытания педиатрических препаратов: «… согласие ребенка должно быть получено в дополнение к разрешению его
- 43. РАСПРОСТРАНЕННЫЕ ОШИБКИ Неполучение согласия до начала участия испытуемого в исследовании Не поставленные должным образом подписи и
- 44. 7. СПРАВКА О ВЫПОЛНЕННОМ ОБЪЕМЕ НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЫ 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
- 45. СПРАВКА О ВЫПОЛНЕННОМ ОБЪЕМЕ Информирует Вас о том, что по протоколу Научно-исследовательской работы: _____________________________________________ на соискание
- 46. 8. ИНДИВИДУАЛЬНАЯ РЕГИСТРАЦИОННАЯ КАРТА/ФОРМА (ИРК/ИРФ) 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
- 47. ИНДИВИДУАЛЬНАЯ РЕГИСТРАЦИОННАЯ КАРТА / ФОРМА (ИРК / ИРФ) Это бумажный или электронный документ, предназначенный для внесения
- 48. ИНДИВИДУАЛЬНАЯ РЕГИСТРАЦИОННАЯ КАРТА / ФОРМА (ИРК / ИРФ) Должны быть указаны следующие данные: номер, название исследования
- 49. Должны быть предусмотрены страницы для внесения информации по следующим позициям: история болезни данные физического обследования основной
- 50. Исследователь несет ответственность за все данные, записанные в Индивидуальные регистрационные карты, и должен заверять их своей
- 51. 9. ЗАКЛЮЧЕНИЕ РЕЦЕНЗЕНТА 3. ДОКУМЕНТАЦИЯ В ЭТИЧЕСКИЙ КОМИТЕТ ДОЛЖНА ВКЛЮЧАТЬ СЛЕДУЮЩЕЕ:
- 52. ЗАКЛЮЧЕНИЕ РЕЦЕНЗЕНТА Название исследования Исполнитель (асп., докт., соиск. ) Руководитель исследования (консультант): Место проведения исследования: Цель
- 53. ЗАКЛЮЧЕНИЕ РЕЦЕНЗЕНТА (лист №1) Название исследования Исполнитель (асп., докт., соиск., исследователь) Руководитель исследования (консультант): Место проведения
- 54. ЗАКЛЮЧЕНИЕ РЕЦЕНЗЕНТА (лист №2) Исследование служит: Непосредственно интересам испытуемых Чисто научным целям, не имеющим непосредственного значения
- 55. 4. Оформление представления в Этическом комитете При получении папки всех документов проводится предварительная этическая экспертиза материалов
- 56. 4. Оформление представления в Этическом комитете Исследователь обязан быть на заседании Этического комитета Исследователь обязан в
- 58. Скачать презентацию






















































 Этапы принятия решения
Этапы принятия решения Викторина Iч 2022 26.10
Викторина Iч 2022 26.10 Режущий инструмент лущильных станков
Режущий инструмент лущильных станков Презентация на тему На пути к индустриальной эре
Презентация на тему На пути к индустриальной эре  Транспортно-пересадочные узлы в рамках реализации комплексного инвестиционного проекта «Реконструкция и развитиеМалого кольца
Транспортно-пересадочные узлы в рамках реализации комплексного инвестиционного проекта «Реконструкция и развитиеМалого кольца Презентация (2)
Презентация (2) Петрович. Моя корзина
Петрович. Моя корзина Бер өн менән генә айырылған һүҙҙәр уйла
Бер өн менән генә айырылған һүҙҙәр уйла Источники и системы теплоснабжения
Источники и системы теплоснабжения Природный стиль. Драма
Природный стиль. Драма Уильям Шекспир
Уильям Шекспир Как усовершенствовать учебную деятельность
Как усовершенствовать учебную деятельность Декларация о правах ребенка
Декларация о правах ребенка Ташкент – столица Узбекистана
Ташкент – столица Узбекистана История становления СПО НИКА УралГУФК
История становления СПО НИКА УралГУФК Месяц безопасности
Месяц безопасности Презентация на тему Родная природа в стихотворениях русских поэтов 19 века
Презентация на тему Родная природа в стихотворениях русских поэтов 19 века Рельеф Южной Америки
Рельеф Южной Америки Yarema Zyelyk
Yarema Zyelyk Еко-туризм в селі Дмитрівка, Одеській області
Еко-туризм в селі Дмитрівка, Одеській області Правила проведения аварийно-спасательных работ при обрушении зданий и сооружений
Правила проведения аварийно-спасательных работ при обрушении зданий и сооружений Карьера
Карьера Акционерный капитал
Акционерный капитал Стилистическая эволюция в творчестве Матиса Готхарта-Нитхарта
Стилистическая эволюция в творчестве Матиса Готхарта-Нитхарта ПРЕДВАРИТЕЛЬНЫЕ ИТОГИ СОЦИАЛЬНО-ЭКОНОМИЧЕСКОГО РАЗВИТИЯ ОМСКОЙ ОБЛАСТИ В 2010 ГОДУ
ПРЕДВАРИТЕЛЬНЫЕ ИТОГИ СОЦИАЛЬНО-ЭКОНОМИЧЕСКОГО РАЗВИТИЯ ОМСКОЙ ОБЛАСТИ В 2010 ГОДУ Самообразование педагога
Самообразование педагога Олимпийские игры. Где и когда проходили первые Олимпийские игры
Олимпийские игры. Где и когда проходили первые Олимпийские игры Таёжная область Северного Урала
Таёжная область Северного Урала