Содержание
- 2. Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные.
- 3. Для реакций ферментативного катализа характерны: 1) высокая эффективность 2) строгая избирательность и направленность действия 3) субстратная
- 4. Скорость ферментативных реакций Скорость ферментативных реакций зависит от: 1) температуры 2) концентрации фермента 3) концентрации субстрата
- 5. Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0,
- 6. Классификация ферментов По типу катализируемых химических превращений ферменты разделены на 6 классов: оксиредуктазы (перенос атомов водорода,
- 8. Скачать презентацию
Слайд 2Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две
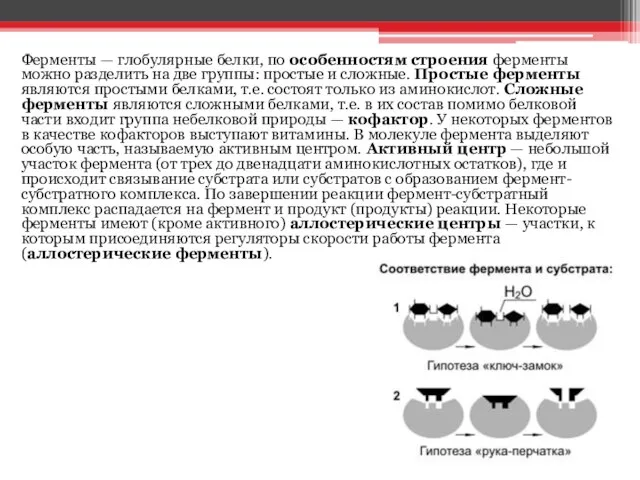
группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Слайд 3Для реакций ферментативного катализа характерны:
1) высокая эффективность
2) строгая избирательность и
Для реакций ферментативного катализа характерны:
1) высокая эффективность
2) строгая избирательность и

направленность действия
3) субстратная специфичность
4) тонкая и точная регуляция
Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
3) субстратная специфичность
4) тонкая и точная регуляция
Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Слайд 4Скорость ферментативных реакций
Скорость ферментативных реакций зависит от:
1) температуры
2) концентрации фермента
3)
Скорость ферментативных реакций
Скорость ферментативных реакций зависит от:
1) температуры
2) концентрации фермента
3)

концентрации субстрата
4) рН.
Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
4) рН.
Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
Слайд 5Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную

активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Слайд 6Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
оксиредуктазы (перенос
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
оксиредуктазы (перенос

атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
изомеразы (внутримолекулярная перестройка — изомераза),
лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
изомеразы (внутримолекулярная перестройка — изомераза),
лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Следующая -
Мутации 9 класс Использование технологии развития критического мышления учащихся (ТРКМ) на уроках
Использование технологии развития критического мышления учащихся (ТРКМ) на уроках The present simple tense
The present simple tense  Портфолио преподавателя Дерябиной С.П.
Портфолио преподавателя Дерябиной С.П. Академическая гребля
Академическая гребля Проектная деятельность Воскресный обед
Проектная деятельность Воскресный обед Спонсорство VITEK и Rondell на ТНТ в программе Большой завтрак 2019
Спонсорство VITEK и Rondell на ТНТ в программе Большой завтрак 2019 Глобализация, масс-медиа
Глобализация, масс-медиа Презентация на тему перпендикулярные прямые 7 класс
Презентация на тему перпендикулярные прямые 7 класс  Сделай правильный выбор
Сделай правильный выбор Как добыть огонь
Как добыть огонь Вовлечение местного населения в развитие туризма в Катунском биосферном заповеднике как способ адаптации местных сообществ к кли
Вовлечение местного населения в развитие туризма в Катунском биосферном заповеднике как способ адаптации местных сообществ к кли Современные концепции и модели развития одаренности
Современные концепции и модели развития одаренности Алгоритм психологической организации группы. Лекция 1
Алгоритм психологической организации группы. Лекция 1 Позиционирование: формула. Семь простых вопросов
Позиционирование: формула. Семь простых вопросов Метаболизм
Метаболизм  Бактериологическое оружие и его воздействие на человека
Бактериологическое оружие и его воздействие на человека BACILLARIOPHYTA ВОДОЕМОВДНЕПРОВСКО-ОРЕЛЬСКОГО ПРИРОДНОГО ЗАПОВЕДНИКА(УКРАИНА)
BACILLARIOPHYTA ВОДОЕМОВДНЕПРОВСКО-ОРЕЛЬСКОГО ПРИРОДНОГО ЗАПОВЕДНИКА(УКРАИНА) DFM-2020-01-12-RUS-Confirmed
DFM-2020-01-12-RUS-Confirmed Презентация на тему Степени сравнения имен прилагательных (6 класс)
Презентация на тему Степени сравнения имен прилагательных (6 класс) Заполнение формы заявки на 2 конкурс социальных проектов в рамках государственной грантовой программы Партнерство
Заполнение формы заявки на 2 конкурс социальных проектов в рамках государственной грантовой программы Партнерство Абитуриент-центр. Занимательные групповые экскурсии для школьников в формате Научный туризм
Абитуриент-центр. Занимательные групповые экскурсии для школьников в формате Научный туризм Графическое изображение деталей
Графическое изображение деталей Импульс тела 9 класс
Импульс тела 9 класс Занятие по лепке из пластилина в программе Картонный домик
Занятие по лепке из пластилина в программе Картонный домик Презентация на тему Нормативно-правовое регулирование объема домашнего задания обучающихся
Презентация на тему Нормативно-правовое регулирование объема домашнего задания обучающихся Растягивающие и сжимающие нагрузки
Растягивающие и сжимающие нагрузки Презентация на тему Население Азии
Презентация на тему Население Азии Ученическая конференция
Ученическая конференция