Содержание
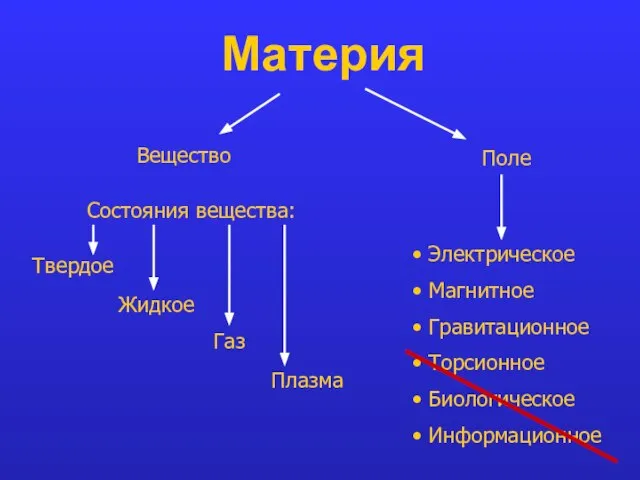
- 3. Материя Вещество Поле Состояния вещества: Твердое Жидкое Газ Плазма Электрическое Магнитное Гравитационное Торсионное Биологическое Информационное
- 4. «Первичные» физические величины Масса М кг Длина L м Время t с
- 5. Производные физические величины Скорость v Lt-1 м/с Ускорение a Lt-2 м/с2 Сила F MLt-2 Н =
- 6. Единицы давления Па = Н/м2 см Н2О ≈ 100 Па = 0,1 кПа = 1 гПа
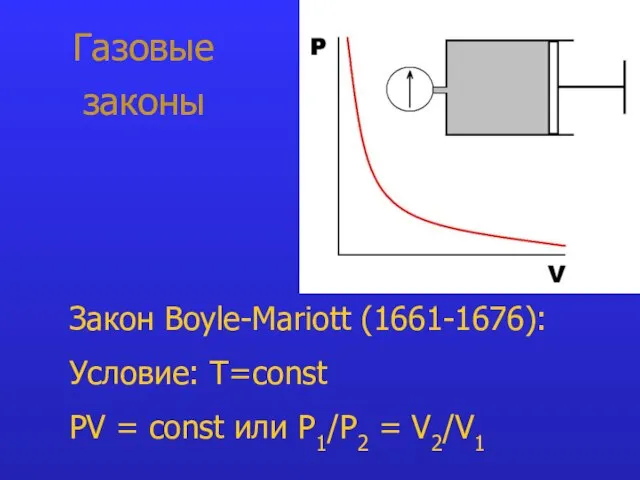
- 7. Газовые законы Закон Boyle-Mariott (1661-1676): Условие: T=const PV = const или P1/P2 = V2/V1
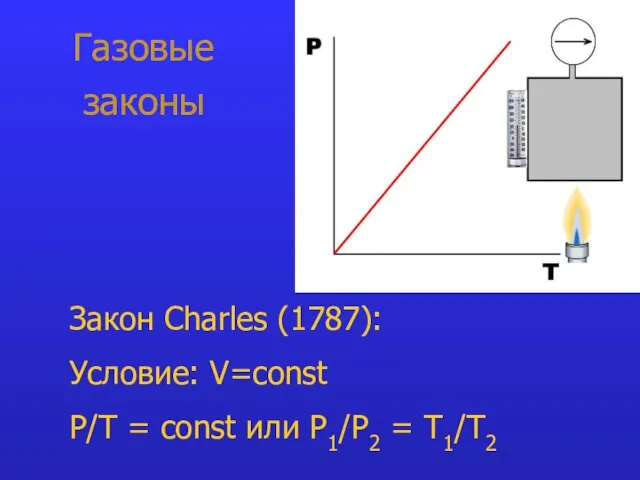
- 8. Газовые законы Закон Charles (1787): Условие: V=const P/T = const или P1/Р2 = T1/Т2
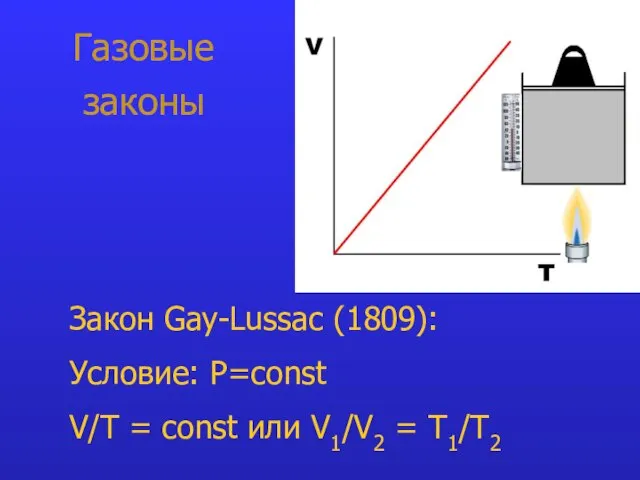
- 9. Газовые законы Закон Gay-Lussac (1809): Условие: P=const V/T = const или V1/V2 = T1/Т2
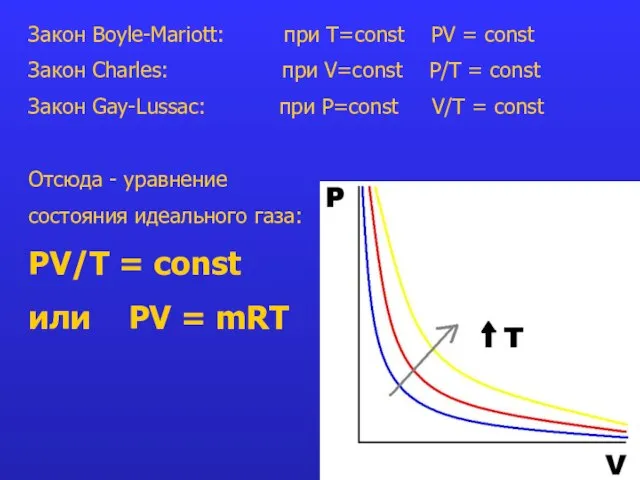
- 10. Закон Boyle-Mariott: при T=const PV = const Закон Charles: при V=const P/Т = const Закон Gay-Lussac:
- 11. Критическая температура: Газ можно перевести в жидкое состояние путем сжатия только при температуре ниже критической (точка
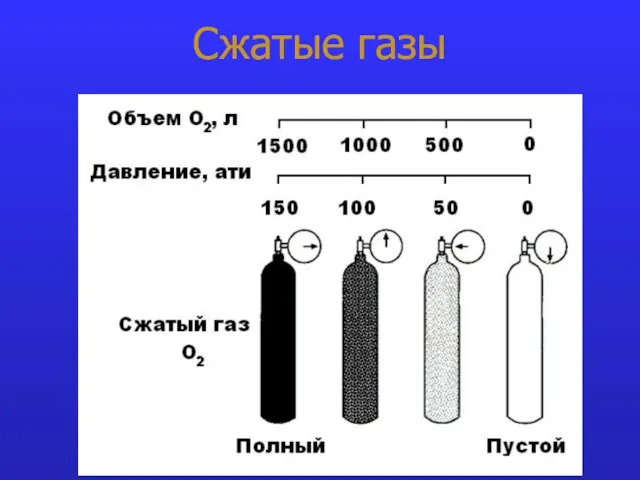
- 12. Сжатые газы
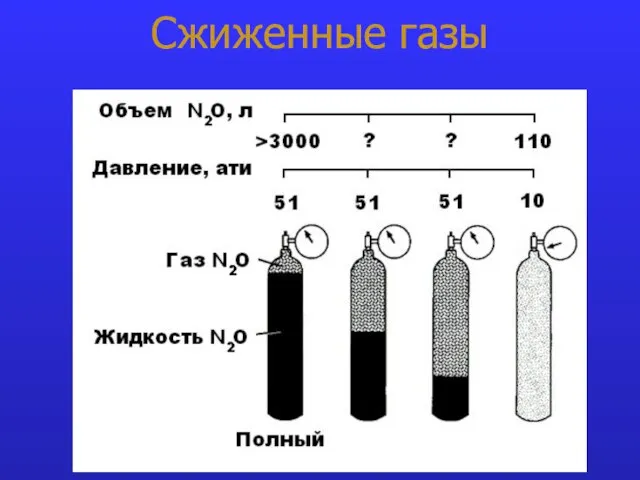
- 13. Сжиженные газы
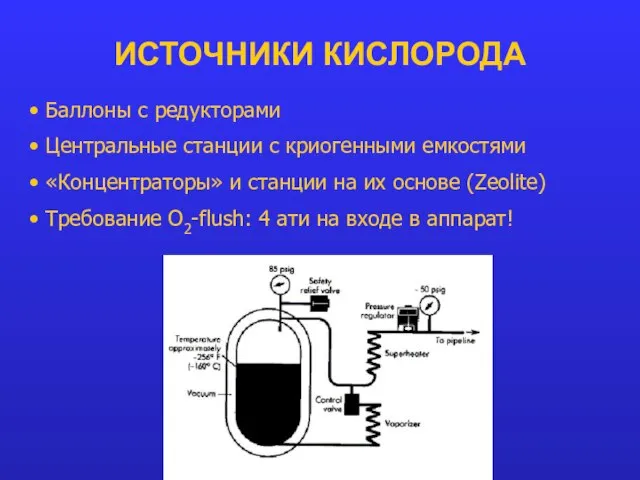
- 14. ИСТОЧНИКИ КИСЛОРОДА Баллоны с редукторами Центральные станции с криогенными емкостями «Концентраторы» и станции на их основе
- 15. Парциальное (частичное) давление - давление, которое оказывал бы каждый газ в отдельности в том случае, если
- 16. Закон Avogadro (1811, «молекулярная гипотеза»): 1 моль (6⋅1023 молекул) любого газа при одинаковых t и Р
- 17. Цветовая кодировка газов !
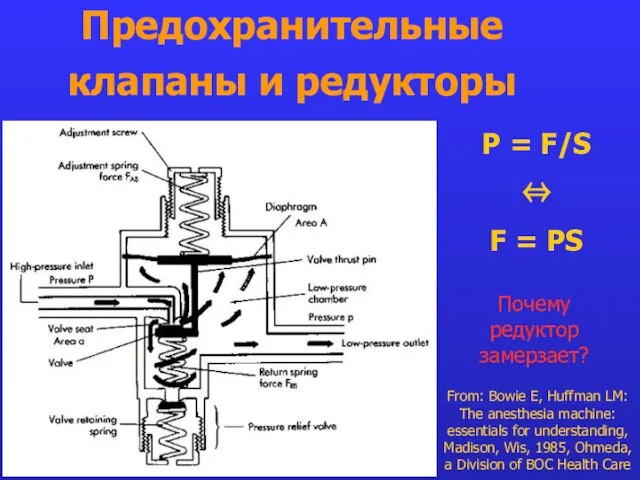
- 18. Предохранительные клапаны и редукторы From: Bowie E, Huffman LM: The anesthesia machine: essentials for understanding, Madison,
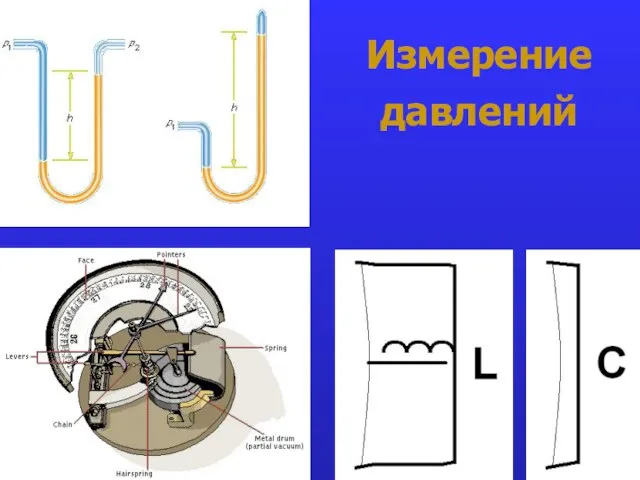
- 19. Измерение давлений
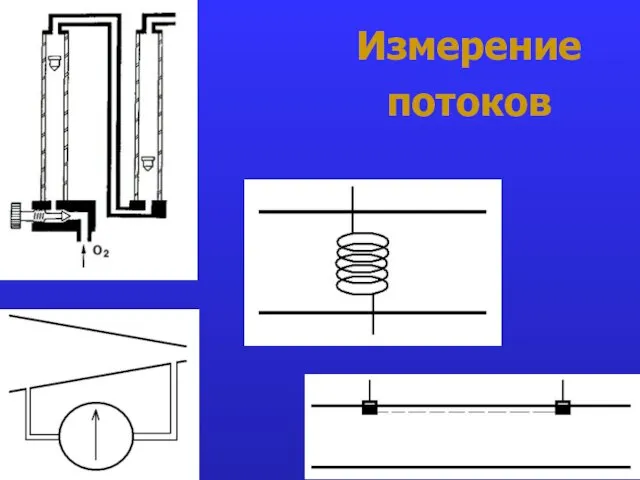
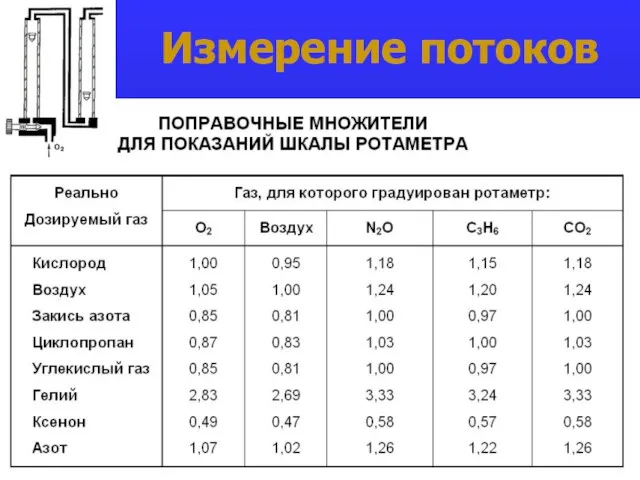
- 20. Измерение потоков
- 21. Измерение потоков
- 22. Измерение объемов V = ∫ Q(t)dt
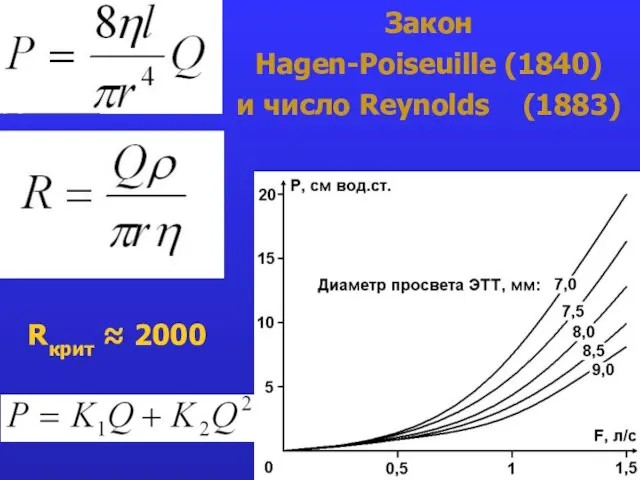
- 23. Закон Hagen-Poiseuille (1840) и число Reynolds (1883) Rкрит ≈ 2000
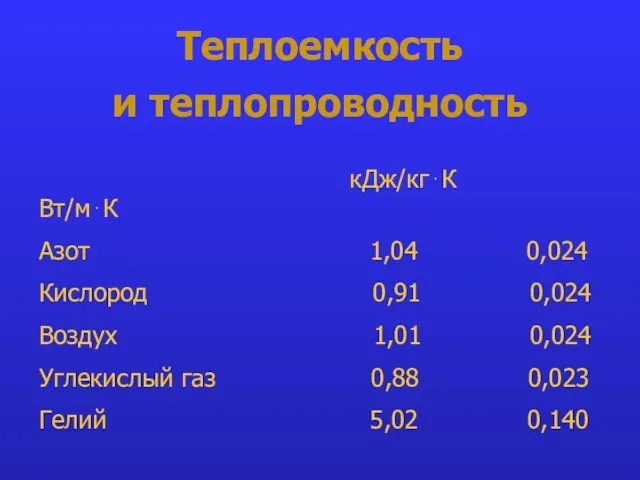
- 24. Теплоемкость и теплопроводность кДж/кг⋅К Вт/м⋅К Азот 1,04 0,024 Кислород 0,91 0,024 Воздух 1,01 0,024 Углекислый газ
- 26. Скачать презентацию









 Наш кот
Наш кот Основные понятия теории информации
Основные понятия теории информации  Система правоотношений на транспорте
Система правоотношений на транспорте Тема 6. Социальные опасности и защита от них
Тема 6. Социальные опасности и защита от них Летняя кампания2011 года
Летняя кампания2011 года Баскетбо́л (англ. basket — корзина, ball — мяч)
Баскетбо́л (англ. basket — корзина, ball — мяч) Организация и проведение регионального этапа конкурса: разработка регионального плана мероприятий, формирование экспертной груп
Организация и проведение регионального этапа конкурса: разработка регионального плана мероприятий, формирование экспертной груп Светлые листья
Светлые листья Тренинг. Вводное занятие
Тренинг. Вводное занятие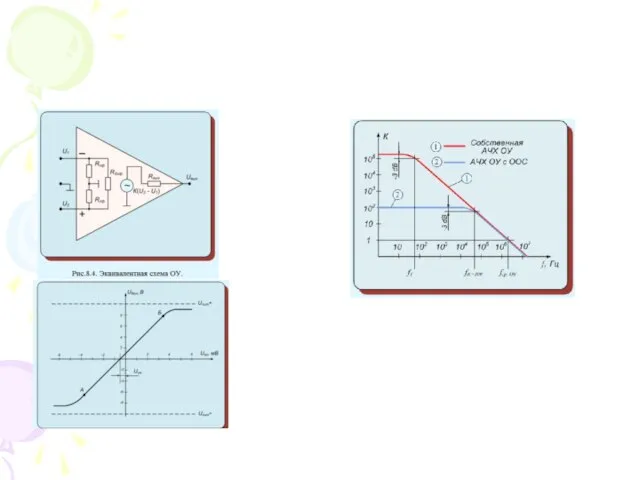 Операционные усилители
Операционные усилители Христианство и Ислам. История происхождения и основные характерные черты
Христианство и Ислам. История происхождения и основные характерные черты Лженаука в современном мире: медиасфера, высшее образование, школа
Лженаука в современном мире: медиасфера, высшее образование, школа Лыжная подготовка дошкольника
Лыжная подготовка дошкольника Электролиз
Электролиз Трихадеры в RAINBOW SIX
Трихадеры в RAINBOW SIX Одежда славян
Одежда славян Презентация на тему Как правильно переходить дорогу
Презентация на тему Как правильно переходить дорогу  Презентация на тему Антропогенез. Стадии антропогенеза
Презентация на тему Антропогенез. Стадии антропогенеза  Федеральный государственный образовательный стандарт
Федеральный государственный образовательный стандарт Старшая школа (2)
Старшая школа (2) Великие реформы 60-70 гг. XIX века
Великие реформы 60-70 гг. XIX века Опыт работы по теме:
Опыт работы по теме: Реализация музейно-образовательной программы Мы входим в мир прекрасного
Реализация музейно-образовательной программы Мы входим в мир прекрасного Россия в эпоху революций 1917 года и становления Советской власти
Россия в эпоху революций 1917 года и становления Советской власти ЛИТЕРАТУРА: В КАМНЕ И БРОНЗЕ
ЛИТЕРАТУРА: В КАМНЕ И БРОНЗЕ Раздельные пункты железных дорог. Раздел 6
Раздельные пункты железных дорог. Раздел 6 Характеристика видов рекламы
Характеристика видов рекламы Место риска в инвестировании капитала
Место риска в инвестировании капитала