Слайд 5Знаходження в природі
F Cl Br J At
ат.% 2,8·10-2 2,6·10-2 1,5·10-5 4·10-6

—
CaF2 – флюорит (плавиковий шпат)
3Ca3(PO4)2·CaF2 – апатит
Слайд 6
Na3[AlF6] – кріоліт
Основні запаси цього мінералу в Гренландії майже повністю вичерпані
Склад емалі
![Na3[AlF6] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю вичерпані](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/366279/slide-5.jpg)
зубів наближується до Ca5F(PO4)3
Добова потреба організму у F становить 1 мг, оптимальна концентрація у питній воді 1 мг/л
Слайд 7NaCl - камяна сіль (галіт)
KCl - сильвін
NaCl·KCl - сильвініт
KCl·MgCl2·6H2O - карналіт
MgCl2·6H2O –

бішофіт
Хлоридів(особливо NaCl) багато в соляних озерах, соляних відкладеннях.
НCl – шлунковий сік
NaCl – клітинна рідина
Слайд 8Бром та йод досить поширені, але власних покладів мінералів вони не мають,

а супроводжують хлор.
Морська вода мiстить ~ 7·10-3 % Br і ~ 5·10-6 % J.
Деякі морські водорості накопичують йод.
Попіл ламінаріі містить до 0,5% йоду.
KJO3 (в покладах селітри в Чілі та Болівії)
Слайд 9Найбільше йоду в бурових водах (до 3·10-3 %)
Організм людини містить близько 35

мг йоду, з них – 15 мг в щитовидній залозі.
At (від грецького astatos – нестійкий) радіоактивний елемент, відомо понад 20 ізотопів, жодного стабільного. Загальний вміст в земній корі товщиною 1,6 км ~ 70мг.
(Максимальна маса At, з якою мали справу дослідники - 2·10-9 г)
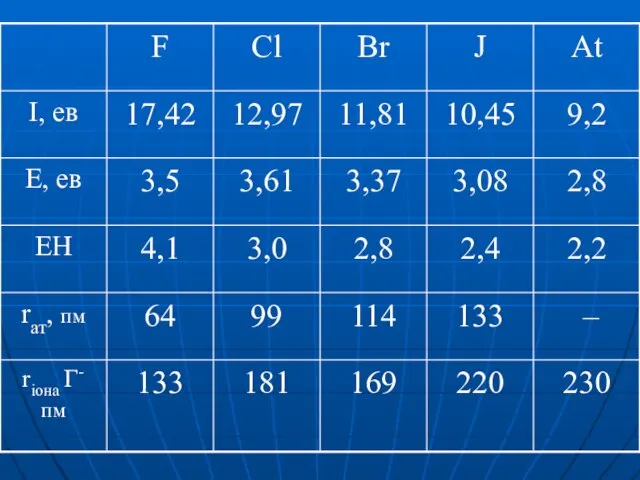
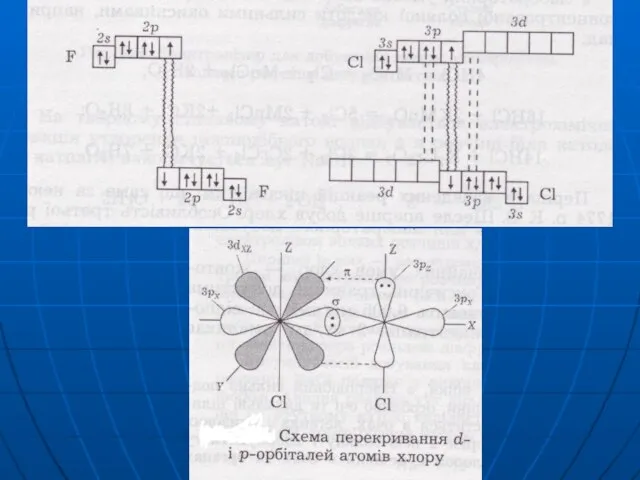
Слайд 10Головна підгрупа VII гр.
ns2np5
F 2s22p5 валентність = 1
ст. ок. 0, -1
ЕН =

4,1
Сl 3s23p53d0 валетність = 1,3,5,7
ст. ок. -1 0 +1 +3 +4 +5 +6 +7
Слайд 11Добування
У всіх випадках це процес окислення
F2 – добувають електролізом розплаву KF·2HF
K(-)

A (+)
2H+ + 2e → H2↑ 2F- - 2e → F2
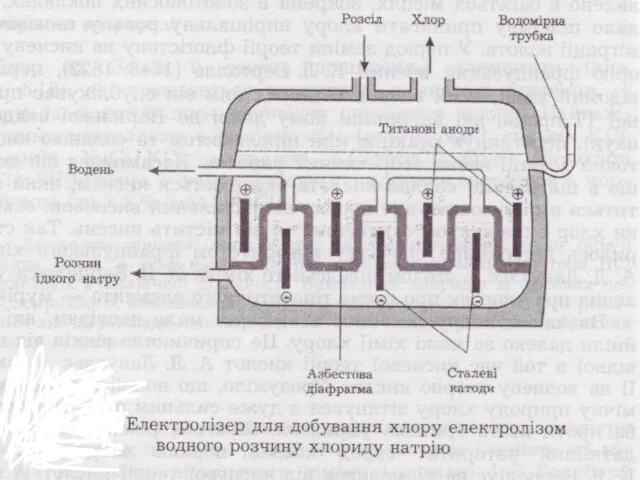
Слайд 12Cl2 добувають електролізом розчину NaCl
K (-)
Na+
2H2O + 2e →

H2 + 2OH-, Е0 = -0,41В .
A (+)
2Cl- - 2e → Cl2, Е0 = 1,36 В
2H2O - 4e → О2 + 4H+, Е0 = 1,23 В
Рівновагу в бік виділення Cl2 зміщують
1) підвищуючи [Cl-]
2) створюючи перенапругу виділенню О2
Слайд 14
2Br - + Cl2 → Br2 + 2Cl-
Br2 відганяють струменем водяної пари

та повітря
2J - + Cl2 → J2 + 2Cl-
з бурових вод
2NaJ+2NaNO2+2H2SO4→J2+2NO+Na2SO4+2H2O
з селітри
NaJO3 + 3NaHSO3 → NaJ + 3NaHSO4
J2 адсорбують активованим вугіллям або екстрагують
Слайд 16Лабораторні способи добування
Дія окисників на HCl або на NaCl
16HCl+2KMnO4 → 5Cl2+2MnCl2+2KCl+8H2O
4HCl +

MnO2 →Cl2 + MnCl2 + 2H2O
14HCl+K2Cr2O7 → 3Cl2+2CrCl3+2KCl+7H2O
Слайд 1710NaCl+2KMnO4+8H2SO4→5Cl2+2MnSO4+
K2SO4+5Na2SO4+8H2O
Br2 i J2 отримують із солей
2KBr + Cl2 → Br2 + 2KCl
2KJ

+ Cl2 → J2 + 2KCl
6KBr + K2Cr2O7 + 7H2SO4→5Br2 + Cr2(SO4)3 + K2SO4 + 8H2O
10KJ + 2KMnO4 + 8H2SO4 →5J2+ 2MnSO4+ K2SO4 + 8H2O
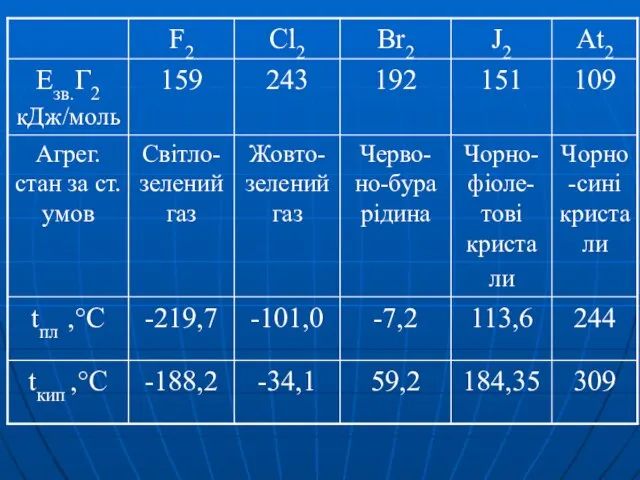
Слайд 20Властивості
F2 Cl2 Br2 J2
Енергія дисперсійної взаємодії
Ткипіння
pозчинність у воді
найвища у Br2

J2 розчиняється погано, але в присутності КJ – розчинність J2 зростає
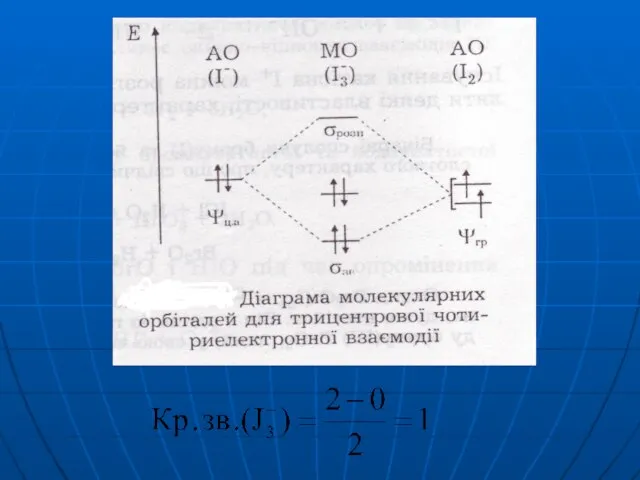
Слайд 21KJ + J2 → KJ3
J- + J2 → J3-
J →

← J- → ← J
0,5 0,5
(J : J : J)-
Слайд 23Галогени – типові окисники
ns2np5
Самий сильний - F2
F2 + 2e →

2F- Е0 = 2,85 В
2H2O + 2F2 → 4HF + O2, ΔН < 0
пісок, асбест спалахують в атмосфері фтору
SiO2 + 2F2 → SiF4 + O2
Kr + F2 → KrF2
Слайд 24Xe + F2 → XeF2
Xe + 2F2 → XeF4 Xe +

3F2 → XeF6
S + 3F2 → SF6, ΔН= -1207 кДж
2P + 5F2 → 2PF5, ΔН= -1385 кДж
ці реакції протікають навіть за t < 00С
2NH3 + 6F2 → 6HF + 2NF3 (за низьких t)
2NH3 + 3F2 → 6HF + N2 (за високих t)
Слайд 25
Cl2 + 2e → 2Cl- E0 = 1,36В
2Sb + 3Cl2 → 2SbCl3
2P

+ 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
2Fe + 3Cl2 → 2FeCl3
J2 + 2e → 2J- E0 = 0,53 В
Zn + J2 → ZnJ2
3J2 + 10HNO3 → 6HJO3 + 10NO + 2H2O
Слайд 32 F2 Cl2 Br2 J2
E°,B 2,87 1,36 1,06 0,53 окислювальні властивості зменшуються
H2

+ F2 → 2HF
H2 + Cl2 2HCl
H2 + Br2 2HBr
H2 + J2 2HJ
Слайд 33Cl2 2Cl·
H2 + Cl· → HCl + H·
2KBr + Cl2 →
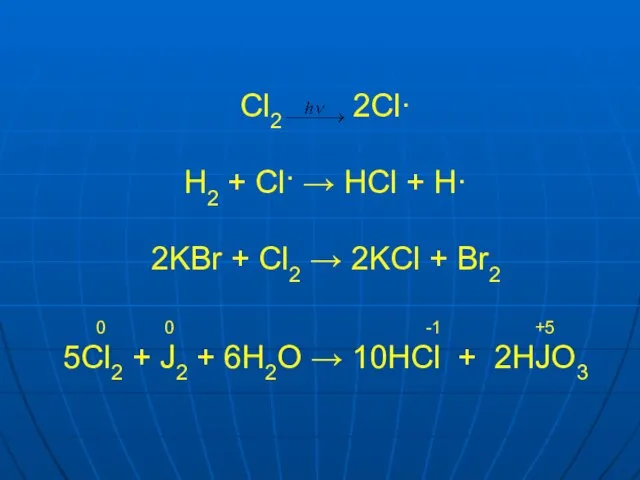
2KCl + Br2
0 0 -1 +5
5Cl2 + J2 + 6H2O → 10HCl + 2HJO3
Слайд 34Галогеноводні
Добування
HF
H2 + F2 → 2HF
для добування не використовують
CaF2 + H2SO4(р)→

CaSO4↓ + 2HF(розчин)
CaF2 + H2SO4(к)→ CaSO4↓ + 2HF↑
Слайд 35HCl
H2 + Cl2 → 2HCl
NaCl + H2SO4 → в розчині обмін
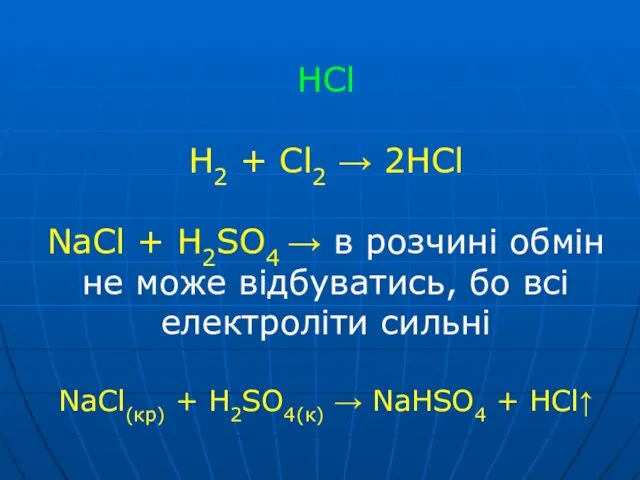
не може відбуватись, бо всі електроліти сильні
NaCl(кр) + H2SO4(к) → NaHSO4 + HCl↑
Слайд 37HBr
KBr(кp) + H2SO4(к)→ KHSO4 + HBr
2HBr + H2SO4 → Br2 +SO2
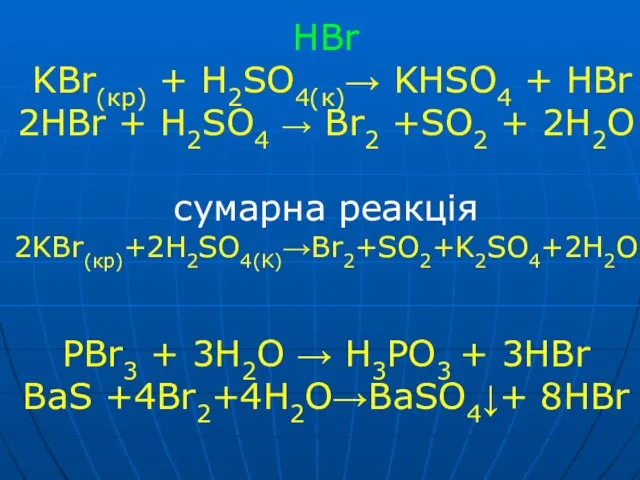
+ 2H2O
сумарна реакція
2KBr(кp)+2H2SO4(K)→Br2+SO2+K2SO4+2H2O
PBr3 + 3H2O → H3PO3 + 3HBr
BaS +4Br2+4H2O→BaSO4↓+ 8HBr
Слайд 38Аналогічно для HJ
8KJ +5H2SO4 → 4J2 +H2S+4K2SO4+4H2O
PJ3 + 3H2O →

H3PO3 + 3HJ
J2 + H2S → S↓ + 2HJ
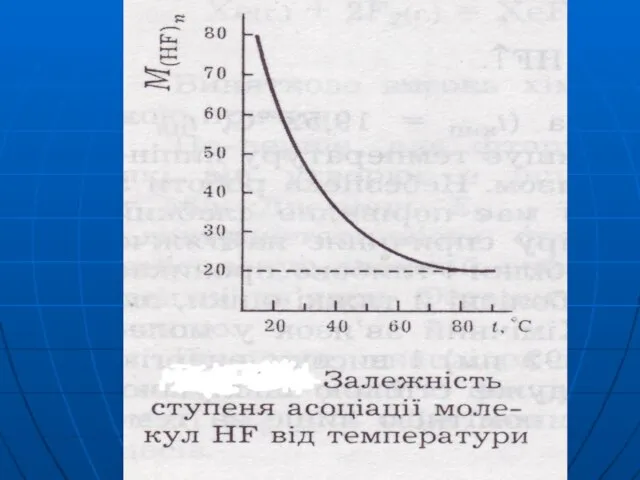
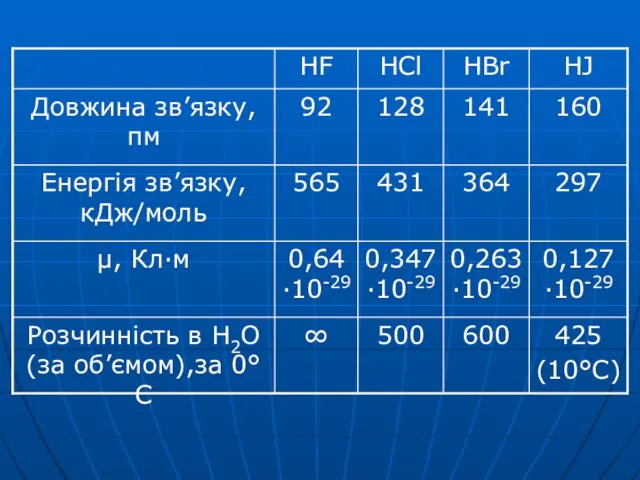
Слайд 39 HF HCl HBr HJ
tкип,°С 19,5 -85 -67 -35
ЕММВз зростає
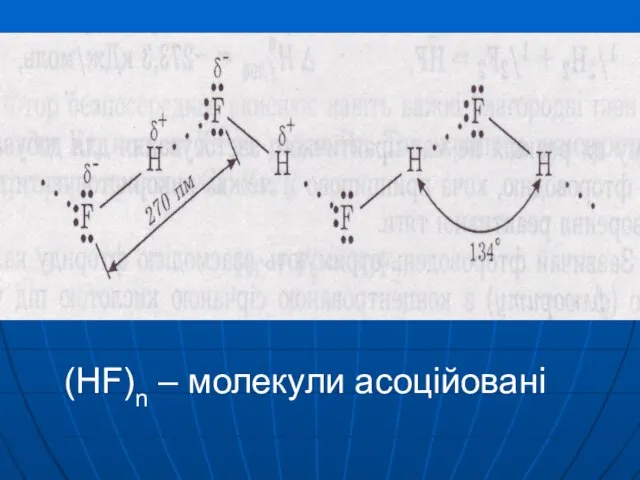
В HF

– водневий зв’зок
H-F···H-F ···
Слайд 42В водних розчинах
HF + H2O ↔ Н3O++ F- K1=7,2·10-4
HF +

F- ↔ НF2- K2=5,1
В розчинах плавикої кислоти йонів НF2- найбільше
Відомі кислі солі KHF2 (KF·HF), KH2F3 (KF·2HF)
Слайд 43HCl HBr HJ
сила кислот
сильні одноосновні кислоти
НГ → Н+ + Г-
Радіус

атома галогену збільшується, збільшується довжина зв'язку,
зменшується Езв’язку,
збільшується здатність зв'язку до поляризації і під дією H2O зв’язки легше розриваються
Слайд 46 HCl HBr HJ
Cl- Br- J-
1,36 1,06 0,54
відновні властивості
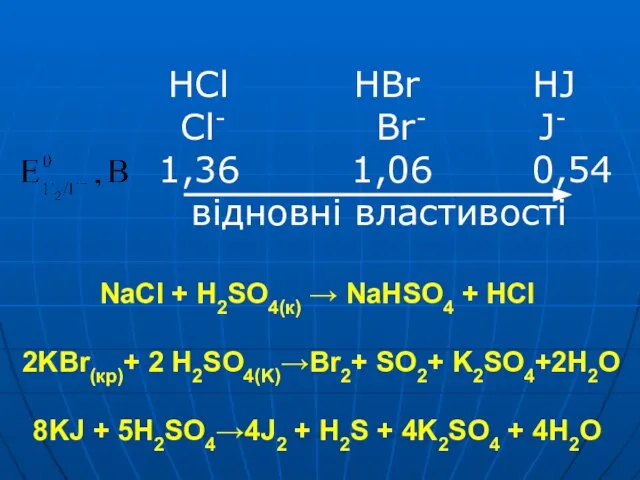
NaCl + H2SO4(к) → NaHSO4 + HCl 2KBr(кp)+ 2 H2SO4(K)→Br2+ SO2+ K2SO4+2H2O
8KJ + 5H2SO4→4J2 + H2S + 4K2SO4 + 4H2O
Слайд 47Якісні реакції на галогенід-йони
Ag+ + Cl- → AgCl↓


![Na3[AlF6] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю вичерпані](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/366279/slide-5.jpg)




































 Прекрасный праздник Новый Год
Прекрасный праздник Новый Год З
З ФОНДЫ И МЕЖДУНАРОДНЫЕ ОРГАНИЗАЦИИ, ПРОЕКТЫ И ПРОГРАММЫ
ФОНДЫ И МЕЖДУНАРОДНЫЕ ОРГАНИЗАЦИИ, ПРОЕКТЫ И ПРОГРАММЫ Тема: СЛОВООБРАЗОВАНИЕ
Тема: СЛОВООБРАЗОВАНИЕ ОБУЧЕНИЕ ДЕТЕЙ ПРАВИЛЬНОЙ РЕЧИ
ОБУЧЕНИЕ ДЕТЕЙ ПРАВИЛЬНОЙ РЕЧИ Как снять уникальный видеоролик. Советы по подготовке к съёмке
Как снять уникальный видеоролик. Советы по подготовке к съёмке 1. Зображення України в картографічних творах. Елементи карти, картографічні проекції та види спотворень на географічних картах(1)
1. Зображення України в картографічних творах. Елементи карти, картографічні проекції та види спотворень на географічних картах(1) Путешествие по Полоцку с Алесем
Путешествие по Полоцку с Алесем Что такое биоинформатика
Что такое биоинформатика Древние соборы. 4 класс
Древние соборы. 4 класс Museums
Museums Знаки ухода за одеждой
Знаки ухода за одеждой Любовная лирика А. С. Пушкина. Адресаты лирики А. С. Пушкина
Любовная лирика А. С. Пушкина. Адресаты лирики А. С. Пушкина Дискретные и непрерывные сигналы
Дискретные и непрерывные сигналы Краткосрочная программа Экообъектив. Водная гладь
Краткосрочная программа Экообъектив. Водная гладь Педсовет “Современный урок- как основа эффективного и качественного образования»
Педсовет “Современный урок- как основа эффективного и качественного образования» Роль имения Спасское-Лутовиново в жизни и творчестве И.С. Тургенева
Роль имения Спасское-Лутовиново в жизни и творчестве И.С. Тургенева Обратная матрица
Обратная матрица Презентация на тему Перспективные направления развития современных технологий (10 класс)
Презентация на тему Перспективные направления развития современных технологий (10 класс) Япония Площадь страны 372 тыс. км Население страны 127,8 млн.чел. Форма правления - конституционная монархия Форма территориального ус
Япония Площадь страны 372 тыс. км Население страны 127,8 млн.чел. Форма правления - конституционная монархия Форма территориального ус Modul_F2_Zintegrowana_komunikacja_marketingowa
Modul_F2_Zintegrowana_komunikacja_marketingowa Передача информации (технические системы)
Передача информации (технические системы) Аттестационная работа. Запись числа. Системы счисления
Аттестационная работа. Запись числа. Системы счисления Обществознание. Подготовка к олимпиаде. Часть 3 (11-15 темы)
Обществознание. Подготовка к олимпиаде. Часть 3 (11-15 темы) Американский английский: новые тенденции
Американский английский: новые тенденции Презентация на тему Самоиндукция
Презентация на тему Самоиндукция  Презентация по предмету гражданская оборона студента 1 курса Института Менеджмента Информационных систем Группы 3311 Берга Святосл
Презентация по предмету гражданская оборона студента 1 курса Института Менеджмента Информационных систем Группы 3311 Берга Святосл Преподаватель
Преподаватель