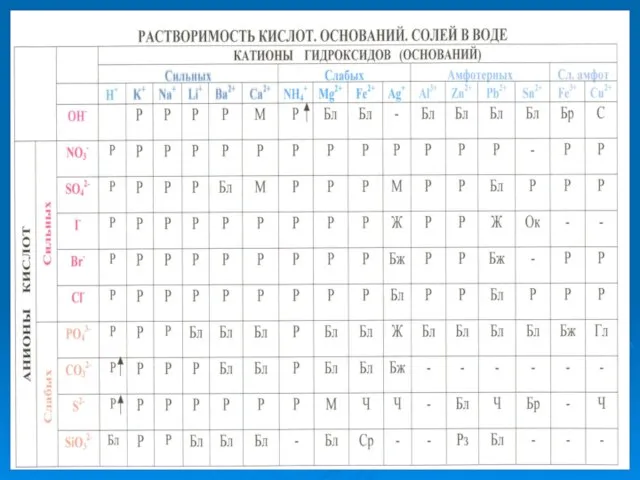
Содержание
- 3. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- 4. Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия
- 5. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
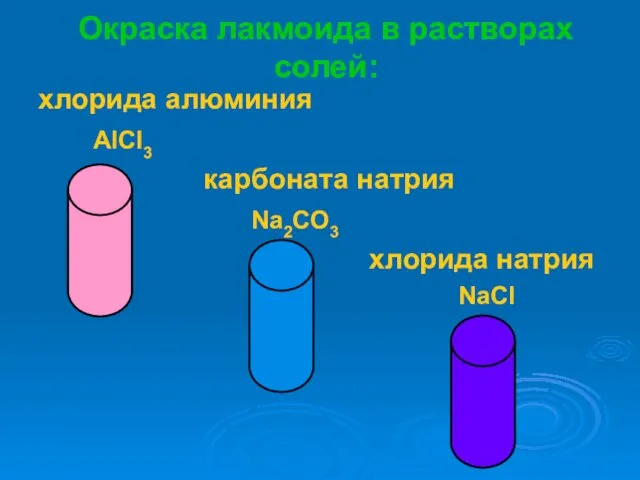
- 6. Окраска лакмоида в растворах солей: хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl
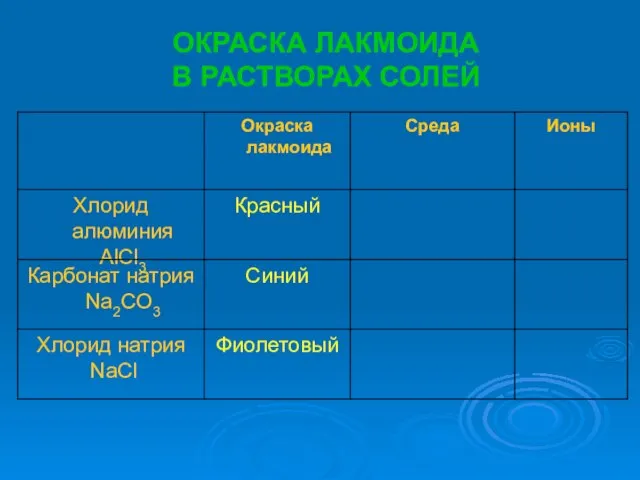
- 7. ОКРАСКА ЛАКМОИДА В РАСТВОРАХ СОЛЕЙ
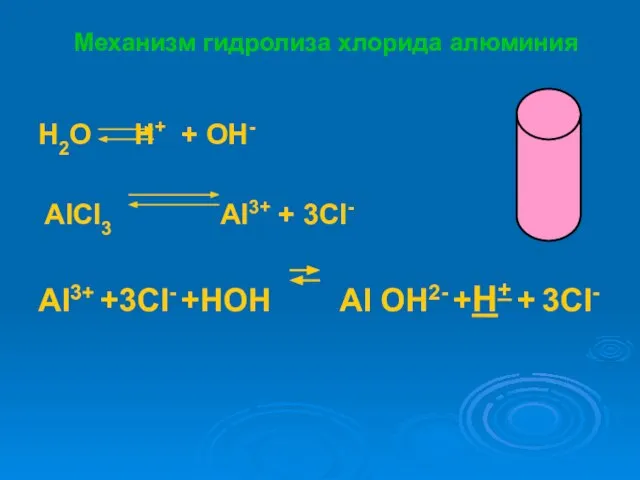
- 8. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
- 9. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
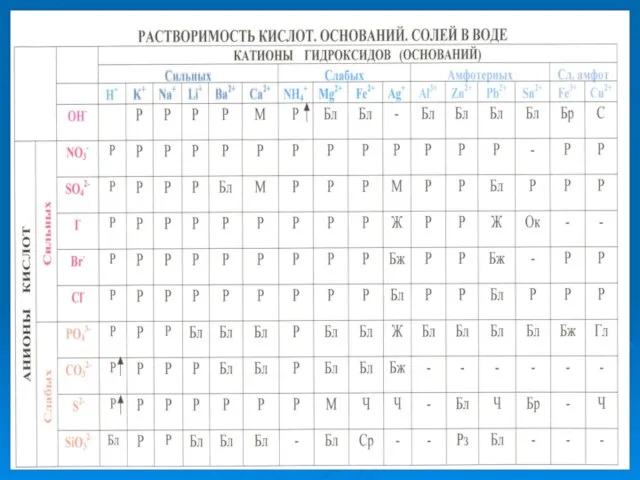
- 10. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
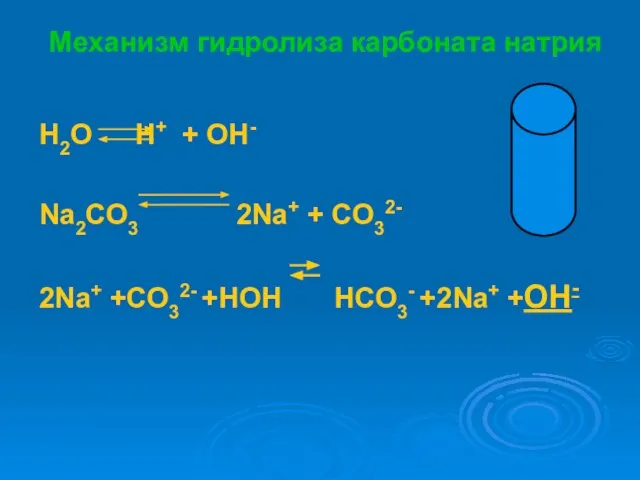
- 12. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
- 13. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
- 14. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 15. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
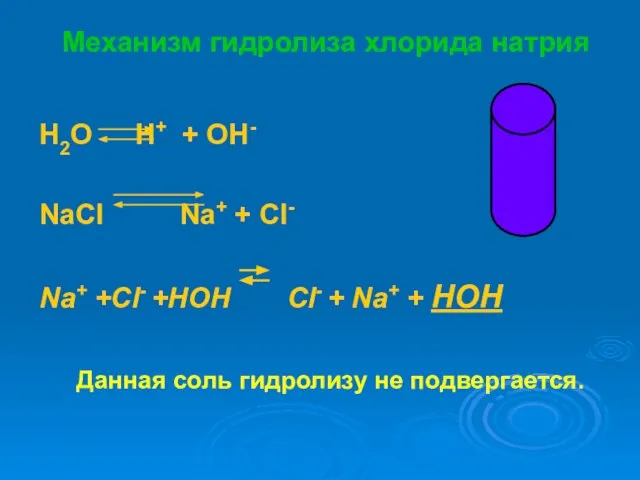
- 16. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
- 17. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
- 18. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
- 19. Сформулируем определение понятия «гидролиз»: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют?
- 20. ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
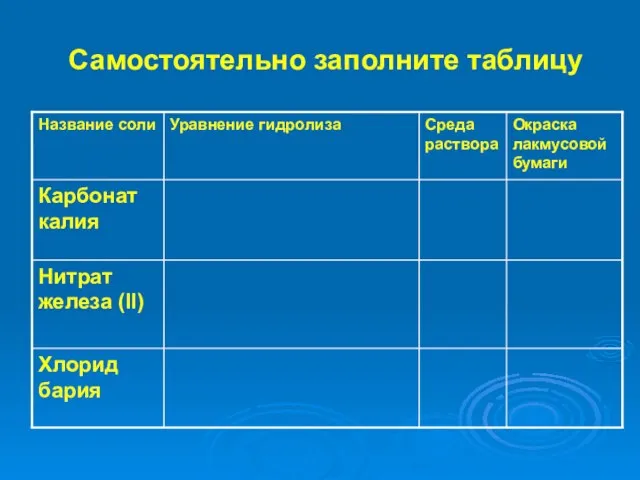
- 22. Самостоятельно заполните таблицу
- 23. Самостоятельно заполните таблицу
- 24. Роль гидролиза в природе Преобразование земной коры Обеспечение слабощелочной среды морской воды
- 25. Роль гидролиза в народном хозяйстве Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло,
- 26. Роль гидролиза в повседневной жизни человека Стирка Мытье посуды Умывание с мылом Процессы пищеварения
- 27. Ключ к оценке качества выполнения теста: Верные ответы: 1 вариант: 1а, 2б, 3а, S2- + HOH
- 28. Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия
- 30. Скачать презентацию



![Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/441220/slide-8.jpg)


![Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/441220/slide-12.jpg)


![Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/441220/slide-16.jpg)









 Александра Лежнина
Александра Лежнина PEMPAL TCOP Группа лидеров – Видеоконференция 23 апреля 2009 г.Презентация результатов ОСФО Республика Таджикистан
PEMPAL TCOP Группа лидеров – Видеоконференция 23 апреля 2009 г.Презентация результатов ОСФО Республика Таджикистан Гражданское общество
Гражданское общество От индустриального общества к информационному
От индустриального общества к информационному Современные педагогические технологии в специальном образовании детей с особенностями психофизического развития
Современные педагогические технологии в специальном образовании детей с особенностями психофизического развития Пирамида Хеопса 146 метров
Пирамида Хеопса 146 метров Animal's world
Animal's world Внешняя политика Советского государства 1920-х
Внешняя политика Советского государства 1920-х Религиозная культура, этика, культурнопросветительская и добровольческая деятельность в школе
Религиозная культура, этика, культурнопросветительская и добровольческая деятельность в школе עמודי חיפוש ותוצאות
עמודי חיפוש ותוצאות ДИСЛАЛИЯ
ДИСЛАЛИЯ 2_Л_Техники_и_этапы_в_академическом_рисунке
2_Л_Техники_и_этапы_в_академическом_рисунке Футбольные фанаты
Футбольные фанаты ТАЙНЫ ВОДЫ
ТАЙНЫ ВОДЫ Презентация на тему Жизнь и творчество Владимира Высоцкого
Презентация на тему Жизнь и творчество Владимира Высоцкого Современные проблемы профильного обучения в сельской школе.
Современные проблемы профильного обучения в сельской школе. Презентация на тему Первая помощь при остановке сердца
Презентация на тему Первая помощь при остановке сердца Презентация_готова
Презентация_готова Риск-менеджмент в лизинговой компании Система управления кредитным риском
Риск-менеджмент в лизинговой компании Система управления кредитным риском Инженерная и компьютерная графика. Комбинированная поверхность
Инженерная и компьютерная графика. Комбинированная поверхность Индивидуальный выбор видов спорта и систем физических упражнений
Индивидуальный выбор видов спорта и систем физических упражнений 10 кл Урок 8
10 кл Урок 8 Час общения «Времена года»
Час общения «Времена года» История счёта
История счёта Бал в честь женитьбы Карла IV (Безумного) и Изабеллы Баварской
Бал в честь женитьбы Карла IV (Безумного) и Изабеллы Баварской Фармацевтические кластеры – мост через «долину смерти» для инновационных разработок
Фармацевтические кластеры – мост через «долину смерти» для инновационных разработок Отражение и преломление света
Отражение и преломление света СЕМИНАР О ПРЕДОСТАВЛЕНИИ СОЦИАЛЬНО-ЗНАЧИМЫХ ГОСУДАРСТВЕННЫХ УСЛУГ С 1 МАРТА 2012 ГОДА
СЕМИНАР О ПРЕДОСТАВЛЕНИИ СОЦИАЛЬНО-ЗНАЧИМЫХ ГОСУДАРСТВЕННЫХ УСЛУГ С 1 МАРТА 2012 ГОДА