Содержание
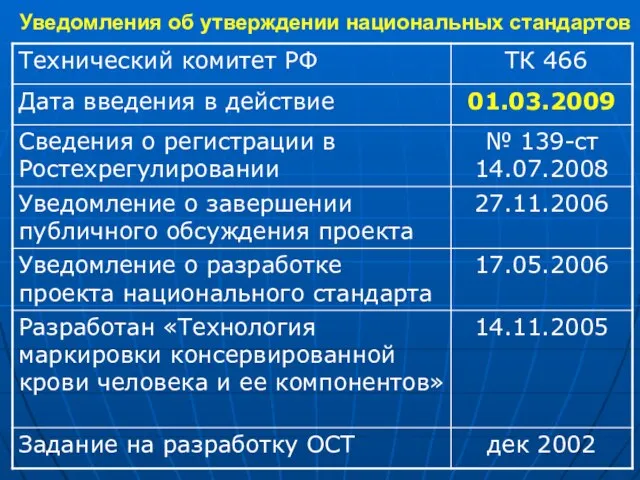
- 2. Уведомления об утверждении национальных стандартов
- 3. WWW.GOST.RU
- 4. Официальные издания стандартов можно заказать в территориальных отделах ФГУП "СТАНДАРТИНФОРМ» (магазинах стандартов) по следующим адресам: Территориальный
- 5. Основные объекты Маркировка Технология Этикетки Время, место, правила изготовления и наклейки этикеток Информационное наполнение, формат и
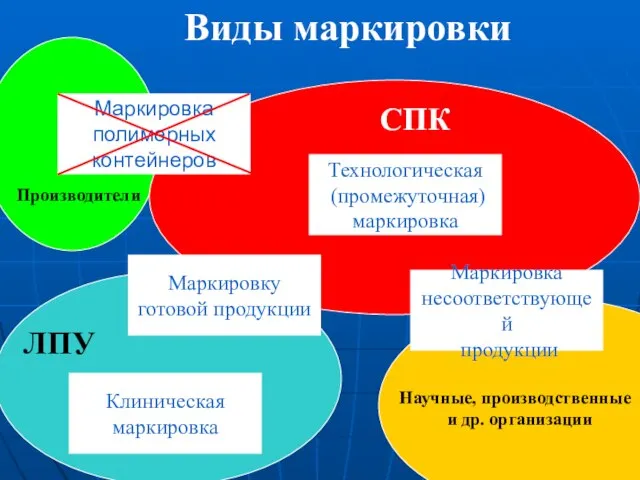
- 6. Виды маркировки Технологическая (промежуточная) маркировка Маркировку готовой продукции Маркировка несоответствующей продукции Клиническая маркировка Маркировка полимерных контейнеров
- 7. Технологическая (промежуточная) маркировка Технологическую маркировку применяют для обеспечения технологических процессов внутри организации Процедуры и требования к
- 8. Образцы технологических наклеек
- 9. Формат этикеток Более 30 информационных объектов
- 10. Формат этикеток АB(IV)Rh- Rh отрицательная C-c+E-e+ K- ГОСТ Р 52938-2008
- 11. Этикетки несоответствующей продукции Этикетки несоответствующей продукции B(III)Rh+ Rh положительная
- 12. Клиническая маркировка B(III)Rh+ Rh отрицательная C+ c- E+ e+ K- Может передать инфекционные агенты С+с-E+ e-
- 13. Клиническая составляющая Этикетка совместимости № компонента крови Браслет реципиента
- 14. Наиболее важные положения стандарта Ориентация на компьютерную маркировку и штрихкоды Разделение на технологическую маркировку и маркировку
- 15. Как действует национальный стандарт ?????????? Закон декларирует принцип добровольности в отношении национальных стандартов
- 16. Как действует национальный стандарт Закон «О техническом регулировании» (N 184-ФЗ от 27 декабря 2002 года) п.9
- 17. Технический регламент (проект) О требованиях к безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых
- 18. 44. Каждая доза (единица) крови и ее компонентов, предназначенная для отпуска из организации донорства крови и
- 19. Единое информационное пространство в трансфузиологии (доклад 13.12.2007 ) С тех пор произошло «чудо»: Постановление Правительства России
- 20. Неразрешимое противоречие На всех уровнях широко декларируется важность внедрения информационных технологий Некоторые процессы (напр. карантинизацию) невозможно
- 21. ПРИКАЗ 7 августа 1985 г. N 1055 ПРИКАЗ 12 апреля 1990 г. N 155 ПРИКАЗ 14
- 23. Скачать презентацию


















 Физический и канальный уровень
Физический и канальный уровень  Криминальный сленг
Криминальный сленг Проект ФКЗ «О созыве Конституционного Собрания Российской Федерации»
Проект ФКЗ «О созыве Конституционного Собрания Российской Федерации» Правила по русскому языку
Правила по русскому языку Газпромбанк - военные праздники. Шаблон оперативной графики. Стилфреймы
Газпромбанк - военные праздники. Шаблон оперативной графики. Стилфреймы Божественная пропорция
Божественная пропорция Magazines in our life
Magazines in our life Презентация на тему Культура первобытного общества
Презентация на тему Культура первобытного общества  Основы технических приёмов нападения и защиты в волейболе
Основы технических приёмов нападения и защиты в волейболе Инклюзивные танцы как одна из форм волонтерской деятельности в образовательной организации
Инклюзивные танцы как одна из форм волонтерской деятельности в образовательной организации Презентация на тему Киевское княжество
Презентация на тему Киевское княжество  История Олимпийских игр
История Олимпийских игр Сыновья Зевса
Сыновья Зевса 16 декабря 1941 года День освобождения Калинина
16 декабря 1941 года День освобождения Калинина Презентация на тему Путешествие в Страну Пословиц
Презентация на тему Путешествие в Страну Пословиц  Фоносемантический анализ предложения
Фоносемантический анализ предложения Презентация на тему Планируемые результаты освоение НОО
Презентация на тему Планируемые результаты освоение НОО Русская культура в 10 веке
Русская культура в 10 веке ФИНАНСОВЫЕ ИНСТРУМЕНТЫ
ФИНАНСОВЫЕ ИНСТРУМЕНТЫ Типы организации хозяйственных систем. Товар и деньги.
Типы организации хозяйственных систем. Товар и деньги. Охрана природы
Охрана природы Свобода воли, нейронаука, пришельцы и роботы
Свобода воли, нейронаука, пришельцы и роботы Презентация на тему Короткое замыкание
Презентация на тему Короткое замыкание Презентация на тему Неопределенная форма глагола (3 класс)
Презентация на тему Неопределенная форма глагола (3 класс) Молодцы!
Молодцы! УСОТиТС от 05 10 2022
УСОТиТС от 05 10 2022 ООО «Бизнес-фактор»
ООО «Бизнес-фактор» Бюджетная услуга: классификация и стандарты качества
Бюджетная услуга: классификация и стандарты качества