Слайд 2- 1888 г. – П. Баумгартен, Г. Нуталь установили в сыворотке крови

черепах «неизвестные начала», которые губят миллионы смертельных доз введенных в кровь сибиреязвенных бацилл
- 1890 г. – Р. Кох предложил туберкулин (фильтрат из убитых МБТ) для диагностики скрытых форм туберкулеза.
«Когда ни медицинский осмотр, ни наличие бацилл не могут дать никаких указаний».
Слайд 3- 1891-1896 г. – Э. Беринг и Ш. Китасато, Ру и Йерсен,

Г.Н. Габричевский и др. доказали, что решающую роль в инфекционном иммунитете играет сыворотка крови, а не фагоциты.
- 1894 -1899 г. – А. Кальмет, Л. Дойч; Ф.И. Чистович и др. ввели термины антиген и антитело
- 1898 г. – П. Эрлих. Рецепторная теория иммунитета
Слайд 4- 1907 г. - К.Ф. Пирке предложил использовать термин туберкулинодиагностика и широко

использовать этот метод для выявления заражения и заболевания туберкулезом. Предложил метод туберкулинодиагностики в виде накожной пробы.
- 1909 г. Mantoux предложил внутрикожный метод введения туберкулина
1910 г. К.Ф. Пирке ввел понятие аллергия
- 1928 г. – Н.Ф. Гамалея. Иммунитет; теория отпечатков.
Слайд 5- 1931–1937–1940 г.г. Ф. Брейнль, Ф. Горовиц, Л. Паулинг. Разработали инструктивную теорию

иммунитета.
Различие между нормальной молекулой гаммаглобулина и молекулой антителом состоит не в расположении аминокислот, а в способе закручивания цепей из аминокислот. Антиген «инструктирует» (изменяет) гаммаглобулин. Каждый антиген вызывает свой способ закручивания и таким образом достигается специфичность антител.
- 1953 г. – Биллингем. Открытие «явления иммунологической толерантности (терпимости)».
Слайд 6 Антиген вводился в организм животного в эмбриональной стадии развития. Тот же

антиген введенный повторно взрослому животному не вызывал формирования антител. Это явление открыло гигантские перспективы для последующего развития иммунологии.
- 1959 – 1964 г.г. М. Ф. Барнет, используя выше названное открытие, разработал теорию «клонального отбора».
В эмбриональной стадии развития и собственные ткани организма и чужеродные антигены способны в равной степени стимулировать выработку антител.
Слайд 7 У эмбриона имеются два вида иммунокомпетентных клеток:
1. Клетки (self), способные

вступать во взаимодействие с собственными антигенами
2. Клетки (non self), способные вступать во взаимодействие с чужими антигенами.
У эмбриона клетки первого типа, объединившиеся с собственными антигенами, теряют способность к размножению и будут отсутствовать у взрослой особи.
Слайд 8 Клетки второго типа, вступившие в контакт с чужеродными антигенами так же

не будут размножаться и организм после рождения не будет реагировать на этот антиген.
Клетки второго типа, не вступившие в контакт с чужеродными антигенами, будут размножаться и после рождения, организм будет обладать только иммунокомпетентными клетками, которые не имели связи с антигенами в эмбриональной стадии.
Слайд 9 Иммунитет
Иммунитет – способ защиты от живых тел и веществ, несущих на

себе признаки генетической чужеродной информации (Р.В. Петров, 1976).
Все возможные реакции иммунитета укладываются в пять основных его феноменов:
1. Гуморальный иммунитет (антителообразование)
2. Клеточный иммунитет (повышенная чувствительность замедленного типа);
3. Толерантность;
4. Иммунологическая память;
5. Аллергия.
Два последних феномена являются производными первых двух.
Слайд 10Основным признаком всех реакций иммунитета является специфичность, заключающаяся в том, что клетки

и антитела реагируют значительно более активно (если не исключительно) с тем антигеном, которым они индуцированы к пролиферации и синтезу.
Существует еще целый ряд других реакций (неспецифический иммунитет), которые также имеют защитный характер и служат для поддержания гомеостаза.
К ним относятся: фагоцитоз, алексин (комплемент), лизоцим, лейцины, бетализин, пропердин, бактерицидин, эритрин, экмолин, интерферон и др.
Их защитные эффекты неспецифические и не являются реакциями иммунитета.
Слайд 11Все многообразие проявлений иммунитета базируется на двух основных способах иммунного ответа: гуморального

и клеточного типа.
Гуморальные реакции – синтез антител – развиваются на введение любых полноценных антигенов, как естественных, так и синтетических. Они играют защитную роль при многих инфекциях и повреждающую роль при многих аутоиммунных и аллергических заболеваниях.
Слайд 12Клеточные реакции – непосредственная атака чужеродных веществ макрофагами, иммунными лимфоцитами (или синтезируемыми

ими медиаторами) играют ведущую роль при других инфекциях, возбудители которых имеют несовершенные(?) растительно-животные антигены (туберкулез, лепра, бруцеллез, листереллез, сальмонеллезы, токсоплазмоз), а также в отторжении трансплантата, в противоопухолевом иммунитете.
Слайд 13Эффекторными клетками гуморального иммунитета являются В-лимфоциты, при клеточном иммунитете – Т-лимфоциты.
Все остальные

иммунологические феномены являются производными клеточного и гуморального иммунитета. В частности:
Толерантность (терпимость) является результатом элиминации (исчезновения) некоторых типов иммунокомпетентных клеток или результатом стимуляции субпопуляций Т- или В- лимфоцитов
Слайд 14Иммунологическая память – усиленный иммунный ответ при повторном контакте с антигеном, обусловлена

сохранением в поколениях В- и Т- лимфоцитов памяти о генетической структуре антигена.
Аллергия – специфический иммунный ответ с неспецифическим конечным эффектом. Антитела или эффекторные элементы клеточного иммунитета, реагируя на повторное введение антигена (иммунологическая память), вследствие сродства с тучными клетками, неспецифически с ними взаимодействуют и вызывают каскад стандартных патофизиологических последствий.
Слайд 15Каким же образом указанные феномены иммунитета принимают участие в патогенезе туберкулеза?
Гуморальный иммунитет

при туберкулезе.
После введения вакцины БЦЖ титры антител (19S, 7S) нарастают и достигают максимума соответственно нарастанию устойчивости вакцинированных животных к последующему заражению (М.М. Авербах и др. 1970). На фоне лечения экспериментального туберкулеза отмечается усиление синтеза антител (И.Н.Ильина, 1972).
Антитела имеют неодинаковую динамику при туберкулезной инфекции.
Антитела, направленные против полисахаридной фракции микобактерий, в наибольших титрах определяются при благоприятном течении туберкулеза.
Слайд 16Антипротеиновые антитела в максимальных титрах обнаруживаются при прогрессировании туберкулеза (Takahashy,1969; Н.В. Гогебашвили,

1970;).
Нарастание активности синтеза цитофильных антител совпадает с интенсивностью развития клеточного иммунитета.
С помощью макрофагов, нагруженных такими антителами, удалось перенести интактным животным клеточный иммунитет.
Несколько наблюдений указывают на то, что иммунные сыворотки замедляют размножение микобактерий в макрофагах или защищают макрофаги от некротизирующего воздействия микобактерий.
Слайд 17На сегодняшний день исследователи считают, что изучение динамики циркулирующих антител не дает

полного ответа на вопрос: какое значение имеют антитела в сопротивляемости к туберкулезу?
Большинство исследователей считают, что синтез антител отражает напряженность резистентности к туберкулезу, но не лежит в основе борьбы с микобактериями.
Слайд 18Однако надо полагать, что едва ли столь совершенная реакция как антителообразование запускается

впустую.
Клеточный иммунитет.
Реакция клеточного иммунитета заключается во взаимодействии Т-лимфоцитов с антигеном, с макрофагами с последующей мобилизацией (с помощью медиаторов) другой популяции Т-лимфоцитов или макрофагов, выполняющих эффекторную функцию.
Слайд 19Такие взаимодействия имеют место при всех реакциях клеточного иммунитета, будь то туберкулиновая

проба, фагоцитоз, атака иммунными лимфоцитами трансплантата или опухоли.
В последнее десятилетие была детально уточнена последовательность событий происходящих в процессе формирования клеточного иммунитета при туберкулезе.
В местах фиксации МБТ возникает неспецифическая защитная реакция – фагоцитоз.
Первыми участниками этой реакции являются нейтрофилы. Их фагоцитарное бактерицидное воздействие оказывается недостаточным и они гибнут под влиянием бактериальных токсинов.
Слайд 20В результате разрушения нейтрофилов в тканях накапливается активная ферментативная среда, вызывающая оксидативный

стресс, ведущий к возникновению неспецифического воспалительного процесса.
Вслед за нейтрофилами в зону неспецифического воспаления устремляются и мононуклеарные лейкоциты (моноциты, лимфоциты).
Слайд 21При первом контакте МБТ и макрофага уничтожения бактерий не происходит в связи

с тем, что макрофаг не «знаком» с генетической структурой МБТ. Лизосомальные ферменты макрофага не могут сами активироваться. В таких условиях МБТ продолжают размножаться внутри макрофага и разносятся макрофагами по всему организму.
Бактерии, захваченные макрофагом, оказывают повреждающее воздействие на лизосомы макрофага своими токсическими продуктами (корд фактор, сульфатиды, АТФ положительные протоны) и макрофаг погибает.
Слайд 22Такое неспецифическое взаимодействие называется незавершенным фагоцитозом.
Чтобы фагоцитоз стал завершенным макроорганизму необходимо задействовать

иммунологические механизмы в виде клеточного иммунитета.
Основу приобретенного клеточного иммунитета составляет взаимодействие макрофагов и лимфоцитов (СD4 и CD8).
Слайд 23Макрофаги, поглотившие МБТ, выделяют на свою поверхность антигены микобактерий в виде пептидов.

Одновременно они выделяют в межклеточное пространство ИЛ-1 и, вероятно, другие медиаторы для активизации Т-лимфоцитов.
CD4 и CD8, воспринимая от макрофагов информацию о генетической структуре МБТ, активизируются и начинают выделять, в свою очередь, медиаторы (лимфокины, хематаксины, гамма-интерферон, ИЛ-2).
Слайд 24Эти медиаторы повышают ферментативную и бактерицидную активность макрофагов.
В сенсибилизированных макрофагах резко увеличивается

выработка лизосомальных ферментов со специфической активностью против полисахаридов и протеинов МБТ. Генерируются активные кислородные радикалы и перекись водорода, которые за счет «кислородного взрыва» воздействуют на структурные элементы МБТ.
Слайд 25Под влиянием всех этих факторов способность МБТ препятствовать образованию фаголизосомы ослабевает и

макрофаги приобретают способность переваривать туберкулезные бациллы. Фагоцитоз становится завершенным.
При адекватном развитии иммунного ответа последующие поколения макрофагов становятся все более иммунокомпетентными. Высокий бактерицидный потенциал активированных макрофагов обеспечивает возможность уничтожения всей или почти всей популяции микобактерий.
Слайд 26При адекватном развитии иммунного ответа имеют место три фазы эффективного фагоцитоза.
1. Макрофаги

приближаются к МБТ и фиксируют их на своей оболочке.
2. Затем участок клеточной оболочки с МБТ погружается внутрь макрофага и образуется фагосома.
3. При слиянии фагосомы с лизосомальными ферментами активированного макрофага образуется фаголизосома. При этом происходит разрушение МБТ.
Слайд 27Интенсивность клеточного иммунитета зависит от состояния естественного иммунитета. При его ослаблении ослабевает

активность макрофагов и Т-лимфоцитов. Фагоцитоз остается незавершенным. На этом фоне туберкулез может прогрессировать (М.И. Перельман и др., 2004 г.).
При усилении естественной защищенности усиливается и инфекционный иммунитет, фагоцитоз становится завершенным.
Слайд 28Выделяемые макрофагами медиаторы активируют и В-лимфоциты, ответственные за синтез иммуноглобулинов. Их полезная

роль отражена выше. Кроме того антитела, формирующиеся к полисахаридным комплексам, выполняют роль опсонирующих антител. Эти антитела обволакивают микобактерии, способствуя их склеиванию и фагоцитозу (М.И. Перельман и др., 2004 г.). Формирование антител к протеинам является признаком подавления клеточного иммунитета.
Повышенная чувствительность замедленного типа (ПЧЗТ).
Неспецифическая и специфическая фазы фагоцитоза сопровождаются синтезом активных химических соединений (фактор роста, фактор переноса, кожно-реактивный фактор, ФНО-a, оксид азота и др.) вызывающих повышение сосудистой проницаемости и развитие воспалительной реакции.
Слайд 29
С действием этих веществ связывают появление у клеток ПЧЗТ, но механизм этого

явления еще недостаточно раскрыт.
Большинство исследователей считают, что ПЧЗТ является проявлением клеточного иммунитета, но не аллергии.
Доказательством тому служат исследования (М.М.Авербах и др., 1974 г.), в которых доказана прямая зависимость уровня ПЧЗТ от уровня клеточного иммунитета.
Слайд 30 Аллергия при туберкулезе.
Немногочисленные исследования показали, что антитела IgE не играют существенной

роли в патогенезе туберкулеза.
Субстратом реакции ПЧЗТ является тот же набор иммунокомпетентных клеток, которые участвуют в реакции клеточного иммунитета.
Поэтому ПЧЗТ уже более тридцати лет рассматривают одним из проявлений клеточного иммунитета.
Слайд 31Однако, несомненно и то, что реакция ПЧЗТ протекает несколько иначе, чем реакция

клеточного иммунитета.
Она развивается быстрее чем клеточный иммунитет и быстрее угасает, не оставляет после себя никаких изменений.
М.М. Авербах (1981) считает, что субстрат ПЧЗТ еще не известен. Таким субстратом могут быть еще неизвестные гуморальные факторы или медиаторы Т-лимфоцитов, которые, возможно, вызывают кожные реакции и иногда появление некротического компонента при введении туберкулина.
Слайд 32
Место аллергии в иммунных реакциях
Иммунитет
↓ ↓
Гуморальный Клеточный
↓ ↓
Реакция

→ Аллергия ← Реакция
немедленного замедленного
типа типа
Слайд 33Туберкулез и иммунологическая толерантность
В ряде экспериментальных исследований установлено, что посредством внутриутробного

введения туберкулина или убитых микобактерий можно подавить у особи способность в последующем к развитию клеточного и гуморального иммунитета в ответ на заражение туберкулезными бациллами (Janicki, 1990).
Предварительное введение мышам вакцинного антигена и циклофосфана индуцировало неспособность к развитию клеточного иммунитета.
У толерантных животных туберкулиновые пробы были отрицательными.
На фоне вызванной толерантности вакцинация БЦЖ оказывается неэффективной (А.Н.Марков,1978).
Слайд 34 Эти исследования свидетельствуют, что толерантность может играть отрицательную роль в патогенезе

туберкулеза.
- У детей с подавленной иммунокомпетентной системой вакцинация может вызвать толерантность вместо развития иммунитета (противопоказания).
- Еще существеннее в патогенезе туберкулеза роль иммунологического отклонения, когда гиперпродукция антител ингибирует клеточный иммунитет и снижает защитный потенциал организма.
Слайд 35 Туберкулез и иммунологическая память
Иммунитет при туберкулезе нестерильный. Исходя из этого,

обсуждение данной проблемы не имело бы смысла. Но есть один момент, указывающий на наличие феномена иммунологической памяти при туберкулезе.
Хорошо известно, что после вакцинации в эксперименте и клинике повышенная сопротивляемость к туберкулезу и туберкулиновая чувствительность кожи держатся значительно дольше, чем в организме обнаруживаются микобактерии БЦЖ.
Слайд 36 Лечение изониазидом и рифампицином животных, вакцинированных БЦЖ, приводит к элиминации микобактерий

БЦЖ, но не оказывает влияния на клеточный иммунитет (Lefford, 1976).
Следовательно, иммунологическая память при туберкулезе зависит не только от персистирования живых микобактерий (М.М. Авербах, 1981).
Слайд 37
Методы изучения клеточного иммунитета
при туберкулезе.
- Реакция бласттрансформации

с туберкулином
- Реакция торможения миграции с туберкулином
Методы изучения гуморального
иммунитета при туберкулезе.
- Реакция агрегатагглюцинации с туберкулином
- Реакция потребления комплемента
-Определение иммунных розеткообразующих лимфоцитов.
Из методов изучения иммунитета и специфической сенсибилизации самое широкое применение получила туберкулинодиагностика.
Слайд 38Туберкулинодиагностика.
Метод выявления с помощью туберкулиновых проб иммунитета и специфической сенсибилизации организма,

обусловленной инфицированием МБТ или введением вакцины БЦЖ.
Старый туберкулин Коха представляет собой фильтрат 6-9 недельной культуры МБТ человеческого и бычьего типа, выращенных на мясо пептоном бульоне, стерилизованным текучим паром в течение 1 ч., сгущенный до 1/10 первоначального объема при температуре 90ºС.
Слайд 39Действующим началом туберкулина является туберкулопротеин. Входят и полисахариды, липиды, нуклеиновые кислоты. Примеси

– белки питательной среды.
Более специфическими препаратами являются PPD-S (1934 г) и ППД-Л (1939 г.).
Международный стандарт (1ТЕ)– 0,00002 г. PPD-S.
В РБ стандартом является (1ТЕ)– 0,00006 г. ППД-Л
В настоящее время используется туберкулин активностью 2 ТЕ в 0,1 мл раствора с добавлением стабилизатора твин-80(0,005%) и консерванта 0,01% хинозола. Выпускается в ампулах по 3 мл.
Слайд 40Туберкулин способен вызывать ответную реакцию только у людей предварительно сенсибилизированных МБТ или

вакциной БЦЖ.
У этих лиц на месте внутрикожного введения развивается специфическая реакция ПЧЗТ в виде инфильтрата.
Патоморфологически инфильтрат характеризуется отеком всех слоев кожи с мононуклеарной и макрофагальной реакцией.
Слайд 41
Широкое применение получили две пробы из многих:
внутрикожная проба Mantoux (1909)
и

Подкожная проба Коха (1890).
Слайд 42Туберкулинодиагностика подразделяется на массовую и индивидуальную.
Цели массовой туберкулинодиагностики:
1. Выявление групп повышенного

риска заболевания туберкулезом, к которым относятся дети и подростки:
- первично инфицированные МБТ (вираж);
- с гиперэргическими реакциями на туберкулин;
- с увеличением инфильтрата на 6 мм и более в течение года.
2. Отбор лиц для ревакцинации БЦЖ.
3. Ранняя диагностика заболевания туберкулезом у детей и подростков.
4 Определение инфицированности МБТ населения и ежегодного риска инфицирования МБТ.
Оценка реакции на пробу Манту.
Выявление групп повышенного риска.
Среди детей из групп риска чаще выявляются больные туберкулезом.
Слайд 43Группы риска выявляют среди детей с положительными реакциями на туберкулин, которые обусловлены

внедрением в организм вирулентных МБТ. Но в условиях массовой вакцинации следует исключить лиц с поствакцинальным иммунитетом.
Врач должен установить причину положительной туберкулиновой пробы.
Вначале нужно установить наличие и размер кожного поствакцинального рубчика на левом плече. При размерах рубца 3-6 мм длительность иммунитета составляет 5-7 лет. При размерах менее 3 мм поствакцинальный иммунитет нестойкий.
Слайд 44Поствакцинная реакция на туберкулин достигает максимума к году и за три пять

лет постепенно угасает. Поствакцинальная папула плоская с нечеткими контурами, бледно-розового цвета, через 1-2 недели подвергается обратному развитию, не оставляя пигментации.
Реакция на туберкулин инфицированного ребенка сопровождается либо стабилизацией чувствительности к туберкулину, либо ее усилением.
Слайд 45На заражение туберкулезом вакцинированного ребенка указывают следующие признаки:
- появление впервые положительной

реакции (>5 мм) после отрицательной или сомнительной;
- усиление предыдущей реакции (поствакцинальной) на 6 мм. и более;
- появление гиперергической реакции в любые сроки после прививки БЦЖ;
- образование папулы 12 мм и более через 3 г. после прививки БЦЖ.
Слайд 46- Инфильтрат при инфицировании хорошо очерчен, красного цвета, возвышается над кожей, пигментация

сохраняется более 2 недель.
Аллергия неясной этиологии.
Если невозможно решить аллергия поствакцинальная или инфекционная, то при отсутствии признаков активного туберкулеза ребенка ставят на учет по 0 группе. Через 3 месяца пробу Манту повторяют. Если размер папулы остается прежним или увеличивается, то аллергию считают инфекционной, при снижении чувствительности к туберкулину аллергию считают вакцинальной.
Слайд 47Определение сроков инфицирования и групп риска у привитых вакциной БЦЖ.
После проведения

дифференциальной диагностики между вакцинальной и инфекционной аллергией и выделения группы инфицированных детей следует определить у них сроки инфицирования.
- Первично инфицированные – вираж туберкулиновой пробы произошел в текущем году. Ребенок наблюдается в ПТД 1 год в YI А группе диспансерного учета. При наличии контакта или медико-социального риска детям проводится курс химиопрофилактического лечения в течение 3 мес.
Слайд 48- Инфицированные МБТ более 1 года.
1. Без гиперергии и нарастания

чувствительности к туберкулину. Они подлежат ежегодной туберкулинодиагностике.
2. С увеличением инфильтрата на 6 мм и более без гиперергии. Ребенок или подросток обследуется в ПТД. Если признан здоровым, то наблюдается в 0 группе учета.
3. С гиперергической реакцией. Это дети, у которых выявлено усиление предыдущей нормергической реакции. Наблюдать в ПТД в YI Б группе диспансерного учета. При наличии контакта или медикосоциального риска проводится превентивное лечение двумя препаратами в течение 3-6 месяцев.
Слайд 49- Инфицированные МБТ с неустановленным сроком инфицирования.
Группа учета 0. Пробу

Манту проводят повторно через 3 месяца. При отсутствии нарастания чувствительности к туберкулину передают под наблюдение участкового педиатра.
Определение срока инфицирования у непривитых
У этих детей отсутствует поствакцинальный рубчик. Первичное инфицирование устанавливается при переходе отрицательной реакции в положительную в течение текущего года.
Слайд 50Отбор лиц для ревакцинации. Проводится по результатам пробы Манту в 7 лет

(1 класс) и в 14-15 (8 класс). Ревакцинации подлежат клинически здоровые лица только с отрицательными реакциями на туберкулин. Дети, у которых после прививки БЦЖ не сформировался рубчик подлежат повторной вакцинации через год при отрицательной туберкулиновой пробе.
Определение показателя инфиципованности и ежегодного роста инфицирования МБТ. Определение этих показателей позволяет отчетливее оценить эпидемиологическую ситуацию и планировать противотуберкулезные мероприятия.
Слайд 51Показатель инфицированности – процент лиц, положительно реагирующих на туберкулин (пр. Манту с

2 ТЕ), по отношению ко всем обследованным за вычетом лиц с поствакцинальной аллергией.
Ежегодный риск инфицирования – процент лиц, подвергшихся первичному инфицированию в течение последнего года, из числа ранее не инфицированных.


















































 Изображения изделий и их обозначения при выполнении графических конструкторских документов
Изображения изделий и их обозначения при выполнении графических конструкторских документов Использование функций
Использование функций Математические задачи от русских, советских и зарубежных писателей
Математические задачи от русских, советских и зарубежных писателей Каникулы в международном детском лагере
Каникулы в международном детском лагере Язык есть исповедь народа
Язык есть исповедь народа Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных
Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных Физико-географическое районирование Северной Евразии
Физико-географическое районирование Северной Евразии  Узоры “тетёрки ” на печенье
Узоры “тетёрки ” на печенье Презентация на тему Постоянные магниты
Презентация на тему Постоянные магниты Весенний фестиваль для учащихся
Весенний фестиваль для учащихся 23 февраля. Поздравляем!
23 февраля. Поздравляем! Российский государственный университет нефти и газа имени И.М.Губкина Кафедра машин и оборудования нефтяной и газовой промышленн
Российский государственный университет нефти и газа имени И.М.Губкина Кафедра машин и оборудования нефтяной и газовой промышленн Звук и свет в лирике И. Анненского
Звук и свет в лирике И. Анненского Книжка-раскраска
Книжка-раскраска Взаимодействие научного руководителя со студентами через личный кабинет с использование сервиса Антиплагиат
Взаимодействие научного руководителя со студентами через личный кабинет с использование сервиса Антиплагиат Зачем живые организмы запасают питательные вещества?
Зачем живые организмы запасают питательные вещества? Особенности приема 2020 (колледж). Дистанционная подача документов
Особенности приема 2020 (колледж). Дистанционная подача документов Ресурсный Центр «Кристина»
Ресурсный Центр «Кристина» Проверка правильности кирпичной кладки
Проверка правильности кирпичной кладки Смешанное обучение – blended learning
Смешанное обучение – blended learning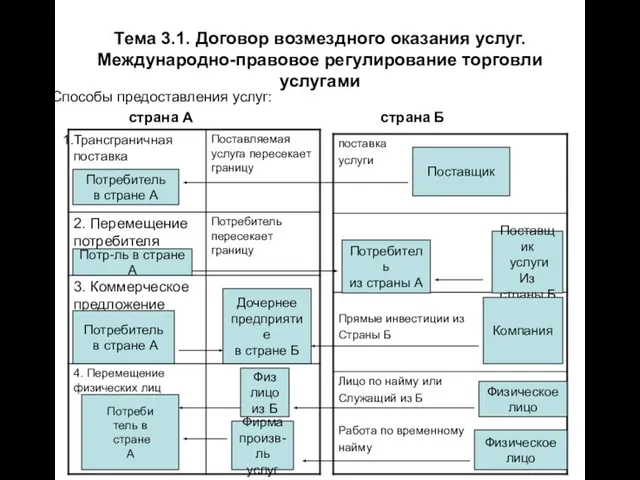 Тема 3.1. Договор возмездного оказания услуг. Международно-правовое регулирование торговли услугами Способы предоставления услуг
Тема 3.1. Договор возмездного оказания услуг. Международно-правовое регулирование торговли услугами Способы предоставления услуг Конвенция о правах ребенка
Конвенция о правах ребенка Богомолова Роза Александровна
Богомолова Роза Александровна Renault Assistance. Служба маркетинга запасных частей и послепродажного обслуживания
Renault Assistance. Служба маркетинга запасных частей и послепродажного обслуживания Принцип действия жидкокристаллических дисплеев
Принцип действия жидкокристаллических дисплеев Правила работы с обучающей презентацией
Правила работы с обучающей презентацией плакат
плакат ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития
ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития