Содержание
- 2. ПЛАН: 1. КАЛЬЦИЙ – КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ 2. НЕМНОГО ОБ ИСТОРИИ… 3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. 4.
- 3. В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь
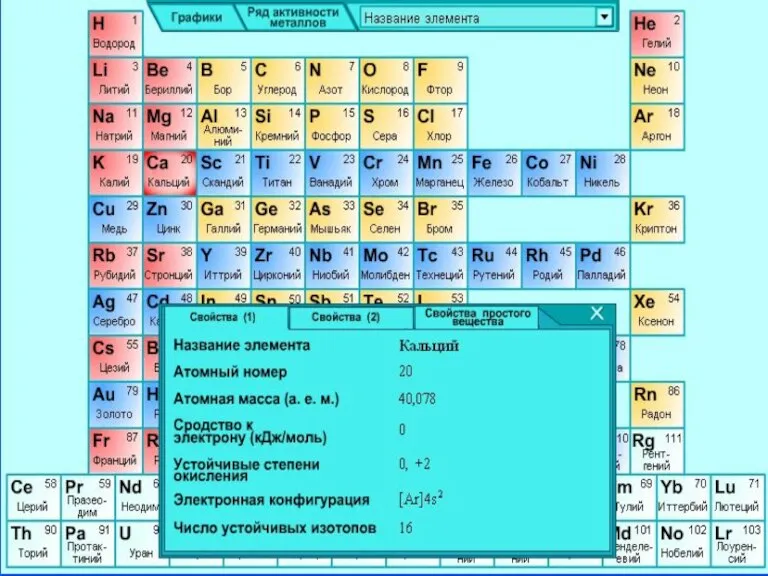
- 4. Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее
- 6. Вильгельм Бунзен Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством электролиза кальций, марганец, магний
- 7. В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого
- 8. Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится
- 9. КАЛЬЦИЙ СОДЕРЖИТСЯ В ГОРНЫХ ПОРОДАХ .
- 10. В солончаках и соленых озерах часто накапливается гипс Ca SO4*2H2O
- 11. Реки приносят в океан много кальция (0,04%), который концентрируется в скелетах организмов.
- 12. Он присутствует во всех тканях и жидкостях живых организмов.
- 13. Залежи кальция - в соляных наплывах
- 14. СТАЛАГМИТ
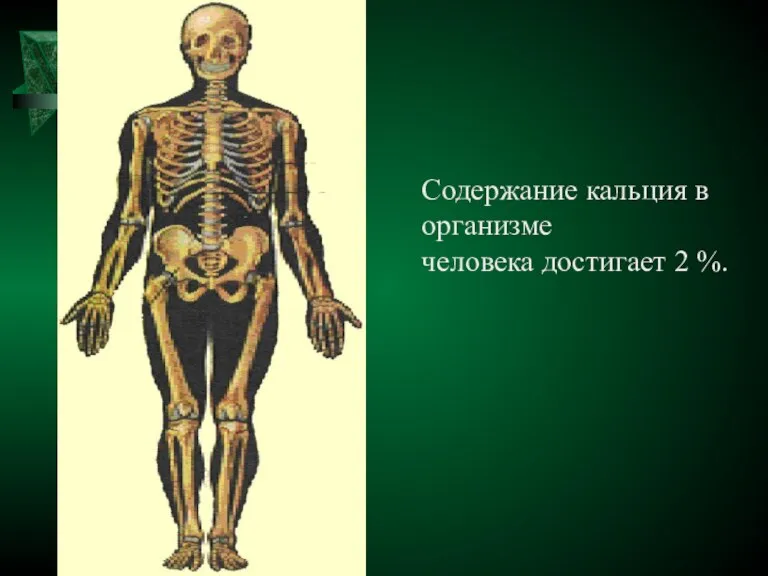
- 15. Содержание кальция в организме человека достигает 2 %.
- 16. СТАЛАГМИТ
- 17. Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
- 18. ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность –
- 19. Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо
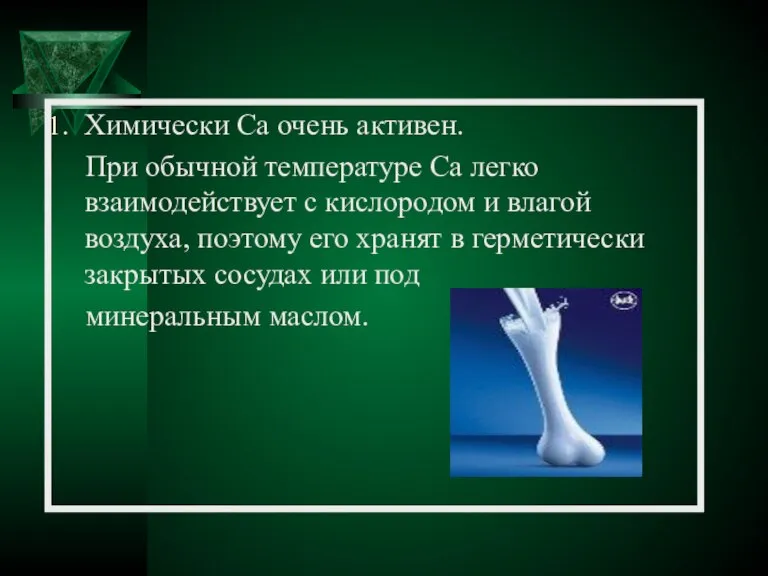
- 20. Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому
- 21. Кальций взаимодействие с простыми веществами – неметаллами. Ca + 2 C = CaC2 карбид кальция 2.
- 22. - С фтором реагирует на холоду: Са+|F2 = CaF2 -C хлором и бромом при температуре свыше
- 23. Трудно вступают в реакцию с азотом и фосфором: ЗСа + N2 = Са3N2 (нитрид магния) ЗСа
- 24. Получение и применение. В промышленности кальций получают двумя способами: 1.Нагреванием брикетированной смеси СаО и порошка Al
- 26. Скачать презентацию




















 Особенности погружения свай в мерзлые грунты
Особенности погружения свай в мерзлые грунты Кольцо Всевластия
Кольцо Всевластия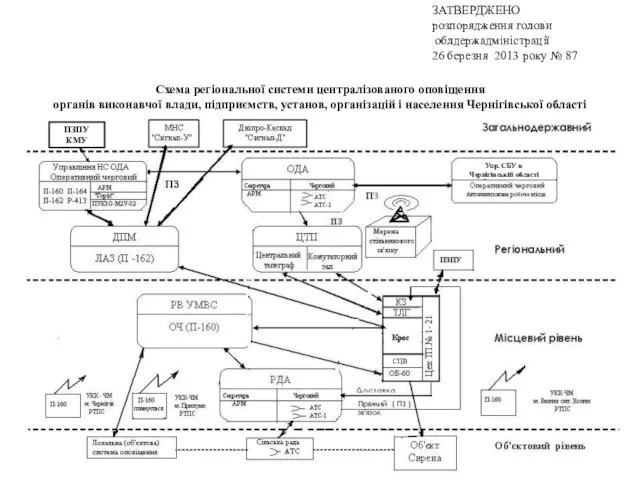 Схема регіональної системи централізованого оповіщення органів виконавчої влади, підприємств, установ
Схема регіональної системи централізованого оповіщення органів виконавчої влади, підприємств, установ Совместные программы, как инструмент интеграции российских вузов в европейское пространство высшего образования C.М. Яковлев, к
Совместные программы, как инструмент интеграции российских вузов в европейское пространство высшего образования C.М. Яковлев, к Transport Layer
Transport Layer  Педагогический советГОУ СОШ № 552
Педагогический советГОУ СОШ № 552 Акватории Московской области
Акватории Московской области Презентация на тему Поэма Гомера Илиада
Презентация на тему Поэма Гомера Илиада  Презентация на тему ПОЛЯРНЫЕ ЖИВОТНЫЕ
Презентация на тему ПОЛЯРНЫЕ ЖИВОТНЫЕ  Tuapse Refinery
Tuapse Refinery Приемы устного счета. Умножение
Приемы устного счета. Умножение Federalism timeline
Federalism timeline  Объединения. Отделение дополнительного образования детей на 2021-2022 учебный год. Начальная школа
Объединения. Отделение дополнительного образования детей на 2021-2022 учебный год. Начальная школа Сталинградская битва17 июля 1942 - 2 февраля 1943
Сталинградская битва17 июля 1942 - 2 февраля 1943 Требования к составлению основной общеобразовательной программы основного общего образования
Требования к составлению основной общеобразовательной программы основного общего образования Виды искусств
Виды искусств Пошив изделий по готовым выкройкам
Пошив изделий по готовым выкройкам О конкурсах Лучший в сфере потребительского рынка Ленинградской области в 2020 году
О конкурсах Лучший в сфере потребительского рынка Ленинградской области в 2020 году Процессоры
Процессоры КРК ЭТАЛОНКомплексные Решения Контроля
КРК ЭТАЛОНКомплексные Решения Контроля Память компьютера – совокупность устройств хранения информации
Память компьютера – совокупность устройств хранения информации History of London
History of London  Джаспер Моррисон. Биография и творческий путь
Джаспер Моррисон. Биография и творческий путь Цветовой круг. Цветотипы внешности
Цветовой круг. Цветотипы внешности АКТУАЛЬНО ВЫПУСКАЕМЫЕ ИЗДЕЛИЯ DIPLOMAT 2011 Ассортимент установок и кресел Дипломат Стоматологические установки: Стационарные Диплома
АКТУАЛЬНО ВЫПУСКАЕМЫЕ ИЗДЕЛИЯ DIPLOMAT 2011 Ассортимент установок и кресел Дипломат Стоматологические установки: Стационарные Диплома Люди взрослые, папы и мамы!Пообщайтесь с нами!Дети просят:Прочитайте нам сказки,Проверьте уроки.Дети ждут от вас ласки,Вы не будьте
Люди взрослые, папы и мамы!Пообщайтесь с нами!Дети просят:Прочитайте нам сказки,Проверьте уроки.Дети ждут от вас ласки,Вы не будьте  Грузовые автомобили Mercedes-Benz. Обозначение моделей и описание технологий
Грузовые автомобили Mercedes-Benz. Обозначение моделей и описание технологий ПОРТФОЛИОучителя начальных классовЛитвиновой Эльвиры Александровны
ПОРТФОЛИОучителя начальных классовЛитвиновой Эльвиры Александровны