Содержание
- 2. Тема: КИСЛОРОД. ОБЩАЯ ХАРАКТЕРИСТИКА. НАХОЖДЕНИЕ В ПРИРОДЕ. ПОЛУЧЕНИЕ
- 3. I.Кислород – химический элемент 1. Химический знак 2.Положение в периодической системе 3.Относительная атомная масса 4.Валентность 4.В
- 4. I.Кислород – химический элемент Химический знак – О Положение в период. Сист.- Z=8, 2 период, IVA-Группа
- 5. Содержание кислорода в природе Распространение элементов в природе (по массе, в %) 1 - кислород -
- 6. Кремний ( IV) оксиды– SiO2
- 7. Алюминий оксиды- Al2O3
- 8. Атмосфера 21 % кислорода (1\5 часть).
- 9. Чистая вода – 88,8 %, Лед – 85,8 %
- 10. Кислород – в организме Белки, жиры, углеводы, гормоны, ферменты
- 11. II.Кислород –простое вещество 1.Химическая формула - О2 2.Молекулярная и молярная массы Mr(О2)=32; М =32 г/моль. 3.Получение
- 12. Карл Шееле, Швеция 1772 год: «Атмосферный воздух состоит из двух частей: «огненный воздух» - поддерживает дыхание
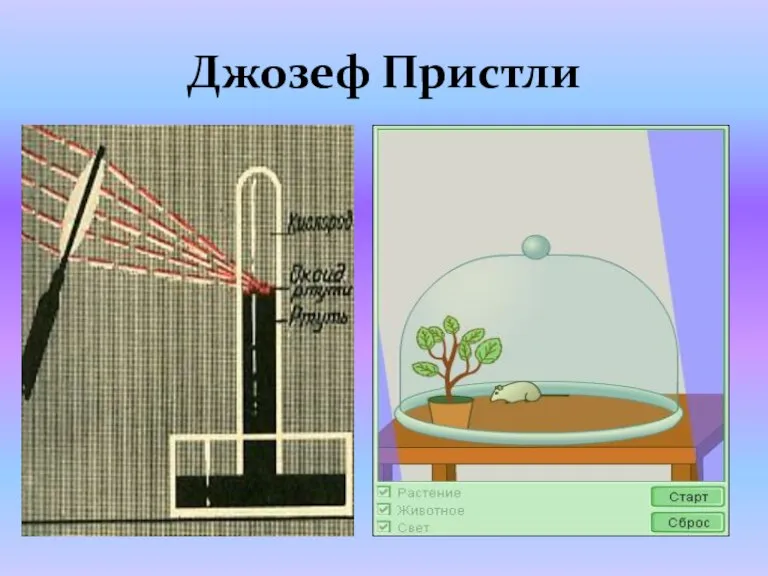
- 13. Джозеф Пристли, Англия, 1774 год Терекөмеш оксидын таркатып кислород таба 2HgO = 2Hg + O2
- 14. Джозеф Пристли
- 15. Антуан Лоран Лавуазье, Франция, 1777 год Подлинная природа этого газа была установлена во Франции. Название Oxygenium
- 16. Сказка 2 KMnO4 = K2MnO4 + MnO2 + O2 ↑ КМnO4 – перманганат калия ; 1-
- 17. Физические войства: Газ Без цвета, запаха, вкуса Малорастворим в воде Һавадан бераз авыр 32> 29 тяж.возд.
- 18. Химические свойства Реакции горения неметаллов С+ O2 = С O2 S + O2 = S O2
- 19. Химические свойства Реакции горения сложных веществ СН4+ 2O2 = СO2 + 2H2O СS2 + 3O2 =
- 21. Повторим 1. Охарактеризуйте кислород как химический элемент. 2.Где содержится кислород? 3. Кто открыл кислород? 4.Как получают
- 22. Задания для закрепления 1.Сколько молекул содержится в 2 моль кислорода? 2.В каком природном соединении больше кислорода
- 24. Скачать презентацию




















 Сладкий подарок Sweet Berry. Изготовим варенье с индивидуальным дизайном в подарок для Ваших клиентов и сотрудников
Сладкий подарок Sweet Berry. Изготовим варенье с индивидуальным дизайном в подарок для Ваших клиентов и сотрудников Презентация на тему Биосфера. Биомасса
Презентация на тему Биосфера. Биомасса Интегрированная автоматизированная система в САИ: повышение эффективности или увеличение затрат
Интегрированная автоматизированная система в САИ: повышение эффективности или увеличение затрат Неадекватные типы материнского отношения
Неадекватные типы материнского отношения Основное направление производства ЦЭО (цеха энергомашиностроительного оборудования) - выпуск различного нестандартизированного
Основное направление производства ЦЭО (цеха энергомашиностроительного оборудования) - выпуск различного нестандартизированного  Инженерные коммуникации в доме
Инженерные коммуникации в доме Методи оцінки та мінімізації кредитного ризику комерційного банку
Методи оцінки та мінімізації кредитного ризику комерційного банку Характеристика правосубьектности международных организаций
Характеристика правосубьектности международных организаций Всероссийский конкурс. Моя Родина - Россия
Всероссийский конкурс. Моя Родина - Россия Капризульки и упрямцы
Капризульки и упрямцы Успех
Успех Презентация на тему Повышение роли таможни в обеспечении доходов государственной казны
Презентация на тему Повышение роли таможни в обеспечении доходов государственной казны  Cake
Cake Договор финансовой аренды (лизинга)
Договор финансовой аренды (лизинга) Юбилей 20 лет. День музеев
Юбилей 20 лет. День музеев Светоносный элемент
Светоносный элемент НАБІР
НАБІР Искусство открывает новые грани мира
Искусство открывает новые грани мира f3b26e62f51149fdadc9e8df9f2c47c8
f3b26e62f51149fdadc9e8df9f2c47c8 Анализ и перспективы социально-экономического партнерства пивоваренной отрасли
Анализ и перспективы социально-экономического партнерства пивоваренной отрасли МЕТОДИЧЕСКИЙ СЕМИНАР
МЕТОДИЧЕСКИЙ СЕМИНАР Электроэнергетика России
Электроэнергетика России Двойные звезды. Масса звезд
Двойные звезды. Масса звезд Презентация на тему Показательная функция, ее свойства и график
Презентация на тему Показательная функция, ее свойства и график Методические указания для выполнения задания очного тура в номинации «Сетевые системы»
Методические указания для выполнения задания очного тура в номинации «Сетевые системы» Моё электронное портфолио
Моё электронное портфолио Состав ПСПО
Состав ПСПО Титул
Титул