Содержание
- 2. Содержание Стр.
- 3. Аллотропия фосфора Фосфор белый Источник информации
- 4. Аллотропия фосфора Фосфор красный Источник информации : не имеет
- 5. Аллотропное превращение красного фосфора Источник Р Р4
- 6. Природные соединения фосфора Апатит Источник информации : Описание минерала
- 7. Природные соединения фосфора Вивианит Источник информации : Описание минерала Fe3(PO4)2·8H2O Бесцветный, зелёный, голубой, тёмно-зелёный, голубовато-зелёный
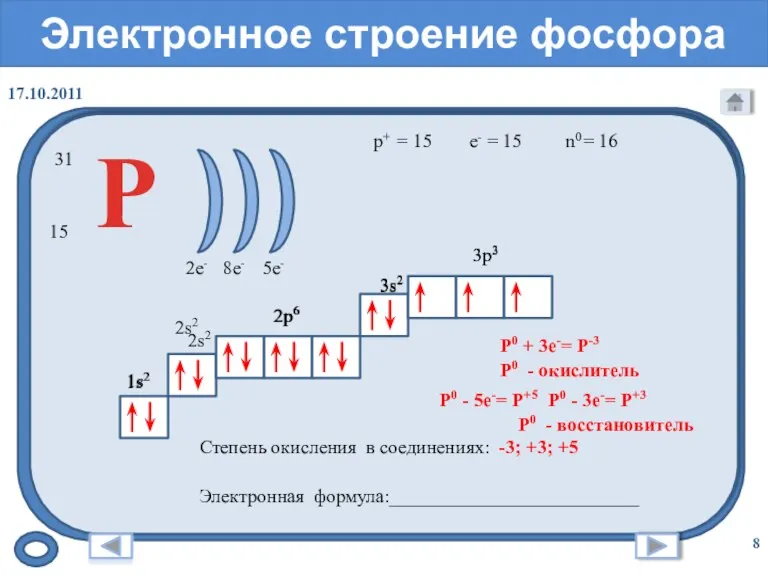
- 8. Электронное строение фосфора = 15 31 15 = 16 p+ n0 e- = 15 Р 2e-
- 9. Химические свойства фосфора Взаимодействие с металлами: 3Mg + 2P = 2 Mg3P2 3Сa + 2P =
- 10. Химические свойства оксида фосфора (V) Взаимодействие с водой: P2O5 + H2O H3PO4 Взаимодействие с кислотой: P2O5
- 11. Химические свойства фосфорной кислоты Взаимодействие с металлами: Mg + H3PO4 Mg3 (PO4)2 + H2 Взаимодействие с
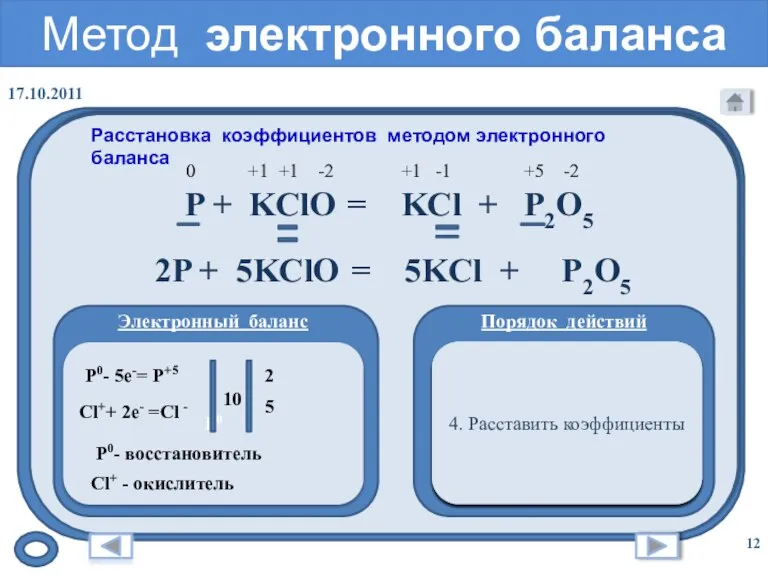
- 12. Метод электронного баланса Расстановка коэффициентов методом электронного баланса Электронный баланс Порядок действий 1. Расставить степени окисления
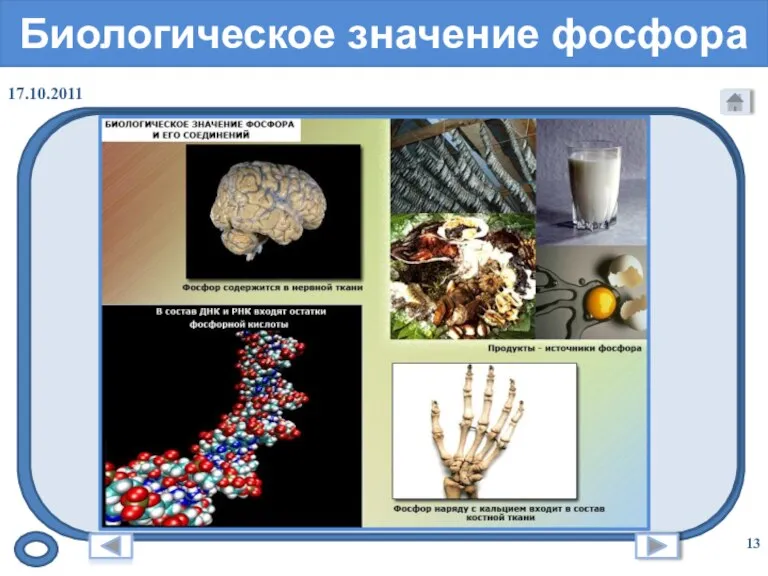
- 13. Биологическое значение фосфора
- 15. Скачать презентацию









 ZACT (новая металлизированная упаковка)
ZACT (новая металлизированная упаковка) Акупунктурный электромассажер для ухода за телом Исюэтун
Акупунктурный электромассажер для ухода за телом Исюэтун Викторина «Весенняя капель»
Викторина «Весенняя капель» Ледяное Царство Зона арктических пустынь
Ледяное Царство Зона арктических пустынь С юбилеем Зилара Адисовна
С юбилеем Зилара Адисовна Спелеология
Спелеология Архитектура западноевропейского средневековья
Архитектура западноевропейского средневековья Предпринимательство и бизнес
Предпринимательство и бизнес Золотой ключик или приключения Буратино. Диафильм
Золотой ключик или приключения Буратино. Диафильм Презентация на тему Строчная и заглавная буквы Ц, ц
Презентация на тему Строчная и заглавная буквы Ц, ц Образовательный проект Профильная четверть
Образовательный проект Профильная четверть Презентация на тему Что такое сквернословие и как с ним бороться
Презентация на тему Что такое сквернословие и как с ним бороться Былины
Былины Круглый стол «НАРКОМАНИЯ - ДОБРОВОЛЬНОЕ САМОУБИЙСТВО?» По модулю «Граждановедение» Я.В. Соколова
Круглый стол «НАРКОМАНИЯ - ДОБРОВОЛЬНОЕ САМОУБИЙСТВО?» По модулю «Граждановедение» Я.В. Соколова СИУ
СИУ Доходность акций
Доходность акций Номинация №4«Здоровьесберегающие технологии на уроках МХК»
Номинация №4«Здоровьесберегающие технологии на уроках МХК» Стимуляция роста и контроль заболеваемости растений с помощью универсального биологического средства защиты.
Стимуляция роста и контроль заболеваемости растений с помощью универсального биологического средства защиты. Презентация на тему Ателье по пошиву изделий. Пошив наволочек
Презентация на тему Ателье по пошиву изделий. Пошив наволочек Биссектриса угла
Биссектриса угла Развитие акушерства и гинекологии в России
Развитие акушерства и гинекологии в России Новое поколение тракторов КИРОВЕЦ К-7М
Новое поколение тракторов КИРОВЕЦ К-7М Разнообразие животных
Разнообразие животных Мастерская БольшеЧемЕГЭ. Повышение уровня сдачи ВПР, ОГЭ, ЕГЭ
Мастерская БольшеЧемЕГЭ. Повышение уровня сдачи ВПР, ОГЭ, ЕГЭ Встреча кандидата с населением
Встреча кандидата с населением Презентация на тему Религия
Презентация на тему Религия Национальные Парки США и Великобритании
Национальные Парки США и Великобритании Предложения ARQA Technologies для брокеров Владимир Курляндчик Директор по развитию, ARQA Technologies
Предложения ARQA Technologies для брокеров Владимир Курляндчик Директор по развитию, ARQA Technologies